Al-Ti-B4C-TiH2系燃烧合成反应制备泡沫铝合金的热力学研究
2014-08-10张治民王录才
王 芳, 张治民,王录才,吕 猛,朱 亮
(1.中北大学 材料科学与工程学院,太原 030051; 2.太原科技大学 材料科学与工程学院,太原 030024)
Al-Ti-B4C-TiH2系燃烧合成反应制备泡沫铝合金的热力学研究
王 芳1,2, 张治民1,王录才2,吕 猛2,朱 亮2
(1.中北大学 材料科学与工程学院,太原 030051; 2.太原科技大学 材料科学与工程学院,太原 030024)
利用燃烧合成技术在制备多孔材料方面有其独特的优势,基于Al-Ti-B4C-TiH2系燃烧合成反应制备泡沫铝。通过燃烧过程中的反应放热量、燃烧温度、原料配比临界条件的理论计算及DSC曲线分析对Al-Ti-B4C-TiH2系燃烧合成反应进行热力学研究。实验结果表明: Al-Ti间、Ti-B4C间反应分别在800℃及1 300℃左右发生,首先Al-Ti间反应,随着反应放热量的增加Ti-B4C间反应被激活,大量剩余的Ti优先与B4C反应直至无B4C存在,剩余的Ti再与Al反应,Al-Ti间反应的最终产物应为TiAl3。原料中的TiH2受热分解释放出气体迫使预制体膨胀得到泡沫铝。原料配比的临界条件中Al的质量分数为76%,且生成物中Al相质量分数为68.8%。
泡沫铝;燃烧合成反应;反应热;燃烧温度
泡沫铝由于其较高的孔隙率,制备工艺简单,比强度高,具备众多功能,而被广泛应用于民用、机械、交通、化工、通讯、建筑等领域,其制备工艺可以分为液态处理、固态处理、水溶液电沉积、气相发泡等四大类[1-5]。目前商业生产中常用的制备工艺主要有[6]熔体发泡法、渗流法、熔模铸造法及粉末冶金法。相较传统制备技术,燃烧合成在制备多孔材料方面有其独特的优势[7]: 可以最大限度地利用材料合成中的反应化学能,节约能源;由于燃烧产生高温,低沸点物质气化,试样内部产生微小孔洞使得产物本身具有一定的孔隙率。
目前利用燃烧合成反应技术制备多孔材料的应用主要集中在多孔陶瓷、多孔金属间化合物方面[7-10]。随着燃烧合成制备技术的不断成熟及完善,利用燃烧合成制备技术制备泡沫铝为泡沫铝的制备工艺开辟了新的道路。本文采用基于Al-Ti-B4C-TiH2系热爆式燃烧合成反应制备泡沫铝,对Al-Ti-B4C-TiH2系燃烧合成反应进行热力学研究。
1 实验过程
试验所需原料粉末的主要参数如表1所示。

表1 原料粉末
试样制备过称为:将原料混合均匀,其中Al、Ti、B4C摩尔配比分别为9∶4∶1,10∶4∶1,17∶4∶1,发泡剂添加量为2%,在压强为203 MPa冷压制备∅10 mm的圆柱状坯样,通过对预制体试样进行DSC曲线分析及计算各反应的反应吉布斯自由能,研究Al-Ti-B4C-TiH2系燃烧合成反应的反应机制、燃烧温度及反应的原料摩尔配比临界值。
2 结果及分析
2.1Al-Ti-B4C-TiH2系燃烧合成反应的反应机制
2.1.1DSC曲线分析
图1、图2和图3中,均发现有两个明显的放热峰:800℃左右、1 300℃左右。三个曲线图对比可以发现,在两个放热峰的单位质量的放热量由大至小依次为:原料摩尔配比为9∶4∶1,10∶4∶1,17∶4∶1的预制体坯样。
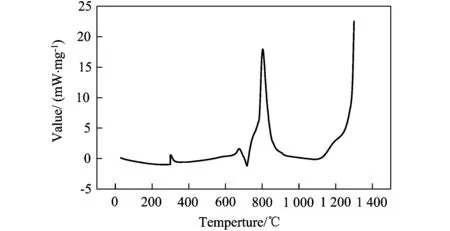
图1 原料摩尔配比为10∶4∶1的试样的DSC曲线分析

图2 原料摩尔配比为17∶4∶1的试样的DSC曲线分析
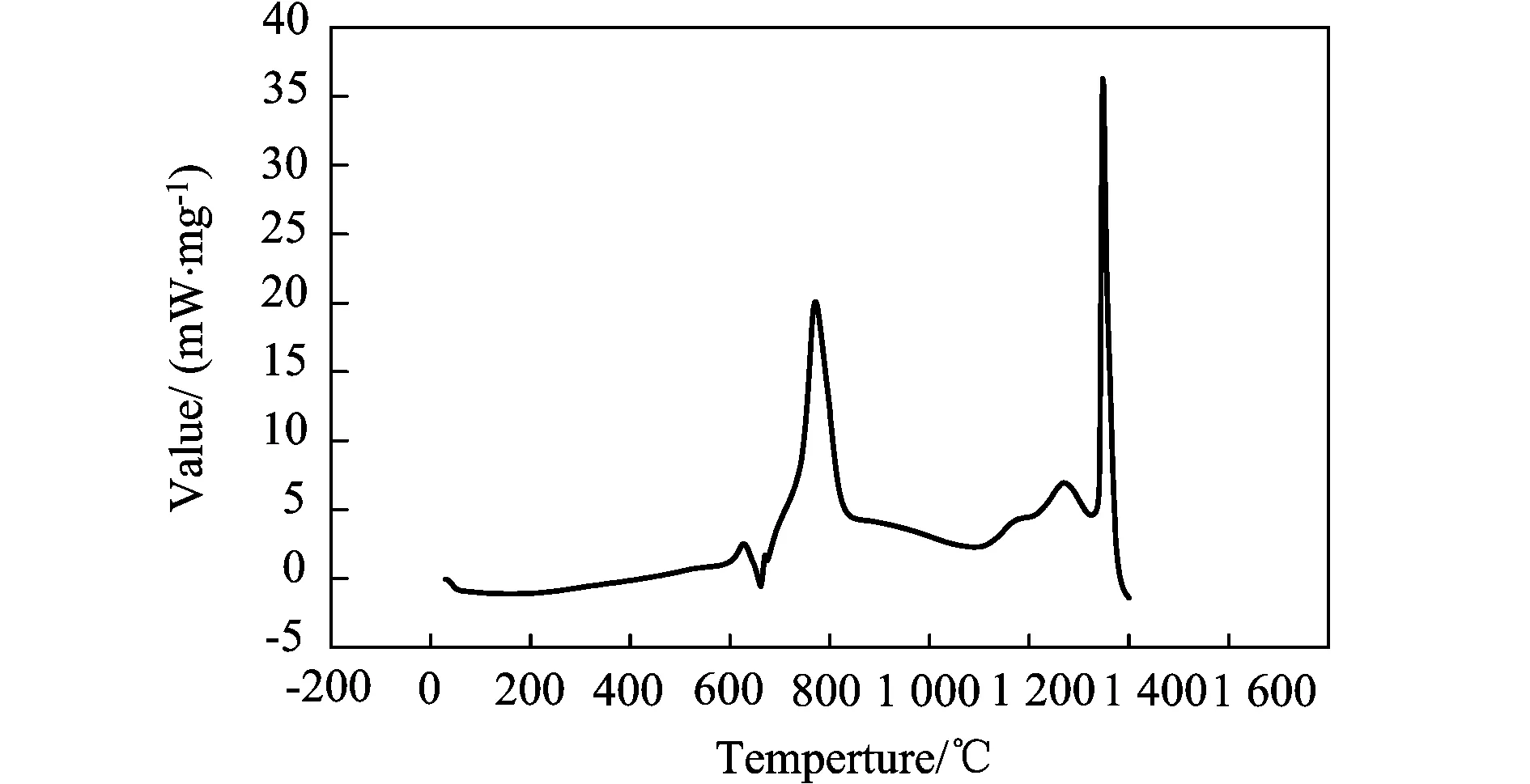
图3 原料摩尔配比为9∶4∶1的试样的DSC曲线分析
大连理工大学的张俊善[11]等人通过对Ti、Al粉压制坯样的DSC曲线分析研究了Ti-Al3系燃烧合成反应的动力学,发现Ti-Al间的反应温度区间在700~800℃。可以判断,在800℃左右有一放热峰为Ti-Al之间的反应,在1 300℃~1 400℃左右有一放热峰,为Ti-B4C之间的反应。即Al-Ti间反应的激活能要小于Ti-B4C间反应的激活能,首先被激发的化学反应应为Al-Ti反应。
Pavel novak[12]等人通过DTA、XRD及光学显微镜等检验手段,对Ti-Al系燃烧反应的反应机制与动力学进行了研究,发现在Ti-Al系SHS反应过程中会产生TiAl3和TiAl相,并最终会转变为TiAl3相。所以,Al-Ti-B4C-TiH2系燃烧合成反应方程如式(1)、(2)、(3):
TiH2→ Ti+H2;
(1)
3Al+Ti → TiAl3,ΔG1;
(2)
3Ti+B4C → TiC+2TiB2,ΔG2.
(3)
式中:ΔG1为Al-Ti反应的反应吉布斯自由能;ΔG2为Ti-B4C反应的反应吉布斯自由能。
2.1.2反应吉布斯自由能的计算
对多元体系,由于反应物不唯一,SHS反应按自由能最低的方向进行的可能性最大。对于本体系燃烧合成反应,当Al-Ti间反应和Ti-B4C间反应同时被激活时,认为燃烧合成反应按照吉布斯自由能最低的方向进行。因此计算Al-Ti反应及Ti-B4C反应的反应吉布斯自由能。
反应吉布斯自由能的计算公式为式(4)和(5):
(4)

(5)

由于本反应体系主要存在两个反应即:Al-Ti间反应、Ti-B4C间反应,而两个反应发生的温度区间分别为800,1 300℃,故计算了Al-Ti间、Ti-B4C间的反应吉布斯自由能在1 000~1 600 K的值,如表2所示。

表2 不同温度下反应吉布斯自由能的计算值[13]
由表2的计算值可以得到在1 000~1 600 K温度区间内,Ti-B4C反应的反应吉布斯自有能均小于Al-Ti的。即当两反应均被激活时,优先向Ti-B4C反应的方向进行,Ti优先参与与B4C的反应。
本体系燃烧合成反应的反应机制:首先被激活的反应应为Al-Ti间反应,随着反应放热量的增加Ti-B4C间反应被激活大量剩余的Ti优先与B4C反应直至无B4C存在,剩余的Ti再与Al反应。而Al-Ti间反应的最终产物应为TiAl3。
2.2 绝热燃烧温度的计算
由基尔霍夫定律[14]可得到绝热温度的计算公式(6):

(6)
式中:T0为反应体系的初始温度;Tad为反应体系的绝热燃烧温度;cp为反应物及产物的热容;ni为反应物及产物的物质的量。
AlTi-B4C系燃烧合成制备泡沫铝,其燃烧过程中总的反应方程式可以表示为:
3Al+4Ti+B4C →TiAl3+TiC+2TiB2.
(7)
Al-Ti-B4C-TiH2体系的所有可能发生的反应方程式为:
3Al+Ti → TiAl3,
ΔrH1=-142.2 kJ/mol;
(8)
3Ti+B4C→TiC+2TiB2,
ΔrH2=-760.2 kJ/mol;
(9)
TiH2→Ti+H2,
ΔrH3=144.3 kJ/mol.
(10)
反应体系所放出的全部热量:Al与Ti,Ti与B4C两反应所放出的热量
Qput=-{n(B4C)×ΔrH2+[n(Ti)+n(TiH2)-3n(B4C)]×ΔrH1}.
(11)
式中:ΔrH2为Ti与B4C之间反应的反应焓;ΔrH1为Al与Ti之间反应的反应焓。
由于试样的预热温度为1 000℃,故反应时Al已经融化TiH2也已分解这两部分所需的热量由加热炉提供不需反应放热量。
反应体系所吸收的热量:

cp(TiB2)+(n(Ti)+n(TiH2)-3n(B4C))×
cp(TiAl3)+[n(Al)-6(n(Ti)+n(TiH2)-
3n(B4C))]×cp(Al)-(n(Ti)+n(TiH2))×
cp(Ti)-n(B4C)×cp(B4C)}.
(12)
式中:T0为试样整体的预热温度;Tad为燃烧合成反应体系的绝热燃烧温度。
根据绝热反应的特点,得到等式:
Qsuc=Qput.
即:
-{n(B4C)×ΔrH2+
[n(Ti)+n(TiH2)-
3n(B4C)]×ΔrH1}=

cp(TiB2)+(n(Ti)+n(TiH2)-
3n(B4C))×cp(TiAl3)+
[n(Al)-6(n(Ti)+n(TiH2)-3n(B4C))]×
cp(Al)-(n(Ti)+n(TiH2))×cp(Ti)-
n(B4C)×cp(B4C)}.
(13)
根据上式计算,在热爆模式中,Ti∶B4C为4∶1系燃烧合成反应的理论燃烧温度如表3所示。
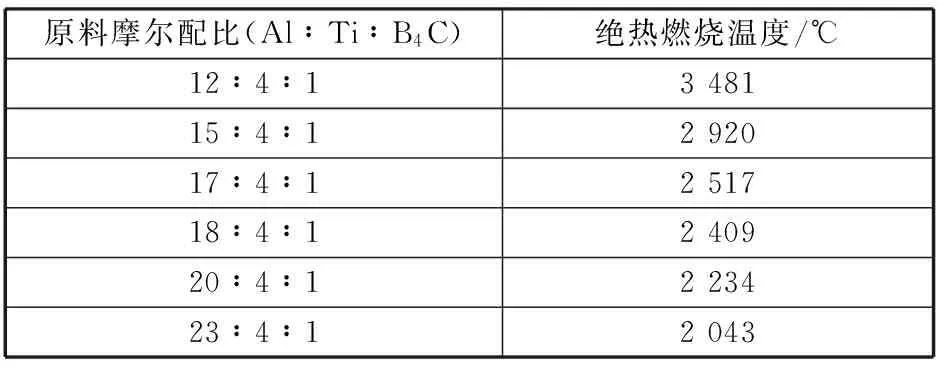
表3 Ti∶B4C比例为4∶1系列的热爆式反应的绝热燃烧温度
由表可知,原料摩尔配比为12∶4∶1的预制体燃烧合成反应结束后燃烧产物中TiC 及TiB2呈液相存在;原料摩尔配比为15∶4∶1的,燃烧产物中存在液相的TiB2,但热量不足以将TiB2完全融化,因此绝热燃烧温度为TiB2的熔点2 920℃;其余的原料配比的燃烧产物中除剩余的铝呈液相外其余均为固相。
2.3 原料摩尔配比临界条件的计算
燃烧合成法制备泡沫铝的关键在于保证燃烧合成反应能够持续进行的前提下得到含Al质量分数高的泡沫铝。但是随着Al质量分数的升高反应放热量减少,甚至当Al质量分数过高时,反应放热量无法维持体系燃烧反应的持续进行。理论上Al质量分数存在一个最高值,此时该反应体系所放出的热量恰好能够维持反应的进行且保证试样发泡。
临界条件:反应放出的热量恰好使反应体系的温度达到Al的熔点(933 K)从而得到泡沫铝。
如下式所示:
Qsuc=Qput.
即:

ΔrHm(TiH2)=-ΔrHm.
(14)
在计算这个临界条件之前,还要固定Ti与B4C的比例(选用前期试验较为理想的原料配比即:B4C与Ti摩尔比例为1∶4系列),预制体试样总质量为50 g。
结合反应方程式(7)、(8)、(9)、(15)、(16):
3Al+4Ti+B4C→TiAl3+TiC+2TiB2,
ΔrHm=-902 498 J/mol;
(15)
Al(S)→Al(L),
ΔfusH(Al)=10 711 J/mol.
(16)
设B4C的物质的量为xmol,根据上述假设、反应方程式及临界条件,可以得到下式通过公式(17)可以计算出原料的摩尔比例。
计算公式为:
Qsuc=Qput
即:
(17)
式中,
(18)
式中:ΔfusH(Al)为铝的熔化焓,ΔrHm,3为TiH2分解反应的反应焓,ΔrHm三元反应体系的反应焓,Qput1为TiH2分解后Ti参与反应的净放热量。
计算结果:
x=0.045 2 mol,原料配比含Al质量分数76.0%。临界条件下热爆式燃烧合成产物中生成物相存在状态及成分(占的质量分数)为: Al(l)为68.8%、TiB2(S)为12.3%、TiC(S)为5.3%、TiAl3(S)为13.5%。
3 结论
1) Al-Ti-B4C-TiH2热爆式燃烧合成制备泡沫铝工艺可行。
2) 通过对试样的DSC曲线分析和反应吉布斯自由能计算,得出体系燃烧合成反应的反应机制:首先被激活的反应应为Al-Ti间反应,随着反应放热量的增加Ti-B4C间反应被激活大量剩余的Ti优先与B4C反应直至无B4C存在,剩余的Ti再与Al反应。而Al-Ti间反应的最终产物应为TiAl3。
3) 绝热燃烧温度及原料配比临界条件的计算结果表明,原料配比的临界条件中Al的质量分数为76%,且生成物中Al相质量分数为68.8%。
[1] Ashby M F, Evans AG, Fleck N A, et al.Metal Foams:A Design Guide[M]. Boston:B-H Press,2000:1-5.
[2] 戴长松, 张亮, 王殿龙, 等. 泡沫材料的最新研究进展[J]. 稀有金属材料与工程, 2005,34(3):337-340.
[3] 于英华,梁冰,李智超. 多孔泡沫金属研究现状及分析[J]. 青岛建筑工程学院学报, 2003(6):15-19.
[4] 刘培生.多孔材料引论[M].北京: 清华大学出版社 2004:2-55.
[5] 刘菊芬,刘荣佩,史庆南,等.新型泡沫铝制备工艺研究[J].材料导报,2002,8:65-67.
[6] 刘培生,陈祥.泡沫金属[M].长沙:中南大学出版社,2012.
[7] Varma Arvind, Lebrat J P. Combustion synthesis of advanced material[J]. Chemical Engineering Science,1992,47(9-11):2179-2194.
[8] 沈培智, 高麟, 高海燕等. FeAl金属间化合物多孔材料高温硫化性能及应用[J]. 粉末冶金材料科学与工程, 2010,15(1):38-43.
[9] M Kobashi, N Kanetake, K Kudo. Self-sustainable blowing process of Al-Ni intermetallic foam by combusing reaction[C]∥Proceedings of the Fifth International Conference on Porous Metals and Metallic Foams. Montreal, Canada, 2007:107-110.
[10] Atsushi Makino, Naohiro Shibata. Effects of dominant parameters on burning velocity and range of flammability in SHS process for Ti-Al system [J]. JSME International Journal Series B, 2006,49(3):856-863.
[11] 张俊善,汪涛,祝美丽,等. 燃烧合成TiAl3化学反应动力学研究[J]. 金属学报,2002,38(10):1027-1030.
[12] Patel Novak, Jiri Kubasek, Jan Serak et al. Mechanism and kinetics of the intermediary phase formation in Ti-Al and Ti-Al-Si systems during reactive sintering [J]. International Journal of Materials Research, 2009,100(3):353-355.
[13] 叶大伦,胡建华. 实用无机物热力学数据手册[M]. 北京:冶金工业出版社,2002.
[14] 傅鹰.化学热力学导论[M].科学出版社2010:1-371.
(编辑:刘笑达)
ThermodynamicStudyofAl-Ti-B4C-TiH2ReactionforPreparingAluminumFoam
WANGFang1,2ZHANGZhimin1,WANGLucai2,LÜMeng2,ZHULiang2
(1.SchoolofMaterialsScienceandEngineering,NorthUniversityofChina,Taiyuan030051,China;2.SchoolofMaterialsScienceofTechnology,TaiyuanUniversityofScienceandTechnology,Taiyuan030024,China)
Combustion Synthesis (CS) has its unique advantages in the preparation of porous materials. In this paper, the aluminum foam was produced by Al-Ti-B4C-TiH2reaction. The thermodynamics of Al-Ti-B4C-TiH2reaction was researched by the theoretical calculations of combustion temperature, critical condition and released heat. DSC curve analysis results show that the reaction temperature between Al-Ti and Ti-B4C was 800℃ and 1 300℃,respectively.Al and Ti reacted firstly, then the reaction heat caused the reaction of Ti and B4C. The residual Ti reacted with Al to form TiAl3. The powder of TiH2was heated to release gas to make the precursor expansion. The mass fraction of aluminum in the raw material ratio and combustion products reached to 76% and 68.8%,respectively.
aluminum foam;combustion synthesis reaction;heat of reaction;ignition temperature
2013-08-02
王芳(1972-),男,山西翼城人,副教授,博士,主要从事多孔金属制备工艺及性能研究,(Tel)18234112488
1007-9432(2014)01-0037-05
TF72
:A
