不同灸法对实验类风湿性关节炎模型滑膜细胞NF-κB信号通路的影响
2014-08-09杨涵棋周海燕钟振东刘旭光
吴 菲,杨涵棋,张 耀,杨 馨,周海燕,钟振东,刘旭光
(成都中医药大学,成都 610075)
滑膜炎症是类风湿性关节炎(RA)的关键病理环节,滑膜细胞功能异常在炎症中占据核心地位,并依赖于滑膜细胞内复杂的炎症信号通路进行分子信号传导。其中,NF-κB、MAPK、JAK-STAT通路是细胞内3条重要的信号传导通路,在RA的炎症反应中起着极其重要的作用。前期的实验研究表明,艾灸对实验性RA家兔滑膜细胞MAPK信号通路[1]和JAK-STAT通路[2]的异常激活有明显抑制作用。本实验通过观测不同灸法对RA模型关节滑膜组织NF-κBp65、NF-κBp50、IKK表达的影响,探索不同灸法抗炎作用的NF-κB信号通路机制。
1 实验材料
日本大耳兔40只,体质量(2.5±0.25) kg,雌雄各半,由成都中医药大学动物实验中心提供。动物在实验前适应性驯养1周,分性别按体质量分层随机分组。福氏完全佐剂(Freund’s Complete Adjuvant,FCA),美国sigma公司生产,购自上海生工。艾绒为中国南阳市东升艾绒厂生产。兔多克隆一抗试剂盒:NF-κBp50(CST,美国),NF-κBp65(博奥森,北京),IKK(博奥森,北京);二抗:1)生物素化山羊抗兔IgG(H+L);2)生物素化山马抗小鼠IgG(H+L);三抗:辣根过氧化酶标记链霉素卵蛋白(HRP/A-V);二抗三抗及DAB显色试剂盒均购自北京中杉金桥公司。TSJ-Q型全自动封闭式组织脱水机;切片机(徕卡-2015,德国);Motic BA400显微摄像系统(麦克奥迪公司);BMJ-Ⅲ型包埋机、PHY-Ⅲ型病理组织漂烘仪(常州市中威医疗仪器有限公司);Image-Pro Plus图像分析系统(Media Cybernetics,Inc.)等。
2 实验方法
2.1 实验分组 将40只日本大耳白兔按性别、体质量分层随机分为5组:空白对照组、RA模型组、温和灸治疗组、直接灸治疗组、隔姜灸治疗组,每组8只。
2.2 RA造模 除对照组以外,于实验开始第1天,参照文献[3]对其余各组家兔双侧后肢膝关节常规消毒处理后,以髌骨下缘膑韧带外测的凹陷处为穿刺注射点,将福氏完全佐剂(FCA)按0.5 mL/kg体质量平均注入双后肢膝关节腔内,塑造家兔佐剂性关节炎,对照组采用相同方法注入无菌生理盐水作为对照。
2.3 艾灸治疗 造模后第7天,将各艾灸组家兔固定于兔架上,暴露背部及膝关节(治疗穴位部位剃毛约2 cm×2 cm),参照《实验针灸学》的动物穴位图谱定位出“肾俞”“足三里”2穴,用艾绒自制成小艾炷(直径4 mm,长度10 mm)分别直接灸、隔姜灸(鲜姜片厚度约为1 mm)、温和灸(距离皮肤约5 mm)家兔“肾俞”“足三里”穴各5壮,两侧交替进行,1次/d,6 d为1个疗程,共3个疗程,疗程之间休息1 d。对照组和模型组家兔同法固定,但不进行艾灸治疗。
2.4 标本取样及处理 艾灸治疗后第21天,经耳缘静脉注射空气处死各组家兔,沿双后膝关节正中纵行切开皮肤直至暴露出以膝关节为中心约3 cm×3 cm的区域,用齿镊提起膑骨,沿膑骨上沿约0.3~0.4 cm处向下切割直至股骨,再分别沿膑骨两侧向下分离至胫骨,可见由膑骨下极向上延续有一层平滑光亮呈淡黄色的滑膜组织。完整剥离滑膜组织,最后用眼科镊轻轻夹住其游离端,用刀片完整切下。同法采集另一侧膝关节滑膜组织。组织离体后立即放入4%甲醛液中固定保存待测。
2.5 指标检测方法 用S-P免疫组化法检测滑膜组织的NF-κBp65、NF-κBp50、IKK含量。石蜡切片,常规脱蜡15 min;混合1份30%H2O2+10份蒸馏水后灭活内源性酶(室温10 min),蒸馏水重复洗3次;抗原热修复,自然冷却至室温后用PBS(PH7.2~7.6)洗涤2次;滴加5%BSA封闭液,室温20 min,甩去多余液体,不洗;滴加NF-κBp65一抗(稀释度1∶125)、NF-κBp50一抗(稀释度1∶150)、IKK一抗(稀释度1∶100);4 ℃孵育过夜,PBS洗5 min×3次;滴加生物素标记的二抗,37 ℃孵育30 min,PBS洗5 min×3次;滴加试剂S-V/HRP30 min(37 ℃),PBS洗5 min×4次;显色剂显色,蒸馏水洗涤;苏木素轻度复染,脱水,透明,封片,显微镜观察。用PBS液代替一抗做为阴性对照。
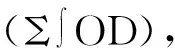
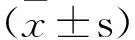
3 结果
不同灸法对RA模型关节滑膜组织NF-κBp65、NF-κBp50和IKK积分灰度值的影响,见表1。
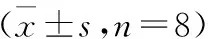
表1 不同灸法对RA模型关节滑膜组织NF-κBp65、NF-κBp50和IKK积分灰度值的影响
注:与空白组比较,○○P<0.01;与模型组比较,▲▲P<0.01;与温和灸组、直接灸组比较,★P<0.05
4 讨论
RA是一种以持续性的关节滑膜炎症为特征的慢性全身性自身免疫性疾病[4]。滑膜细胞在滑膜炎症过程中始终处于核心地位,滑膜细胞分泌的细胞因子绝大多数是低分子量的多肽或糖蛋白,它必须和靶细胞表面相应的受体结合后,激活特定的信号传导通路才能发挥其调节细胞生长、分化、增殖、免疫应答、参与炎症反应等多种生物学效应。因此,近年来滑膜细胞信号传导通路及滑膜细胞的增殖信号对核内相关基因表达的调控备受关注。已有研究表明:NF-κB在RA的滑膜细胞中广泛表达,与其调控的细胞因子一起共同参与了关节滑膜炎症及其损伤反应等病理进程,在RA的发病中起关键作用[5-9]。
艾灸能有效调控实验性RA滑膜细胞的分泌功能,抑制滑膜炎症发展[10-13]。本实验结果显示:与模型组比较,各艾灸治疗组NF-κBp65、NF-κBp50和IKK积分灰度值明显降低(P<0.05),提示不同灸法对NF-κBp65、NF-κBp50和IKK的蛋白表达都有抑制作用,艾灸可能通过降低IKK活性对NF-κB通路进行有效调控。 此外,还发现隔姜灸在抑制NF-κBp65、NF-κBp50和IKK表达方面比温和灸、直接灸更为明显,推测其原因可能与不同灸法具有不同的温热刺激模式有关,而不同温热刺激模式引起NF-κB信号通路相关分子不同表达的相关机制有待进一步深入研究。
[1]杨馨,杨慎峭,周海燕,等.艾灸对实验性RA家兔滑膜细胞MAPK信号通路影响的研究[J].中华中医药学刊,2007,25(3):470-474.
[2]杨馨,李继书,杨慎峭,等.艾灸对实验性类风湿性关节炎家兔滑膜细胞JAK-STAT信号通路影响的研究[J].针刺研究,2007,32(2):75-82.
[3]陈奇.中药药理实验方法学[M].北京:人民卫生出版社,1994:68.
[4]李强,任丽娅.类风湿关节炎的中医药治疗进展[J].吉林中医药,2004,24(3):52-53.
[5]古正涛,沈鹰.NF-κB对类风湿性关节炎发病作用的研究进展[J].广东医学,2008,29(9):1576-1578.
[6]李小鹰,王炳银.心血管疾病分子生物学[M].北京:人民军医出版社,2000:220.
[7]AHN K S,SETHI G,AGGARWAL B B.Nuclear factor-kappa B:from clone to clinic[J].Current Molecular Medicine,2007,7(7):619.
[8]HAYDEN M S,GHOSH S.Shared principles in NF-κB signaling[J].Cell,2008,132(3):344-362.
[9]WHITESIDE S T,ISRA?L A.I kappa B proteins:structure,function and regulation[J].Seminars in Cancer Biology,1997,8(2):75.
[10]高骏,刘旭光,黄迪君,等.持续光照对艾灸调控类风湿性关节炎大鼠褪黑激素与类风湿性关节炎血浆IL-1β、IL-4水平的影响[J].辽宁中医杂志,2011,38(8):1677-1680.
[11]唐照亮,宋小鸽,章复清,等.艾灸治疗类风湿性关节炎抗炎免疫作用机理的研究[J].针刺研究,2003,28(4):292.
[12]杨涵棋,刘旭光,杨馨,等.不同灸法对类风湿性关节炎家兔肿胀关节及滑膜液中白介素-1、肿瘤坏死因子-α表达的影响[J].针刺研究,2013,38(2):134-139.
[13]杨涵棋,刘旭光,张耀,等.不同灸法对实验性RA模型IL-6、IL-8、MCP-1表达影响的研究[J].中华中医药学刊,2012,30(12):2625-2627.
