失血性休克后的肠淋巴液提高血管通透性的作用*
2014-08-09孙改霞郭亚雄杜会博张立民赵自刚刘圣君牛春雨
孙改霞, 郭亚雄, 杜会博, 张立民, 赵自刚, 刘圣君, 牛春雨
(河北北方学院微循环研究所,河北 张家口 075000)
血管通透性增高是重症休克患者出现组织水肿、引起毛细血管渗漏综合征、进而加重组织细胞缺氧和微循环障碍的关键环节[1]。因此,探讨重症休克血管通透性增高的发生机制,并以此针对相关靶点探求重症休克的干预措施,是当前防治重症休克的重点研究课题。研究表明,失血性休克后的肠淋巴液(post-hemorrhagic shock mesenteric lymph, PHSML)回流是器官损伤的一个关键环节[2-3];肠淋巴液在重症休克血管高通透性中的作用值得关注。为此,本文目的在于从整体动物模型入手,观察PHSML引流对失血性休克大鼠肝、肾、心肌、肺、脾、小肠等组织血管通透性的作用;并进一步观察引流至体外的PHSML对人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)通透性的作用,阐明PHSML与血管高通透性的关系。
材 料 和 方 法
1 动物与分组
健康、SPF级Wistar雄性大鼠18只(中国军事医学科学院实验动物中心)经过适应性饲养后用于本实验,体重 220~260 g。实验前12 h禁食、自由饮水,随机均分为:假手术组 (sham)、休克组 (shock)和休克+引流组 (shock+ drainage)。实验过程中动物处置方法符合伦理学规范。
2 失血性休克模型复制与肠淋巴液引流
所有大鼠经乙醚诱导、戊巴比妥钠 (50 mg/kg;Merck) 注射全身麻醉后,休克组和休克+引流组大鼠按我室报道的以股动脉匀速放血(10 min)、调整放血量维持平均动脉血压[(40±2) mmHg, 90 min]的方法,建立失血性休克模型[4],液体复苏(回输放出血液+等量林格氏液,30 min)后,观察至6 h;休克+引流组大鼠在液体复苏后即刻,按我室常规方法引流肠淋巴液至6 h[4],按0~3 h和3~6 h时间段分为2份,离心去细胞,冷冻于-80 ℃,用于后续实验;休克组动物仅剥离肠淋巴管;假术组动物仅行相同手术操作,但不放血、不输液、不引流肠淋巴液,观察至与其它各组相对应时点。
3 注射伊文氏蓝与灌洗
在液体复苏后5.5 h,经股静脉注射1%伊文氏蓝(Evans blue,EB; Sigma)溶液(30 mg/kg),30 min后开胸,立即连有生理盐水(37 ℃)输液瓶的钝性穿刺针穿刺至左心室心尖部深入主动脉,同时在右心耳底部作一切口,冲洗体循环内的EB。然后,将穿刺针插入肺动脉,并在左心耳底部作一切口,行肺循环灌洗。
4 组织留取与外观颜色观察
在灌流至无蓝色液体流出为止,立即留取固定位置的心肌(左心室肌)、肝 (左外叶下缘)、脾、肾 (左肾正中纵行切开后纵切面)、小肠 (十二指肠下10 cm处,长约5 cm)和肺 (左肺下缘)组织,用生理盐水洗去表面污物,用滤纸吸干表面附着水分,置于平皿中,在解剖镜(SZ2-ILST,Olympus)下观察外观颜色,应用数码照相机 (Nikon)拍照。
5 组织EB浓度检测
首先,准确称取1 mg EB、0.2 g牛血清白蛋白,溶于5 mL 0.9%生理盐水中作为储备液。采取倍比稀释法配制不同浓度的标准液,在波长620 nm处,检测各标准液吸光度值,绘制标准曲线方程:y=0.088x+ 0.005x2+0.000254x3,R2=0.9963。然后,取固定位置的心肌(左心室肌下缘)、肝(左外叶下半部分)、脾(下半部分)、肾(左肾正中纵行切开的一半)、小肠(十二指肠下15 cm处,长约5 cm)和肺(肺左叶)组织,约0.1~0.3 g,剪碎为1 mm×1 mm×1 mm的组织块,按100 mg待测组织加入1 mL甲酰胺 (Sigma),置于50 ℃水浴孵育24 h,3 000 r/min离心10 min,取上清分别测定620 nm、740 nm波长处的吸光度,结合文献[5-6],代入公式:校正A620=实际测量A620-1.426A740-0.03,计算校正吸光度值,代入方程,计算EB浓度。将组织块沉渣放入80 ℃恒温箱烤24 h至恒定,称干重,作为组织EB浓度的标准化处理,即:EB浓度/组织干重(μg/g)。
6 组织干湿重比值检测
取固定位置的心肌 (左心室肌外缘)、肝 (左外叶上半部分)、脾 (上半部分)、肾 (左肾正中纵行切开的一半)、小肠 (十二指肠下10 cm处,长约5 cm)和肺 (右肺中叶)组织,用滤纸吸干表面附着水分;应用分析天平准确测量,并记录组织的湿重 (wet weight, W);然后于80 ℃恒温箱烤72 h至组织干重恒定,称干重 (dry weight, D),计算D/W比值。
7 HUVECs形态学观察
将新购自上海严谨生物公司的HUVECs,按常规方法复苏、传代,制备5×108/L左右的细胞悬液,移入96孔板,每孔加入100 μL细胞悬液,将96孔板放置于37℃、5%CO2孵育箱(Thermo)中培养,待细胞单层融合至70%~80%时,按下述处理因素分为7组:DMEM组(DMEM培养基,Gibco)、DMEM+胎牛血清 (fatal bovine serum,FBS)组(DMEM培养基含10% FBS)、脂多糖 (lipopolysaccharide, LPS; Sigma)组 (含10 mg/L LPS的DMEM培养基)、4% 休克复苏后0~3 h肠淋巴液组(含4%休克复苏后0~3 h肠淋巴液的DMEM培养基,简称4% PHMSL 0~3 h组)、10% PHMSL 0~3 h组、4% PHMSL 3~6 h组和10% PHMSL 3~6 h组。待各种因素与HUVECs作用6 h后,倒置显微镜(Leika)下观察不同处理因素对HUVECs形态的影响。
8 HUVECs活性观察
待各种处理因素与HUVECs (设6个复孔) 作用6 h后,每孔中加入10 μL MTT(Amresco,5 g/L),继续在培养箱中孵育4 h,然后吸弃孔内培养液,每孔加入150 μL DMSO(Fisher),置于摇床上振荡10 min,充分溶解;使用M3型酶标仪(MD)在波长490 nm处测量各孔A值,以此反映细胞活性。
9 单层内皮细胞通透性测定
首先,将Transwell小室 (上室;Corning)放在24孔细胞培养板 (下室)上,在上室中加入DMEM培养液,37℃预孵育24 h;将浓度为2.4×107/L HUVECs悬液100 μL接种于上室,下室加入600 μL含10%FBS的DMEM培养基,至37 ℃、5%CO2培养箱中孵育;24 h后,待细胞融合生长形成致密的单层细胞;按前述处理因素,更换上室中培养液;更换下室培养液为无血清DMEM培养基,作用6 h后,应用EVOM2型跨上皮电阻测量仪 (WPI),测量跨细胞电阻 (trans-endothelial electrical resistance,TEER)。然后,吸去上室中的培养液,加入100 μL含有FITC-Albumin(1 g/L,Sigma)的DMEM培养基,避光孵育45 min,收集上、下室液体100 μL,移入96孔板(其中上室液体稀释50倍),采用酶标仪的荧光强度测量模块读取荧光强度 (激发波长:485 nm;发射波长:525 nm),同时测量底室液体量。结合文献[7-10]计算单层血管内皮细胞对白蛋白的通透系数(Pa):Pa= ([A]/t) × (1/A) × (V/[L])。其中,[A]为下室荧光吸光度;t为作用时间,以秒计算;A是滤膜面积,以cm2计算;V为下室液体量,以mL计算;[L]为上室荧光吸光度。
10 统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 16.0统计软件包进行方差齐性检验,方差齐(P>0.10)的资料多组间比较采用单因素方差分析,方差不齐(P≤0.10)的资料采用Kruskal-Wallis检验,以P<0.05为差异有统计学意义。
结 果
1 PHSML引流对失血性休克大鼠各组织EB渗出情况的影响
如图1所示,休克组大鼠肺、心、肾、肝、脾和小肠组织表面的蓝色较假手术组深,休克+引流组大鼠的这些组织表面的蓝色较休克组浅;通过甲酰胺萃取EB、定量分析检测表明:休克组大鼠肺、心、肾、肝、脾和小肠组织EB渗出量均显著高于假手术组 (P<0.05),休克+引流组大鼠肺、心、肾、肝、脾、肠组织EB渗出量均显著低于休克组 (P<0.05),且心和肾组织EB渗出量高于假手术组 (P<0.05)。
2 PHSML引流对失血性休克大鼠各组织干湿比值的影响
在液体复苏结束后6 h,休克组大鼠心肌、肝、脾、肾、小肠和肺组织的D/W比显著低于假手术组(P<0.05);休克+引流组大鼠心肌、肝、脾、肾、小肠和肺组织的D/W比显著高于休克组(P<0.05),且与假手术组无统计学意义(P>0.05),见表1。
3 PHSML肠淋巴液对HUVECs形态的影响
各种因素处理HUVECs 6 h后,倒置显微镜下观察可见:DMEM和DMEM+FBS组细胞生长旺盛,呈鹅卵石样贴壁,2组细胞的形态无明显差别(图2A、2B);4% 0~3 h PHSML处理后,细胞间隙增大,细胞间连接消失,胞体发生不规则收缩,部分细胞悬浮甚至脱落(图2C),PHSML浓度加大到10%时,细胞胞膜边缘进一步模糊,失去完整性,细胞碎片增多,胞内颗粒密集,呈现典型拉网现象 (图2D);4% 3~6 h PHSML处理后,细胞间隙开始逐步拉大,胞体发生小范围收缩,部分细胞悬浮(图2E),PHSML浓度加大到10%时,细胞胞体失去完整性,胞膜边缘模糊不清,有细胞碎片,胞内颗粒增加 (图2F);LPS处理后,细胞失去了典型的鹅卵石样形态,细胞收缩变形,结构发生不规则改变,较多细胞悬浮甚至脱落(图2G)。
4 PHSML对HUVECs细胞活性的影响
DMEM组与FBS+DMEM组细胞活性无显著差异(P>0.05);4%和10% 0~3 h、4%和10% 3~6 h的PHSML以及LPS均降低了HUVECs的活性,与DMEM组和FBS+DMEM组均有显著差异(P<0.05);在4个PHSML作用组中,以10% 0~3 h PHSML降低HUVECs活性的作用最强,均显著低于其它3组(P<0.05);4% 3~6 h PHSML的作用显著弱于LPS组(P<0.05),其它3个PHSML组与LPS组无显著差异(P>0.05),见图3。

表1 肠淋巴液引流对失血性休克大鼠各组织干湿重比值的影响

Figure 2. Effect of post-hemorrhagic shock mesenteric lymph (PHSML) on the cellular morphology of human umbilical vein endothelial cells (HUVECs) 6 h after incubation(×200).A: DMEM group; B: FBS+DMEM group; C: 4% PHSML 0~3 h group; D: 10% PHSML 0~3 h group; E: 4% PHSML 3~6 h group; F: 10% PHSML 3~6 h group; G: LPS group.
5 PHSML对HUVECs单细胞通透性的影响
如图4所示,各种因素与HUVECs孵育6 h后,结果显示:DMEM组与FBS+DMEM组细胞TEER值、Pa值无显著差异(P>0.05);4%和10%休克复苏后0~3 h、4%和10%休克复苏后3~6 h PHSML以及LPS均降低了TEER,提高了Pa值,与DMEM组和FBS+DMEM组均有显著差异(P<0.05)。在4个PHSML作用组中,以10%休克复苏后0~3 h PHSML组HUVECs的TEER值最低,均显著低于其它3组(P<0.05),且低于LPS阳性对照组(P<0.05);以4%休克复苏后3~6 h PHSML作用的HUVECs的TEER值最高,均显著高于其它3个淋巴液作用组与LPS组 (P<0.05)。同时,在4个PHSML作用组中,以4%休克复苏后3~6 h PHSML组HUVECs的Pa值最低,均显著低于其它3组 (P<0.05);LPS作用于HUVECs后,Pa值最高,均显著高于4个PHSML组(P<0.05)。

Figure 3. Effect of post-hemorrhagic shock mesenteric lymph (PHSML) on the viability of human umbilical vein endothelial cells (HUVECs) 6 h after incubation.Mean±SD.n=6.*P<0.05 vs DMEM or FBS+DMEM group; #P<0.05 vs 4% PHSML 0~3 h group; △P<0.05 vs 4% PHSML 3~6 h group.
讨 论
目前,国内外学者一般从整体动物模型、离体灌流器官或组织模型、单层内皮细胞模型等3个层次研究血管通透性[11]。在整体动物模型上,人们一般从静脉注射EB、[125I]白蛋白或荧光标记的白蛋白,然后测定组织中EB含量、放射性强度或荧光强度,来反映组织的通透性[11]。为了全面探讨、了解休克肠淋巴液回流在重症休克引起血管通透性增高这一过程中的作用,本研究首先应用静脉注射EB、再行全身灌洗、甲酰胺萃取的方法,观察了PHSML引流对失血性休克大鼠肺、肝、肾、心肌、脾、小肠等组织中EB含量渗出的影响。
研究表明,PHSML引流均可降低失血性休克大鼠各组织EB含量,从灌洗的各组织器官表面的颜色变化也佐证了这一结果。研究结果提示,失血性休克引起的血管高通透性在各组织器官均有所表现,且PHSML引流的作用具有普遍性。应当指出,在这一实验中,全身灌洗是影响实验成败的关键技术。一方面,灌洗不完全,会直接影响组织中EB的结果;另一方面,灌洗压力过高,可能会引起肺循环压力过高,引起肺水肿,使实验结果出现较大偏差。为此,在本实验中,结合相关文献[6, 12]报道,建立了先行体循环灌洗、再行肺循环灌洗的方法,避免了由于灌洗导致的肺水肿发生;并结合灌洗过程中重要器官肝、肺表面颜色的变化判断灌洗是否完全,同时,考虑到可能存在灌洗不足的因素,又结合相关文献[5-6],去除了与血红蛋白结合的伊文氏蓝引起吸光度的影响,应用校正公式进行伊文氏蓝浓度的计算。国外的一些研究,也应用静脉注射EB,行支气管肺泡灌洗,将获得的支气管肺泡灌洗液与血浆EB浓度的百分比作为肺血管通透性指标,证明了失血性休克、烧伤后肺组织血管通透性增高,也发现了阻断PHSML回流降低了肺组织的血管通透性[13-15]。但这些研究均集中在肺损伤的研究,而本文结果进一步证实了PHSML回流是导致失血性休克后各组织器官血管通透性的重要因素。
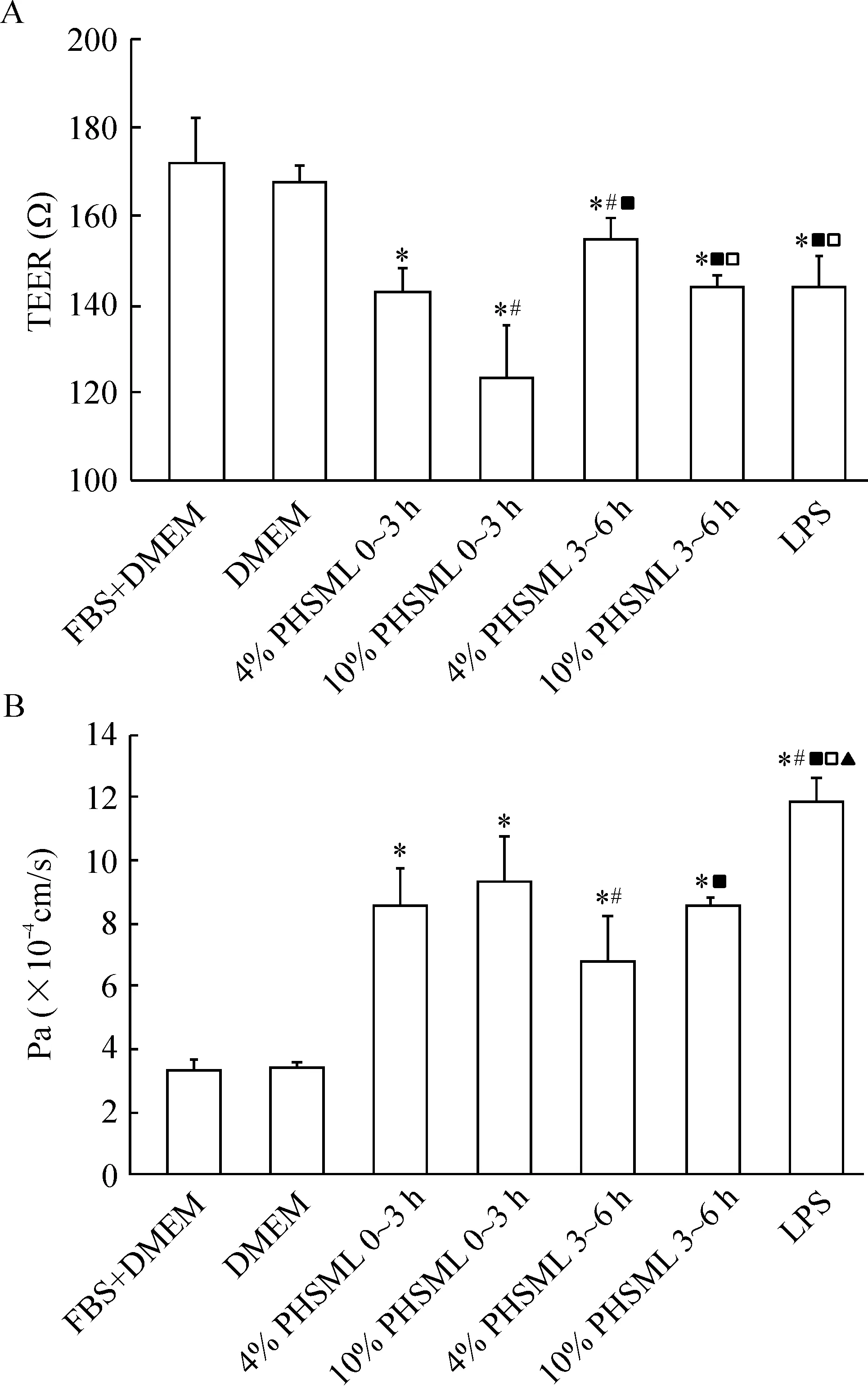
Figure 4. Effects of post-hemorrhagic shock mesenteric lymph (PHSML) on the permeability of human umbilical vein endothelial cells (HUVECs) 6 h after incubation.A: changes of trans-endothelial electrical resistance (TEER) in HUVECs; B: changes of monolayer permeability to of HUVECs FITC-labeled albumin. Mean±SD. n=4.*P<0.05 vs DMEM or FBS+DMEM group; #P<0.05 vs 4% PHSML 0~3 h group; ■P<0.05 vs 10% PHSML 0~3 h group; □P<0.05 vs 4% PHSML 3~6 h group; ▲P<0.05 vs 10% PHSML 3~6 h group.
血管通透性增加的后果,就是引起组织液生成超过回流,导致组织水肿的发生。为此,本研究进一步检测了各组织器官的D/W值。结果显示,失血性休克组大鼠的肺、肝、肾、心肌、脾、肠等组织的D/W值均显著降低,出现了组织水肿;PHSML引流提高了休克大鼠各组织的D/W值,表明减轻了组织水肿的程度,这与降低过高的血管通透性有关。研究结果从另一个侧面,进一步验证了PHSML引流降低血管高通透性的作用。
血管内皮细胞的完整性以及它们之间的连接是维持血管内皮屏障以及血管内皮细胞通透性的重要结构学基础[16]。生理条件下,血管通透性的调节涉及跨细胞途径和细胞旁途径[16]。跨细胞途径,即穿过内皮细胞到达周围组织[17];一般情况下,蛋白质及脂质主要是通过该途径来实现血管内外的物质交换与平衡[18]。细胞旁途径,是指一些物质从内皮细胞间隙穿过血管到达周围组织[19]。跨细胞途径功能的实现与内皮细胞的骨架蛋白形成的网状结构的完整性有关,细胞旁路途径功能的实现主要依靠细胞间黏附或连接分子的表达有关[19]。为了进一步探讨PHSML对血管通透性的作用,观察了将引流至体外的PHSML对HUVECs通透性的影响,并以LPS作为阳性对照。
形态学观察结果显示,不同浓度、不同时间的PHSML作用于HUVECs 6 h后,均引起了HUVECs结构学损伤,破坏了完整性,从血管内皮细胞通透性的跨细胞途径这一方面解释PHSML引起血管通透性增高的细胞机制;同时,细胞间隙增大、细胞间连接消失,表明PHSML可能引起了HUVECs间的连接状态,这可能从血管内皮细胞通透性的细胞旁途径这一方面解释休克肠淋巴液引起血管通透性增高的细胞机制。可见,PHSML增加HUVECs通透性的作用可能与2种途径均有一定关系。
为了进一步明确PHSML对HUVECs结构与完整性的损伤作用,本文应用MTT法检测了PHSML对HUVECs生长活性的影响。结果显示,不同浓度、不同时间的PHSML作用6 h均降低了HUVECs生长活力,使HUVECs存活数减少;这些结果与形态学观察结果是一致的,从另一个角度证明了PHSML对HUVECs的损伤作用。结果也说明PHSML增加内皮细胞通透性的作用是通过破坏血管内皮屏障的跨细胞途径实现的,而PHSML对与跨细胞途径功能密切相关的骨架蛋白的表达,还有待进一步观察。
TEER检测与单层细胞对白蛋白的通透系数已广泛应用于细胞通透性的检测;一般来说,单层细胞的TEER值越大,说明单层细胞越致密,通透性越小,单层细胞对白蛋白的通透系数越大,表明单层细胞通透性越高。本实验关于TEER与单层细胞对白蛋白的通透系数检测结果表明,不同浓度、不同时间的PHSML降低了HUVECs的TEER,提高了Pa值,说明PHSML增加内皮细胞通透性的作用与破坏细胞间的致密结构是相关的,也说明PHSML的作用是通过破坏细胞间黏附或连接分子实现的。当然,PHSML对HUVECs黏附连接或紧密连接蛋白的作用还有待进一步研究。
在上述研究中也发现,10%的失血性休克液体复苏的0~3 h肠淋巴液的损伤作用最强,细胞活性接近LPS的作用,降低TEER的作用则明显强于LPS对照组,这也与我们前期观察到肠淋巴液中有高浓度内毒素的结果是一致的。这也表明,在失血性休克液体复苏的0~3 h内,肠淋巴液的毒性作用最强,提示应关注在这一时段肠淋巴液的病理学作用。
总之,减少PHSML回流,有利于降低休克引起各组织器官过高的血管通透性;PHSML引起了HUVECs的形态学损伤、降低了生长活性、降低了TEER、提高了对FITC标记白蛋白的通透系数,提示PHSML回流提高血管通透性的机制与破坏内皮细胞的通透性有关,其机制涉及细胞通透性的跨细胞途径与细胞旁途径,相关机制还需进一步研究。
[参 考 文 献]
[1] Sawant DA, Tharakan B, Tobin RP, et al. Inhibition of Fas-Fas ligand interaction attenuates microvascular hyperpermeability following hemorrhagic shock [J]. Shock, 2013, 39(2): 161-167.
[2] Deitch EA. Gut lymph and lymphatics: a source of factors leading to organ injury and dysfunction [J]. Ann N Y Acad Sci, 2010, 1207(Suppl 1): E103-E111.
[3] Deitch EA. Gut-origin sepsis: evolution of a concept [J]. Surgeon, 2012, 10(6): 350-356.
[4] 韩 波,张立民,陈立峰,等. 硫化氢在休克肠淋巴液致肝损伤中的作用与机制[J]. 中国病理生理杂志, 2013, 29(7): 1307-1312.
[5] Wallace KL, Linden J. Adenosine A2A receptors induced on iNKT and NK cells reduce pulmonary inflammation and injury in mice with sickle cell disease [J]. Blood, 2010, 116(23): 5010-5020.
[6] Niessen F, Furlan-Freguia C, Fernández JA, et al. Endogenous EPCR/aPC- PAR1 signaling prevents inflammation-induced vascular leakage and lethality [J]. Blood, 2009, 113(12): 2859-2866.
[7] You QH, Sun GY, Wang N, et al. Interleukin-17F-induced pulmonary microvascular endothelial monolayer hyperpermeability via the protein kinase C pathway [J]. J Surg Res, 2010, 162(1): 110-121.
[8] Tinsley JH, Wu MH, Ma W, et al. Activated neutrophils induce hyperpermeability and phosphorylation of adherens junction proteins in coronary vascular endothelial cells [J]. J Biol Chem, 1999, 274(35): 24930-24934.
[9] Tinsley JH, Teasdale NR, Yuan SY. Myosin light chain phosphorylation and pulmonary endothelial cell hyperpermeability in burns [J]. Am J Physiol Lung Cell Mol Physiol, 2004, 286(4): L841-L847.
[10] Tinsley JH, Breslin JW, Teasdale NR, et al. PKC-dependent, burn-induced adherens junction reorganization and barrier dysfunction in pulmonary microvascular endothelial cells [J]. Am J Physiol Lung Cell Mol Physiol, 2005, 289(2): L217-L223.
[11] 王述昀,赵克森. 血管通透性的调节和游离微血管技术在其研究中的应用[J]. 中国病理生理杂志, 2005, 21(1): 203-208.
[12] Yano K, Liaw PC, Mullington JM, et al. Vascular endothelial growth factor is an important determinant of sepsis morbidity and mortality [J]. J Exp Med, 2006, 203(6): 1447-1458.
[13] Magnotti LJ, Upperman JS, Xu DZ, et al. Gut-derived mesenteric lymph but not portal blood increases endothelial cell permeability and potentiates lung injury following hemorrhagic shock [J]. Ann Surg, 1998, 228(4): 518-527.
[14] Deitch EA, Xu D, Kaise VL. Role of the gut in the development of injury- and shock induced SIRS and MODS: the gut-lymph hypothesis, a review [J]. Front Biosci, 2006, 11: 520-528.
[15] Magnotti LJ, Xu DZ, Lu Q, et al. Gut-derived mesenteric lymph: a link between burn and lung injury [J]. Arch Surg, 1999, 134(12): 1333-1341.
[16] 赵克森,黄巧冰. 血管通透性增高的基本机制[J]. 中国病理生理杂志, 2003, 19(4): 549-553.
[17] Dejana E, Tournier-Lasserve E, Weinstein BM. The control of vascular integrity by endothelial cell junctions: molecular basis and pathological implications [J]. Dev Cell, 2009,16(2): 209-221.
[18] Mehta D, Malik AB. Signaling mechanisms regulating endothelial permeability [J]. Physiol Rev, 2006, 86(1): 279-367.
[19] Wallez Y, Huber P. Endothelial adherens and tight junctions in vascular homeostasis, inflammation and angiogenesis [J]. Biochim Biophys Acta, 2008, 1778(3): 794-809.
