胞外高浓度ATP诱导SH-SY5Y细胞的自噬和凋亡*
2014-08-09白瑞樱魏林郁李超堃李新娟赵红岗李东亮
卢 娜, 白瑞樱, 魏林郁, 李超堃, 李新娟, 赵红岗, 李东亮
(新乡医学院基础医学院生理学与神经生物学教研室,河南 新乡 453003)
腺苷三磷酸(adenosine triphosphate,ATP)不仅是体内储能供能物质,还是细胞间传递信息的重要活性分子,中枢神经系统(central nervous system,CNS)神经细胞释放的ATP作为递质,对神经功能的作用越来越受到关注[1]。生理条件下胞外ATP浓度在μmol/L水平,它通过核苷转运形式释放至突触间隙,可选择性地作用于相应嘌呤受体发挥递质调节、突触修饰和神经营养等作用。而当CNS遭受各类应激,如缺氧缺血、炎症损伤后,受损细胞释放大量ATP,胞外达到mmol/L的高水平,可引起神经元继发性死亡[2]。因此,研究ATP对神经元毒性作用的特点及规律,揭示神经元死亡方式,有可能为脑损伤和脑卒中的防治策略提供新思路。人神经母细胞瘤细胞(SH-SY5Y细胞)来自于神经发育过程中的神经嵴,表现出与神经元相似的生化、药理和功能方面的特性,提供了一个可以用来研究神经元功能、分化及死亡的良好体外模型。本实验以SH-SY5Y细胞为对象,观察ATP诱导的细胞凋亡和自噬,以及两者的时间顺序特点。
材 料 和 方 法
1 材料
人神经母细胞瘤SH-SY5Y细胞株由上海中科院典型细胞培养库提供;DMEM培养液、新生牛血清购于HyClone;细胞增殖与毒性检测试剂盒(Cell Counting Kit-8,CCK-8)购于广州晶欣生物科技有限公司;annexin V-FITC细胞凋亡检测试剂盒、单丹磺酰戊二胺(monodansylcadaverine,MDC)、细胞凋亡与坏死检测试剂盒、鼠抗β-actin多克隆抗体及兔抗caspase-3单克隆抗体均购自碧云天生物技术有限公司;鼠抗微管相关蛋白1轻链3-Ⅱ(microtubule-associated protein 1 light chain 3-Ⅱ, LC3-Ⅱ)单克隆抗体购自Abgent;FITC标记驴抗鼠IgG(H+L)购自Laboratories;蛋白marker购自Fermentas。
2 主要方法
2.1SH-SY5Y细胞培养 细胞置于含体积分数为10%胎牛血清的DMEM中,在37 ℃、5% CO2的饱和水汽培养箱中培养,每隔48 h换培养液,当单层细胞融合后,行传代处理。传代后随机分为对照组和ATP作用1 h、3 h、6 h组,ATP各组培养液均更换为终浓度含6 mmol/L ATP 的培养液,放入培养箱中继续培养。每次每组设5 个平行复孔,实验重复3 次。
2.2CCK-8比色法检测细胞存活率 取对数生长期细胞,调整细胞密度,以5×107/L接种于96孔板,每孔细胞悬液100 μL。在37 ℃、5%CO2的饱和水汽培养箱中培养24 h,弃去培养液,分别置换成终浓度含3、6、9、12和15 mmol/L ATP 的培养液。ATP 作用3 h后,每孔加10 μL CCK-8溶液,避光孵育2 h,酶标仪在波长450 nm 处读取吸光度(absorbance,A),用5孔A值的均数计算存活率。将对照组的A值表示为ACon,ATP 各组样本的A值表示为AATP,存活率按下式计算: 存活率(%)=AATP/ACon×100%。本实验对照组的细胞存活率定为100.0%。
2.3MDC染色检测自噬空泡 MDC是一种自噬空泡的标志物, 可以通过MDC染色观察判断细胞自噬过程的发生[3]。采用Biederbick 等[4]实验方法,各组细胞爬片处理后,去培养基,用PBS 洗2 遍;然后加入0.05 mmol/L的MDC染色液,37 ℃孵育60 min;吸去染料后用4 ℃、4% 多聚甲醛固定5 min,PBS 洗2 次;晾干后立刻用荧光显微镜观察,激发波长365 nm,阻断波长430 nm;在200倍视野下,随即取5个视野,用ImageJ软件分析荧光强度值,代表细胞自噬表达的相对水平。重复3 次,计算平均值。
2.4Hoechst染色凋亡细胞 取对数生长期细胞,调整细胞密度,以5×107/L接种于24孔板,每个孔细胞悬液500 μL;培养24 h后,置换成终浓度含6 mmol/L ATP 的培养液;ATP 作用1 h、2 h、3 h、6 h后弃培养液,每孔加1 mL细胞染色缓冲液和5 μL Hoechst 33258,冰浴染色30 min;PBS洗涤1次,立即在荧光显微镜下观察。在200倍视野下,随机取100个细胞,计数呈现强蓝光的凋亡细胞,并计算凋亡比率= 呈现强蓝光的细胞/100 个细胞,重复3 次,计算平均值。
2.5流式细胞术检测细胞凋亡率 取对数生长期SH-SY5Y细胞,经消化制成细胞悬液, 以5×106细胞数接种于培养瓶中, 细胞贴壁后加入ATP,终浓度为6 mmol/L,分别在1 h、2 h、3 h、6 h后, PBS洗2遍,收集细胞,弃上清,分别加入1 mg/L PI和anne-xin V-FITC, 37 ℃孵育15 min,PBS洗2遍,流式细胞术检测细胞凋亡率。
2.6Western blotting法检测caspase-3和LC3-2表达 收获细胞,4 ℃预冷的PBS洗1次,加入适量的细胞裂解液,用细胞刮子刮下细胞,低温离心机12 000 ×g离心10 min,取上清液,弃沉淀。用BCA法测定各组蛋白含量,每孔上样25 μL蛋白,经15% SDS-PAGE 80 V电泳2 h后,300 mA恒流转膜40 min,5% 脱脂牛奶常温下封闭1 h后,在4 ℃孵育Ⅰ抗(兔抗人caspase-3滴度为1∶1 000、小鼠抗人LC3-Ⅱ滴度均为1∶2 000、小鼠抗人β-actin滴度均为1∶3 000);5%脱脂牛奶常温下封闭Ⅱ抗(羊抗兔辣根过氧化物酶IgG 和羊抗小鼠辣根过氧化物酶IgG 滴度均为1∶5 000,5% 脱脂牛奶配制),ECL 显影显示目的条带和内参,用SIGMA Photo Pro 5.0软件分析光密度值,代表蛋白表达的相对水平。
3 统计学处理
用SPSS 11.0统计软件分析。数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法)。以P<0.05 为差异有统计学意义。
结 果
1 不同浓度 ATP作用3 h对SH-SY5Y细胞形态的影响
倒置相差光学显微镜下观察SH-SY5Y细胞形态的变化,正常SH-SY5Y 细胞大部分呈梭形、三角形,少数呈多边形,胞浆内有大量颗粒,多数可见细胞突起,折光性好,贴壁能力强; 随着ATP作用浓度增加,细胞贴壁数量逐渐减少,细胞形态逐渐变为圆形,体积皱缩,突起减少或消失,折光性逐渐减弱;脱壁的细胞增加,表明ATP对SH-SY5Y 细胞损伤作用有浓度依赖性,见图1。

Figure 1. Effect of different concentrations of ATP on the morphology of SH-SY5Y cells (×200). A: 0 mmol/L; B: 3 mmol/L; C: 6 mmol/L; D: 9 mmol/L; E: 12 mmol/L; F: 15 mmol/L.
2 不同浓度 ATP作用3 h对SH-SY5Y细胞存活率的影响
CCK-8法检测结果以空白对照组细胞存活率为100.0%,则3、6、9、12和15 mmol/L ATP组存活率分别为72.6%、55.8%、40.3%、20.8%和8.1%,与对照组比较差异均有统计学意义(P<0.05),随胞外ATP浓度增高,细胞存活率逐渐降低,呈剂量依赖性,见表1。

表1 不同浓度ATP对SH-SY5Y 细胞存活率的影响
3 ATP(6 mmol/L)对SH-SY5Y 细胞存活率的影响
CCK-8法检测结果显示,6 mmol/L ATP作用1 h、2 h、3 h和6 h,SH-SY5Y 细胞存活率分别为对照组的69.4%、62.3%、54.7%和53.1%,差异均有统计学意义(P<0.05);随着ATP作用时间的延长,细胞存活率呈时间依赖性逐渐降低,3 h达高峰,3 h和6 h组之间差异无统计学意义(P>0.05),见表2。
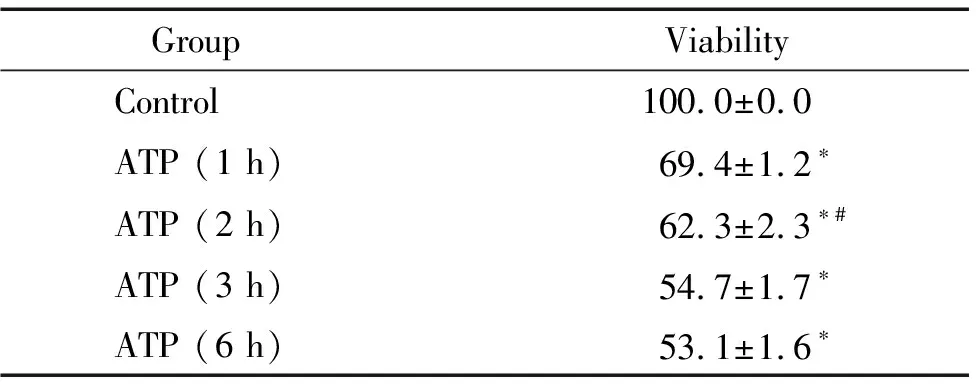
表2 ATP作用不同时间对SH-SY5Y细胞存活率的影响
4 MDC染色检测细胞自噬空泡
MDC染色结果表明,与正常对照组相比, 6 mmol/L ATP作用1 h,细胞内MDC点状荧光信号明显增强,提示细胞出现大量自噬空泡;而2 h、3 h和6 h后MDC荧光信号逐渐减弱,提示细胞内自噬泡减少,见图2。

Figure 2. Effect of ATP (6 mmol/L) treatment for different time on the formation of autophagic vacuoles (MDC staining,×400).Mean±SD.n=5.*P<0.05 vs control group; ##P<0.05 vs 1 h group.
5 荧光染色检测细胞凋亡率
Hoechst染色结果表明,正常对照组细胞染色质均匀,发出均匀浅蓝色荧光,核呈正常结构; 6 mmol/L ATP作用后,大量细胞染色质固缩,胞核致密深染,胞内可见亮蓝色荧光。3 h凋亡率达高峰,见图3。
6 流式细胞术检测细胞凋亡率
与正常对照组相比,6 mmol/L ATP作用后,早期凋亡率明显增加,并呈时间依赖性,3 h凋亡率达高峰。ATP作用1 h、2 h、3 h和6 h后凋亡率分别为(12.33±0.43)%、(30.27±0.24)%、(41.65±0.36)% 和(40.71±0.29)%,见图4。
7 Western blotting法检测 caspase-3和LC3-Ⅱ蛋白表达的变化
蛋白质印迹结果显示,与正常对照组比较,6 mmol/L ATP作用后,各组cleaved caspase-3蛋白表达量均增加(P<0.05),6 h达高峰;LC3-Ⅱ蛋白表达量在作用1 h、2 h和3 h明显增加(P<0.05),1 h表达量最高,然后随时间延长而逐渐降低,见图5。

Figure 3. Effect of ATP (6 mmol/L) treatment for different time on the changes of apoptotic rates of SH-SY5Y cells (Hoechst 33342 staining,×200). The arrows indicate the apoptotic cells with sapphirine color. Mean±SD.n=5.*P<0.05 vs control group; #P<0.05 vs 3 h group.
讨 论
自噬(autophagy)是细胞利用溶酶体降解自身受损细胞器和大分子物质的过程,是真核细胞特有的生命现象[5], 这一过程在细胞清除废物、重建结构、生长发育、维持内环境稳定中起重要作用[6];并参与了如脑损伤、神经退行性改变、精神分裂症等多种疾病的发病过程[7]。细胞在受到外界因素刺激,如饥饿、缺氧、高温,或在细胞内部应激等多种情况下,均可诱导自噬的发生[8]。LC3是目前观察自噬现象是否存在、研究自噬活性较为可靠的生物学标志物,它哺乳动物细胞中酵母ATG8(Aut7/Apg8)基因的同源物,定位于前自噬泡和自噬泡膜表面,参与自噬体的形成。LC3 有Ⅰ型和Ⅱ型之分,未发生自噬时,细胞内合成的LC3 经过加工,成为胞质可溶性的LC3-Ⅰ,常规表达。当自体吞噬发生时,LC3-Ⅰ经泛素样加工修饰过程,与自噬膜表面的磷脂酰乙醇胺结合,形成LC3-Ⅱ。LC3-Ⅱ结合并始终位于胞内自噬体的膜上,其含量的多少与自噬泡数量的多少成正比。因此LC3-Ⅱ表达强度与自噬活性密切相关[9]。目前,大多数研究证实自噬具有脑保护作用,当神经元遭遇应激时,自噬最先被激活,当自噬不能维持神经元稳态后,细胞再继发凋亡,最后进入坏死;且自噬与凋亡可同时存在于神经元[10],推测自噬在脑损伤后可能发挥清除受损细胞及降低正常细胞损害的作用。

Figure 4. ATP (6 mmol/L) induced apoptosis of SH-SY5Y cells detected by flow cytometry with annexin V-FITC/PI staining.Mean±SD.n=5.*P<0.05 vs control group; #P<0.05 vs 3 h group.

Figure 5. Effect of ATP (6 mmol/L) treatment for different time on the protein expression of cleaved caspase-3 and LC3-Ⅱ in SH-SY5Y cells. Mean±SD.n=5. *P<0.05 vs control group; #P<0.05 vs 6 h group; △P<0.05 vs 1 h group.
凋亡是由基因控制的细胞主动死亡的一种过程。Caspase是一大类凋亡调控基因,对神经元的凋亡起着非常关键的作用,而caspase-3被称为死亡蛋白酶,是caspase家族中最重要的细胞凋亡执行者之一[11]。 Caspase-3正常状态下以酶原(32 kD)的形式存在于胞浆中,在凋亡的早期阶段,它被激活,活化的caspase-3由2个大亚基(17 kD)和2个小亚基(12 kD)组成,裂解相应的胞浆胞核底物,最终导致细胞凋亡。很多学者将活化的caspase-3作为指标来检测凋亡[12]。脑组织缺血、缺氧后,神经细胞内能量代谢障碍,大量氧自由基的产生、兴奋性氨基酸的蓄积和释放及内质网应激等均可诱导自噬的发生。自噬发挥着双刃剑的作用。一方面,自噬的过度激活可能介导细胞程序性死亡[13],另一方面,自噬的启动可能有助于维持神经元稳态,减少继发损伤,清除已经被损伤的细胞器而保护神经元[14]。那么SH-SY5Y细胞在ATP的损伤下,自噬能否被激活?和凋亡有何关系?
本研究CCK-8结果表明, 随胞外ATP浓度增高,细胞存活率逐渐降低,呈剂量依赖性(表1);同时随胞外6 mmol/L ATP作用时间延长,细胞存活率逐渐降低,呈时间依赖性,3 h达高峰(表2)。这提示ATP损伤过程中细胞的增殖过程受到影响。通过Hoechst染色及流式细胞术检测细胞凋亡率均显示, 与正常对照组相比, 应用6 mmol/L ATP作用后,细胞凋亡率增加(P<0.05),并呈时间依赖性,3 h凋亡率达高峰(图3、4),表明ATP作用SH-SY5Y细胞启动了凋亡程序。同时我们检测了ATP在作用SH-SY5Y细胞时自噬的变化, 荧光显微镜MDC染色结果表明, ATP能够引起SH-SY5Y细胞发生自噬并且在1 h时就可以观察到自噬空泡明显增多(P<0.05), 而2 h、3 h和6 h后MDC荧光信号逐渐减弱,细胞内自噬泡减少(图2),提示自噬对细胞损伤结构的清理修复作用在进行;而细胞凋亡则在3 h达高峰,表明ATP诱导的SH-SY5Y细胞损伤中自噬增强发生在凋亡高潮之前。
我们进一步通过Western blotting对凋亡相关蛋白caspase-3及自噬特异性蛋白LC3-Ⅱ的表达进行检测, 发现与正常对照组相比,cleaved caspase-3蛋白表达量随时间逐渐增高,6 h达高峰;同时发现LC3-Ⅱ蛋白表达量在1 h达最高值,而后随时间延长而逐渐降低(图5),与相关研究结果基本相符[15]。说明ATP同时激活SH-SY5Y细胞发生自噬和凋亡,自噬增强在前,凋亡高潮在后。有研究表明,自噬空泡的积聚出现在凋亡之前并且不被凋亡抑制剂所影响, 而自噬被抑制后, 细胞凋亡蛋白caspase-3活化水平显著增加[16]。因此, 我们推测ATP损伤的早期, 很可能优先启动细胞自噬机制,降解受损的细胞器等胞内物质, 以提供维持细胞生存的氨基酸和能量等, 来延缓细胞凋亡过程的发生,对细胞的存活起一定的保护作用[17], 但随着ATP作用时间的延长, 凋亡逐渐占主导地位, 自噬失去其拮抗凋亡作用, 从而表现细胞死亡加速[10]。
综上所述本研究提示,胞外高浓度ATP启动SH-SY5Y细胞自噬和凋亡,自噬增强在前,凋亡高潮在后。研究ATP这种神经系统广泛存在的胶质递质(gliotransmitter)启动和调控自噬与凋亡机制,或许能够为应对神经元损伤提供新的策略。
[参 考 文 献]
[1] Butt AM. ATP: a ubiquitous gliotransmitter integrating neuron-glial networks [J]. Semin Cell Dev Biol, 2011, 22(2):205-213.
[2] Skaper SD, Debetto P, Giusti P. The P2X7 purinergic receptor: from physiology to neurological disorders [J]. FASEB J, 2010, 24(2):337-345.
[3] Perry CN, Kyoi S, Hariharan N, et al. Novel methods for measuring cardiac autophagyinvivo[J]. Methods Enzymol, 2009, 453:325-342.
[4] Biederbick A, Kern HF, Elsässer HP. Monodansylcada-verine (MDC) is a specificinvivomarker for autophagic vacuoles[J]. Eur J Cell Biol, 1995, 66(1):3-14.
[5] Klionsky DJ, Emr SD. Autophagy as a regulated pathway of cellular degradation[J]. Science,2000, 290(5497):1717-1721.
[6] Zou W, Wang X,Vale R, et al. Autophagy genes promote apoptotic cell corpse clearance[J]. Autophagy, 2012, 8(8):1267-1268.
[7] Shpcilka T, Elazar Z. Shedding light on mammalian microautophagy[J]. Dev Cell, 2011, 20(1):1-2.
[8] Feng Y, He D, Yao Z, et al. The machinery of macroautophagy[J]. Cell Res, 2014, 24(1):24-41.
[9] Mizushima N. Methods for monitoring autophagy[J]. Int J Biochem Cell Biol,2004, 36(12): 2491-2502.
[10] Wang P, Guan YF, Du H, et al. Induction of autophagy contributes to the neuroprotection of nicotinamide phosphoribosyltransferase in cerebral ischemia [J]. Autophagy, 2012, 8(1):77-87.
[11] Jan CR, Su JA, Teng CC, et al. Mechanism of maprotiline-induced apoptosis: role of [Ca2+]i, ERK, JNK and caspase-3 signaling pathways[J]. Toxicology, 2013, 304:1-12.
[12] 周天恩, 张 萌, 杨正飞, 等. 亚低温减轻氧糖剥夺所致的大鼠海马神经元损伤[J]. 中国病理生理杂志, 2013, 29(7):1165-1170.
[13] Balduini W, Carloni S, Buonocore G. Autophagy in hypoxia-ischemia induced brain injury[J]. J Matern Fetal Neonatal Med, 2012, 25(Suppl 1):30-34.
[14] Zhao Y, Chen G, Zhang W, et al. Autophagy regulates hypoxia-induced osteoclastogenesis through the HIF-1α/BNIP3 signaling pathway[J]. J Cell Physiol, 2012, 227(2):639-648.
[15] Wei Q, Zhang Y, Sun L, et al. High dose of extracellular ATP switched autophagy to apoptosis in anchorage-depen-dent and anchorage-independent hepatoma cells[J]. Purinergic Signal,2013, 9(4):585-598.
[16] Fayaz SM, Suvanish Kumar VS, Rajanikant GK. Necroptosis: who knew there were so many interesting ways to die?[J]. CNS Neurol Disord Drug Targets, 2014, 13(1):42-51.
[17] Zeng R, He J, Peng J, et al. The time-dependent auto-phagy protects against apoptosis with possible involvement of Sirt1 protein in multiple myeloma under nutrient depletion[J]. Ann Hematol, 2012, 91(3):407-417.
