靶向干扰CXCR7基因表达对肝癌(HCC)细胞增殖及凋亡的影响
2014-08-07灵韩梅梅王芳申华莉2余红秀杨芃原
林 灵韩梅梅王 芳申华莉,2余红秀,3△杨芃原,2
(1复旦大学生物医学研究院 上海 200032;2复旦大学化学系,3生命科学学院 上海 200433)
靶向干扰CXCR7基因表达对肝癌(HCC)细胞增殖及凋亡的影响
林 灵1韩梅梅1王 芳1申华莉1,2余红秀1,3△杨芃原1,2
(1复旦大学生物医学研究院 上海 200032;2复旦大学化学系,3生命科学学院 上海 200433)
目的探讨CXCR7基因在不同肝癌细胞系及肝癌组织中的表达情况,并研究靶向抑制CXCR7基因表达对肝癌细胞增殖及凋亡的影响。方法应用Western blot检测不同肝癌细胞系及10例肝癌组织中CXCR7蛋白的表达水平。采用短发夹状RNA(short hairpin RNA,sh RNA)干扰技术沉默HCCLM3与MHCC97L细胞中CXCR7基因的表达,分别采用Western Blot和qRT-PCR检测shRNA的靶向沉默效果。通过CCK-8增殖实验与Annexin V-FITC/PI细胞双染色研究CXCR7抑制对HCCLM3与MHCC97L增殖及凋亡的影响。结果CXCR7表达水平与肝癌细胞的恶性程度呈正相关,肝癌组织中CXCR7表达水平较癌旁显著升高。实验成功构建了9个慢病毒表达载体,其中CXCR7 sh RNA-566序列干扰效率最高。增殖实验显示干扰表达组细胞生长速度受到明显抑制(P<0.05);流式细胞仪分析显示干扰CXCR7表达可诱导细胞凋亡的发生。结论CXCR7表达水平与肝癌恶性程度呈正相关,靶向干扰CXCR7表达可抑制细胞的增殖能力,诱导细胞发生凋亡。
肝细胞肝癌(HCC);CXCR7基因; 短发夹状RNA(sh RNA); 增殖能力; 细胞凋亡
原发性肝癌的主要分型为肝细胞肝癌(hepatocellular carcinoma,HCC,以下简称肝癌),是高侵袭性的恶性肿瘤,早期症状不明显,大多数患者就诊时已至中晚期,整体预后很差。
趋化因子是一类相对分子质量为8 000~12 000的小分子分泌蛋白,通过与细胞表面G蛋白偶联受体结合来介导细胞的定向迁移和趋化。目前已发现20种趋化因子受体和50多种趋化因子[1-2]。趋化因子及其受体的相互作用在免疫调节、血管生成、干细胞分化、发育及定向迁移过程中起着重要作用[3]。研究发现,趋化因子及其受体在多种肿瘤细胞中呈高表达,发挥调控肿瘤相关的血管生成、促进肿瘤细胞增殖、控制肿瘤细胞迁移侵袭运动等生物学功能[4]。其中最令人瞩目的是趋化因子受体CXCR4与其配体CXCL12的相互作用。
Muller等[5]在2001年首次报道了乳腺癌细胞高表达CXCR4,其配体CXCL12多表达于乳腺癌的特异转移部位,如腋窝淋巴结、骨、肺和肝等,从而导致癌细胞的定向转移。过去认为CXCR4是CXCL12的唯一特异性受体,但Balabanian等[6]和Burns等[7]都发现CXCL12能与RDC1结合,因此将一直被当作孤儿受体的RDC1更名为CXCR7。CXCR7作为CXCL12的第2受体,是一个具有7次跨膜结构的G蛋白偶联受体,在哺乳动物中高度保守。与CXCR4一样,CXCR7可以作为HIV感染CD4阳性T细胞的协同受体;CXCR7还与CXCR4基因的编码序列相邻,提示CXCR7与CXCR4有许多相似性[8]。CXCR7与肿瘤的发生密切相关,本研究拟观察CXCR7在肝癌中的表达,探讨CXCR7对人肝癌细胞生物学行为的影响,发掘CXCR7作为肝癌诊断标志物的潜在价值。
材料和方法
材料和试剂人正常肝细胞L02,无转移能力的人肝癌细胞系Hep G2、Hep3B、Huh7,转移潜能依次增高的人肝癌细胞系MHCC97L、MHCC97H、HCCLM3、HCCLM6(以下简称为97L、97H、LM3、LM6)以及细胞系293T由本实验室保存。10例肝癌组织标本由复旦大学附属中山医院肝癌研究所提供,肝癌切除术后经病理组织学证实所有标本均为肝细胞肝癌。慢病毒载体质粒p LKO.1以及病毒包装质粒psPAX2和p MD2.G由复旦大学生物医学研究院系统生物学实验室贺福初教授惠赠。
质粒抽提试剂盒(德国QIAGEN公司);RNA反转录试剂盒、荧光定量PCR试剂盒(日本Ta KaRa公司);脂质体转染试剂Lipofectamine 2000TM、RNA提取试剂Trizol(美国Invitrogen公司);Bradford法蛋白定量试剂盒、PVDF膜(美国Bio-Rad公司);ECL化学发光试剂盒(美国Pierce公司);胎牛血清(美国Gibco公司);CCK-8细胞增殖检测试剂盒(日本 Dojindo公司);FITCAnnexin V/PI凋亡检测试剂盒(美国BD公司);短发夹状RNA(short hairpin RNA,shRNA)干扰序列(美国Sigma公司);CXCR7多克隆抗体(美国Abcam公司);GAPDH多克隆抗体(中国康为公司);β-ACTIN多克隆抗体、HRP标记IgG(中国金斯瑞公司)。
构建CXCR7 shRNA重组慢病毒表达载体根据NCBI数据库中CXCR7基因(Gene ID:57007)cDNA,设计9条针对CXCR7的sh RNA片段(表1)。将各组模板单链退火处理,2条Oligo寡核苷酸分别稀释至1μg/m L,取5μL,加入10×缓冲液5μL、去离子水35μL,95℃孵育4 min,缓慢降至室温。用限制性内切酶AgeI和EcoRI双酶切p LKO.1质粒后电泳,切胶回收线性化质粒,利用T4连接酶把退火的9对sh RNA寡核苷酸序列与线性化的p LKO.1慢病毒载体连接,重组质粒经酶切鉴定及测序得到正确克隆。将重组体转化大肠埃希菌DH5α,筛选氨苄抗性克隆,摇菌扩增后抽提质粒,分别命名为p LKO.1-CXCR7 sh RNA-1,2,3,4,5,139,205,300,566。
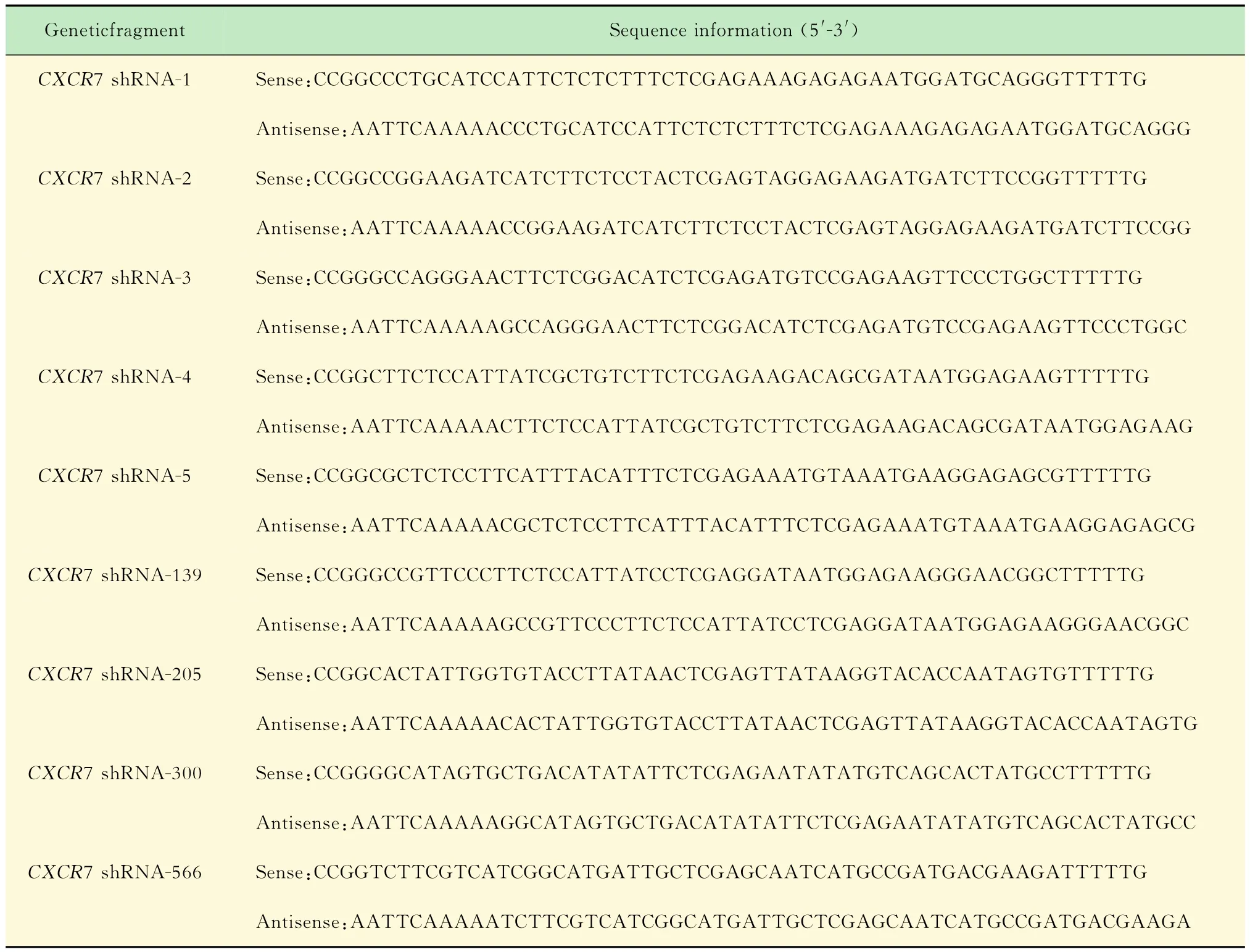
表1 CXCR7 shRNA序列信息(9片段)Tah 1 Sequence information ofCXCR7 shRNAs(nine sequences)
慢病毒介导的靶向干扰CXCR7表达通过病毒感染的方式将外源性DNA导入细胞并与宿主细胞染色体整合。具体步骤如下:(1)细胞转染:转染前1天,接种293T细胞至细胞培养皿中,使转染时细胞密度达到50%。将15μg p LKO.1-CXCR7 shRNAs(或p LKO.1空载体)与11.25μg psPAX2及3.75μg p MD2.G混合,脂质体介导转染293T细胞,6 h后换液8 mL。(2)病毒颗粒感染:转染36 h后,将培养基吸出,201×g离心5 min,取含病毒颗粒的上清液感染目的细胞LM3;同时加入聚凝胺至终浓度8μg/mL以提高感染效率;3~5 h后补充相同体积的正常培养液和聚凝胺;24 h后再次感染。(3)筛选:感染48 h后,换液为正常培养基,同时用终浓度5.5μg/μL的嘌呤霉素进行筛选培养;2周后得到稳定敲低CXCR7表达的细胞株。
qRT-PCR测定CXCR7 mRNA水平首先用Trizol试剂抽提细胞总RNA,逆转录合成第一链c DNA。将反转录后的cDNA产物稀释10倍,以GAPDH为内参,用染料SYBR®Green I标记产物。CXCR7上游引物5'-TGCATCTCTTCGACTACTCA-GA-3',下游引物5'-GGCATGTTGGGACACATCAC-3';GAPDH 上游引物5'-GGACCTGACCTGCCGTCTAG-3',下游引物 5'-GTAGCCCAGGATGCCCTTGA-3'。两步法PCR扩增标准程序:95℃预变性30 s;95℃下5 s、60℃下34 s,共40个循环;采集60℃反应的荧光值,完成对目的基因的相对定量。
Western hlot测定CXCR7蛋白水平蛋白样品用Bradford法测定浓度。每个泳道上样30μg蛋白,经SDS-PAGE胶电泳分离后,恒压100 V持续90 min将凝胶内的蛋白样品电转移至PVDF膜。5%脱脂牛奶室温封闭2 h;将膜浸于稀释好的一抗中,4℃过夜;TBST洗膜3次,适当比例稀释HRP标记的二抗,室温下20 rpm水平摇动孵育1 h;TBST洗膜3次,采用ECL化学发光系统显色,获得条带的定量信息。
CCK-8法检测细胞增殖取对数生长期的待测细胞,以细胞浓度2 000/孔接种于96孔板中。每孔加入10μL的DojindoTMCCK-8试剂,与待测细胞在培养箱内避光共孵育2 h,然后用酶标仪进行检测,记录D450值,绘制细胞增殖曲线。
FCM法检测细胞凋亡采用BD Annexin V/PI凋亡检测试剂盒,取适量10×Annexin V-FITC结合液,用去离子水稀释至1×。用不含EDTA的胰酶消化贴壁细胞并计数,取1×~5×Annexin VFITC结合液各500μL分别加入105个细胞,细胞重悬后加入5μL Annexin V-FITC染液,再加入5 μL PI染液,轻轻混匀,冰浴避光放置,1 h内进行流式细胞仪检测。
统计学分析采用GraphPad Prism 5.0软件来分析数据并作图,所有实验至少进行3次独立的重复,结果以±s表示,参数变量组间差异采用Student's t检验,双侧P<0.05为差异有统计学意义。
结 果
肝癌细胞系及肝癌组织中的CXCR7表达情况Western blot检测CXCR7蛋白在人肝、肝癌细胞系中的表达水平,CXCR7在正常肝细胞系L02中几乎不表达;在无转移潜能的肝癌细胞系Hep G2、Hep3B、Huh7中表达较弱;在转移潜能依次增高的97L、97H、LM3、LM6细胞中 CXCR7呈现高表达(图1A)。Western blot检测成对肝癌组织样本中CXCR7的表达情况,10例肝癌患者癌及癌旁组织中的CXCR7,6对样本癌组织中CXCR7表达水平较癌旁组织呈现上调趋势,其余4对样本癌和癌旁组织中的CXCR7表达无明显差异(图1B、1C)。

图1 CXCR7在肝癌细胞系及肝癌与癌旁组织中的表达情况Fig 1 CXCR7 expression in HCC cell lines and HCC specimens with adJacent noncancerous liver tissuesA:Western blot analysis was performed to detect CXCR7 protein expression in 8 cell lines,β-actin was used as a control to ensure equal loading.B:Expression of CXCR7 in 10 pairs of HCC specimens with adjacent noncancerous liver tissues (a:Tumor tissues;b:Para-carcinoma),blue arrows represented the up-regulation of CXCR7 expression in tumor tissues.C:Quantitative evaluation of CXCR7 in HCC specimens was analyzed by Quantity One.HCC specimens have higher CXCR7 level than adjacent noncancerous liver tissues (N:Adjacent noncancerous tissues;T:Tumor tissues).
慢病毒重组质粒的鉴定及CXCR7 shRNA干扰序列的筛选设计9条针对CXCR7的shRNA片段,构建重组质粒后检测脂质体介导的LM3细胞转染效率。将带有荧光标签的pcDNA3.1-GFP质粒与构建好的慢病毒重组质粒共转LM3细胞,瞬时转染48和72 h后,用荧光显微镜拍照。Lipofectamine 2000TM对LM3细胞毒性较小,细胞状态基本良好;LM3细胞易于转染,由GFP荧光强度估计转染效率至少为60%,从而推测重组质粒也能被高效地转入LM3细胞中(图2A)。构建稳定长效干扰CXCR7表达的LM3细胞株,以病毒颗粒LV-CXCR7 shRNA-3,4,5,139,566感染靶细胞,CXCR7蛋白表达水平下调明显(图2B);同时做两个内参,可见β-actin和GAPDH趋势一致。进一步利用qRT-PCR对目的基因CXCR7进行相对定量检测,以GAPDH为内参,当LV-CXCR7 shRNA-566感染LM3细胞时,CXCR7mRNA表达水平下调最为明显(图2C),提示慢病毒p LKO.1-CXCR7 shRNA-566表达载体对LM3细胞的CXCR7基因沉默效果较好。
干扰CXCR7表达对细胞增殖能力的影响CCK-8法分析CXCR7在细胞增殖中的作用。病毒颗粒LV-CXCR7 sh RNA-566感染靶细胞97L,嘌呤霉素筛选后,分别采用qRT-PCR和Western blot检测干扰效率,CXCR7 m RNA和蛋白表达水平均显著降低,表明靶向干扰CXCR7表达的97L稳转株构建成功,可用于后续实验(图3A、3B)。抑制CXCR7表达组的生长曲线较平缓,与空白对照组LM3及阴性对照组LM3-p LKO.1相比,干扰表达组LM3-CXCR7 sh RNA-566细胞的生长速度下降(图3C,P<0.05)。同理,与对照组相比,干扰97L细胞中CXCR7表达使细胞增殖能力减弱(P<0.05,图3D)。
靶向抑制CXCR7表达对细胞凋亡率的影响用Annexin V-FITC与PI对细胞进行双染色,流式细胞仪分析CXCR7在细胞凋亡中的作用。磷脂酰丝氨酸(phosphatidylserine,PS)在正常细胞中只存在于细胞膜的内侧,凋亡早期PS由胞膜内侧翻转到胞膜外侧,PS外翻可以通过Annexin V来检测。LM3-CXCR7 sh RNA-566实验组凋亡率为27.87%±0.53%,与对照组8.94%±0.13%相比,实验组凋亡率明显增高(图4A、4B);97L-CXCR7 sh RNA-566实验组凋亡率较对照组97L-p LKO.1也发生上调(图4C、4D)。凋之结果提示下调CXCR7表达可诱导凋亡的发生。

图2 构建稳定长效干扰CXCR7表达的LM3细胞株Fig 2 Stahle silencing of CXCR7 expression in LM3 cellsA:The transfection efficiency of LM3 cells was observed after transfection with recombinant plasmid for 48 and 72 h(×100);B:Western blot analyzed the efficiency of CXCR7 shRNAs;C:qRT-PCR confirmed the efficiency of CXCR7 specific shRNAs on CXCR7 mRNA expression.
讨 论

图3 干扰CXCR7表达对细胞增殖的影响Fig 3 The effect of depletion of CXCR7 on cell proliferationA and B:qRT-PCR and Western blot confirmed the efficiency of CXCR7 shRNA-566 on mRNA and protein expression of CXCR7,respectively;C and D:Stably transfected with a shRNA targeting CXCR7 in LM3 or 97L cells suppress cell proliferation.Asterisks indicate value vs.groups of LM3(or 97L)and LM3-p LKO.1(or 97L-p LKO.1),P<0.05.
CXCR7在多种肿瘤细胞表面及活化的内皮细胞中表达,但在正常的上皮及间质细胞中很少表达[9-11]。本研究比较了不同肝癌细胞系中CXCR7的内源表达,也发现正常肝细胞L02与无转移潜能的肝癌细胞Hep3B、HepG2和Huh7中CXCR7表达较低,而在有转移潜能的肝癌细胞97L、97H、LM3、LM6中CXCR7表达量增高,提示CXCR7的表达与肝癌转移潜能呈正相关。Miao等[11]发现乳腺癌、肺癌、横纹肌肉瘤、宫颈癌原位灶均有CXCR7表达。本研究也发现肝癌组织中CXCR7蛋白表达水平较癌旁显著提高。CXCR7蛋白在肝癌细胞及组织中均表达上调,提示CXCR7在肝癌进程中可能发挥重要的作用。
正常细胞的生长受细胞周期的严格调控,而肿瘤细胞的生长呈失控状态,可持续分裂与增殖。本研究使用慢病毒载体系统靶向沉默肝癌细胞中CXCR7的表达,CCK-8增殖实验发现CXCR7表达降低对细胞增殖呈明显的抑制作用。维持组织生长平衡的过程中,细胞增殖与细胞凋亡相互协调,尤其是细胞凋亡对组织更新和保持细胞数目恒定起重要作用。凋亡程序控制个体中大多数细胞,当代谢紊乱或基因组损伤无法修复时,机体能激活凋亡途径以清除有缺陷或者失活的细胞;而癌细胞能运用多种方式失活部分甚至全部凋亡机制而存活,并旺盛生长,因而有必要探索CXCR7表达水平与肝癌细胞的凋亡相关性。本研究发现干扰CXCR7表达,LM3细胞早期凋亡率由对照组的6.90%±0.90%显著上调为22.80%±0.86%;97 L细胞凋亡率由对照组的3.46%±0.52%上调为6.15%±1.03%。增殖实验与凋亡检测结果提示,CXCR7不仅能直接促进细胞增殖,还能通过抗凋亡的间接作用来促进肿瘤细胞生长。

图4 干扰CXCR7表达对细胞凋亡的影响Fig 4 The effect ofCXCR7 expression on cell apoptosisA and B:Apoptosis was analyzed by Annexin V-FITC/PI staining,data showed a substantial proportion of apoptotic cells in LM3-CXCR7 sh RNA-566 group whereas the vector transfect cells contained relatively few apoptotic;C and D:Rate of apoptosis was increased when down-regulation of CXCR7 in 97L cells,percent of apoptotic cells were shown on the picture.
其他实验室的工作也揭示了CXCR7的表达与肿瘤细胞的增殖和凋亡密切相关。Burns等[7]发现过表达CXCR7的人乳腺癌细胞株与野生型对照组相比,细胞存活能力与增殖能力明显增强。Xue等[12]通过siRNA技术干扰肝癌细胞株LM3中CXCR7表达,发现细胞增殖与侵袭能力均降低。在对膀胱癌与前列腺癌的研究中,也发现过表达CXCR7的细胞能通过阻止自身凋亡来促进细胞的增殖;而下调CXCR7表达能使细胞发生G1期阻滞从而抑制细胞的增殖效应[9,13]。
本研究证实CXCR7表达与肝癌恶性进程正相关,靶向沉默CXCR7表达可以抑制细胞增殖、诱导细胞凋亡,提示CXCR7可能为肝癌治疗提供一个新的靶点。但CXCR7在肝癌发生发展的调控过程中,是作为上游的细胞恶性转化调控因子还是下游的具体执行蛋白;是具有决定作用的关键蛋白还是只起到辅助作用的功能性蛋白,尚需要对CXCR7调控通路进行进一步的研究和探讨才能明确。
[1] Allen SJ,Crown SE,Handel TM.Chemokine:receptor structure,interactions,and antagonism[J].Annu Rev Immunol,2007,25:787-820.
[2] Sun X,Cheng G,Hao M,et al.CXCL12/CXCR4/CXCR7 chemokine axis and cancer progression[J].Cancer Metastasis Rev,2010,29(4):709-722.
[3] Olson TS,Ley K.Chemokines and chemokine receptors in leukocyte trafficking[J].Am J Physiol Regul Integr Comp Physiol,2002,283(1):R7-28.
[4] O'Hayre M,Salanga CL,Handel TM,et al.Chemokines and cancer:migration,intracellular signalling and intercellular communication in the microenvironment[J].Biochem J,2008,409(3):635-649.
[5] Muller A,Homey B,Soto H,et al.Involvement of chemokine receptors in breast cancer metastasis[J].Nature,2001,410(6824):50-56.
[6] Balabanian K,Lagane B,Infantino S,et al.The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes[J].J Biol Chem,2005,280(42):35760-35766.
[7] Burns JM,Summers BC,Wang Y,et al.A novel chemokine receptor for SDF-1 and I-TAC involved in cell survival,cell adhesion,and tumor development[J].J Exp Med,2006,203(9):2201-2213.
[8] Shimizu N,Soda Y,Kanbe K,et al.A putative G proteincoupled receptor,RDC1,is a novel coreceptor for human and simian immunodeficiency viruses[J].J Virol,2000,74(2):619-626.
[9] Hao MG,Zheng JH,Hou KL,et al.Role of chemokine receptor CXCR7 in bladder cancer progression[J].Biochem Pharmacol,2012,84(2):204-214.
[10] Tripathi V,Verma R,Dinda A,et al.Differential expression of RDC1/CXCR7 in the human placenta[J].J Clin Immunol,2009,29(3):379-386.
[11] Miao ZH,Luker KE,Summers BC,et al.CXCR7 (RDC1)promotes breast and lung tumor growthin vivoand is expressed on tumor-associated vasculature[J].Proc Natl Acad Sci USA,2007,104(40):15735-15740.
[12] Xue TC,Chen RX,Han D,et al.Down-regulation of CXCR7 inhibits the growth and lung metastasis of human hepatocellular carcinoma cells with highly metastatic potential[J].Exp Ther Med,2012,3(1):117-123.
[13] Singh RK,Lokeshwar BL.The IL-8-regulated chemokine receptor CXCR7 stimulates EGFR signaling to promote prostate cancer growth[J].Cancer Res,2011,71(9):3268-3277.
Effects of inhihitingCXCR7 gene expression on hiological characteristics of human hepatocellular carcinoma(HCC)cell lines
LIN Ling1,HAN Mei-mei1,WANG Fang1,SHEN Hua-li1,2,YU Hong-xiu1,3△,YANG Peng-yuan1,2
(1Institutes of Biomedical Sciences,Fudan University,Shanghai200032,China;2Departments of Chemistry,3School of Life Sciences,Fudan University,Shanghai200433,China)
hepatocellular carcinoma(HCC); CXCR7 gene; short hairpin RNA (sh RNA);proliferation; apoptosis
R 735.7
A
10.3969/j.issn.1672-8467.2014.02.004
2013-05-17;编辑:段佳)
卫生部“艾滋病和病毒性肝炎等重大传染病防治”重大专项(2012ZX10002012-006);上海市卫生局基金(2009002)
△Corresponding author E-mail:hongxiuyu@fudan.edu.cn
【Ahstract】 OhJectiveTo explore the expression of chemokine receptor CXCR7 on human hepatocellular carcinoma(HCC)cell lines and tumor samples,and the effects of CXCR7 on cell proliferation and apoptosis of HCC cell lines.MethodsWestern blot analysis was applied to detect CXCR7 protein expression in HCC cell lines and 10 pairs of HCC specimens with adjacent tissues.RNA interference method of short hairpin RNA (shRNA)was used to silenceCXCR7 expression in HCCLM3 and MHCC97L cells.The expressions ofCXCR7 mRNA and protein were determined by qRT-PCR and Western blot,respectively.The effects ofCXCR7 down-regulation on cell proliferation and apoptosis were measured by CCK-8 assay and Annexin V-FITC/PI apoptosis detection.ResultsThe CXCR7 expression was gradually enhanced with increasing metastatic potential of HCC cell lines,and compared to adjacent tissues of clinical specimens,CXCR7 expression was hugely increased in tumor tissues.Nine lentiviral expressing vectors were constructed successfully and stably transfected into HCCLM3 cells.Based on their effects on CXCR7 expression,CXCR7 shRNA-566 was selected to evaluate the effects of down-regulation of CXCR7 on proliferation and apoptosis of HCCLM3 and MHCC97L cells in vitro.It was found that CXCR7 shRNA-566 could significantly inhibit the proliferation of HCCLM3 and MHCC97L cells (P<0.05).Flow cytometry assay showed that depletion of CXCR7 expression could induce cell apoptosis.ConclusionsCXCR7 expression is positively associated with HCC progression,and interference targeted of CXCR7 expression inhibit cell proliferation and induce apoptosis.
*This work was supported hy the National Science and Technology MaJor ProJect(2012ZX10002012-006)and Shanghai Municipal Health Bureau Foundation(2009002).
