针对HSV-2 LAT ORF的siRNA在病毒潜伏激活中的作用
2014-08-02孙朝晖杨慧兰危敏林武荣冼江
孙朝晖,杨慧兰,危敏,林武荣,冼江
针对HSV-2 LAT ORF的siRNA在病毒潜伏激活中的作用
孙朝晖,杨慧兰,危敏,林武荣,冼江
目的观察疱疹病毒2型潜伏相关转录子开放阅读框架(HSV-2 LAT ORF)在病毒潜伏感染激活中的作用。方法体外建立HSV-2潜伏感染及复发的神经细胞模型,对病毒在细胞中的潜伏和激发进行PCR验证及测序;设计针对LAT ORF的siRNA,激活诱导后转染SH-SY5Y细胞,检测转染前后LAT ORF的表达改变;制备HSV-2基因表达谱芯片,利用芯片分析抑制LAT ORF后病毒基因表达的改变。结果在人神经母细胞瘤细胞株SH-SY5Y上成功建立了HSV-2潜伏感染及激活的细胞模型,LAT、gG基因PCR扩增及电泳结果证实了病毒在细胞中的潜伏及激活;LAT ORF-siRNA转染细胞24、36、48h后,LAT ORF mRNA的表达水平分别降低了39%、51%和60%。基因芯片分析干扰后病毒基因表达,共有28个基因出现差异表达,其中24个基因下调,4个基因上调。结论LAT ORF在HSV-2潜伏感染激活中发挥了重要作用,为下一步分析LAT在病毒潜伏激活中的调控机制奠定了基础。
疱疹病毒2型;病毒潜伏期;RNA干扰;寡核苷酸序列分析
疱疹病毒2型(HSV-2)是人类病毒性疾病的常见病原体之一,其潜伏感染及激发是生殖器疱疹易复发、难根治的主要原因。潜伏相关转录子(LAT)编码蛋白在HSV感染的复发中起重要作用,是研究HSV感染复发过程中信号转导途径及特异性基因治疗的理想靶标。本研究建立稳定的HSV-2潜伏感染及激活细胞模型,并针对HSV-2 LAT 开放阅读框架(ORF)区设计siRNA进行RNA干扰,观察HSV-2 LAT ORF表达被抑制后病毒基因组表达的变化,探寻LAT ORF介导病毒潜伏激活的途径。
1 材料与方法
1.1 主要试剂与仪器 单链寡核苷酸接头(SIP 5'-pGATCm CACACCAGCCAAACCCA-3'及SIR 5'-GGTTTGGCTGGTGTG-3')采用O ligo 6.0软件设计,由G ib co公司进行合成、纯化及SIP5'端磷酸化;RD-PCR通用引物U(5'-GTTTGGCTGGTGTGGATC-3'),Cy5标记的通用引物,分组引物UA、UT、UC、UG由本室自行合成;GenePix 4000B scanner购自美国GenePix科技有限公司。HSV-2 333标准株由中国预防医学科学院病毒研究所提供,病毒复苏后,接种Vero细胞单层增殖,测定病毒毒力[1]。人神经母细胞瘤细胞株SH-SY5Y购自中国医学科学院基础医学研究所,细胞培养于含10%胎牛血清的RPM I 1640培养基中,生长至80%融合时进行传代培养。
1.2 方法
1.2.1 HSV-2在SH-SY5Y细胞中潜伏感染模型的建立 弃掉旧培养液,加入0.25%胰酶消化液1~3m l,37℃消化细胞2~5m in,显微镜观察贴壁细胞形状变圆至脱离瓶壁,加等体积含10% FCS的RPM I 1640终止消化,500~1000r/m in离心1~2m in,弃上清,加入含10% FCS的RPM I 1640培养液,用吸管吹打使细胞悬浮,调整细胞数目至约1.0×105个/cm3,各加入1m l至24孔板中(2cm2/孔),培养24h待细胞贴壁生长后,弃上清,加入含10% FCS的RPM I 1640培养液,加入60μmol/L无环鸟苷(ACV)100μl,培养过夜,吸去上清,将含有5MOI的病毒液100μl接种于孔板中,并于37℃吸附1h,加入含2.0% FCS的RPM I 1640维持培养液,37℃、5%CO2培养箱中培养,相差显微镜下观察细胞形态。
1.2.2 HSV-2在SH-SY5Y细胞中潜伏感染激发的诱导 在24孔板中,将潜伏感染8d的细胞放入温度为43℃的水浴箱1.5h,相差显微镜下观察细胞形态。
1.2.3 HSV-2在SH-SY5Y细胞中潜伏、激发的验证 分别在H SV-2感染SH-SY 5Y细胞的第4、6、8天取24孔板培养上清进行PCR验证;取感染后第8天24孔板,43℃加热1.5h,取加热完成后12、24、36h的上清进行PCR验证。PCR引物:H SV-2 LAT基因上游引物5'-GCCAGACGTGCGTGCTCTGCACGAT-3',下游引物5'-TGTTGGTCTTTATCATAGAACAGAG-3',位置为基因组12 1 343-121 492,扩增条带大小为15 0b p;H SV-2 gG基因上游引物5'-GACCCAAAGACGCACCCACA-3',下游引物5'-CCAAGGCGACCAGACA AACG-3',位置为基因组139、478~141、988,扩增条带大小为412bp。采用测序仪测序并将结果与GenBank数据库进行BLAST同源性比较。
1.2.4 针对LAT ORF基因的siRNA设计及合成参照GenBank中HSV-2 333株LAT基因的ORF序列(M 69065),设计针对该序列的3对siRNA,其序列及在LAT基因ORF序列中的相对位置如表1所示,同时合成阴性对照siRNA。

表1 针对HSV-2 ORF的siRNA序列Tab.1 Sequences of the siRNAs targeting HSV-2 LAT ORF
1.2.5 siRNA转染靶细胞 选择加热处理后的SHSY5Y细胞进行转染实验,具体操作按试剂说明进行。转染实验分为siRNA组、阴性对照组及空白对照组(未加siRNA及转染试剂),每组设3个复孔。siRNA 组每孔加入100μl转染复合物(0.8μg siRNA溶于50μl RPM I 1640+2μl Lipofectam ine 2000溶于48μl RPM I 1640中),阴性对照组每孔加入100μl转染复合物(0.8μg阴性对照siRNA溶于50μl RPM I 1640+2μl Lipofectam ine 2000溶于48μl RPM I 1640中),空白对照组每孔只加入100μl RPM I 1640。将24孔板放于37℃、5%CO2细胞培养箱中孵育4h,更换含10% FCS的RPM I 1640培养液继续培养,转染24~72h后进行分析。
1.2.6 RT-PCR半定量检测转染前后HSV-2 ORF基因的表达 收集siRNA转染前后细胞,用Trizol法提取细胞总RNA,DEPC水溶解后测定浓度及比值。37℃水浴DNaseⅠ消化痕量污染基因组DNA 2h后,利用引物oligo(dT)18、反转录酶AMV于42℃进行反转录,得到的反应液用于RT-PCR反应。
1.2.7 基因芯片探针制备 在Vero细胞中增殖HSV-2,取上清,采用限制性显示技术(restriction disp lay,RD)制备探针,采用PAGE结合银染法分离靶基因片段并进行3次PCR,具体方法参照文献[2-4]进行。
1.2.8 芯片点样与固定 加50% DMSO将探针浓度调整为300μg/m l,按编号顺序依次加入384孔板。阳性对照探针选自经过测序验证的痘苗病毒基因片段,阴性对照探针的基因片段来自人白细胞基因。芯片打印方式:每个阵列15×30,每个探针打3个点,共150条探针,其中2个GAPDH基因为阳性对照,10个水稻片段为阴性对照,5个50% DMSO为空白对照(图1)。将芯片正面朝下置于3×SSC盐水湿盒上方再水合化,然后迅速置入100℃温箱中干燥,用紫外交联仪以65m J的总能量进行交联固定,以使探针共价交联结合在玻片表面。样品标记:分别取对照组及siRNA组细胞提取总RNA,反转录为cDNA,利用RD-PCR技术进行样品标记[2-3],对照组用Cy3进行标记,实验组用Cy5进行标记。
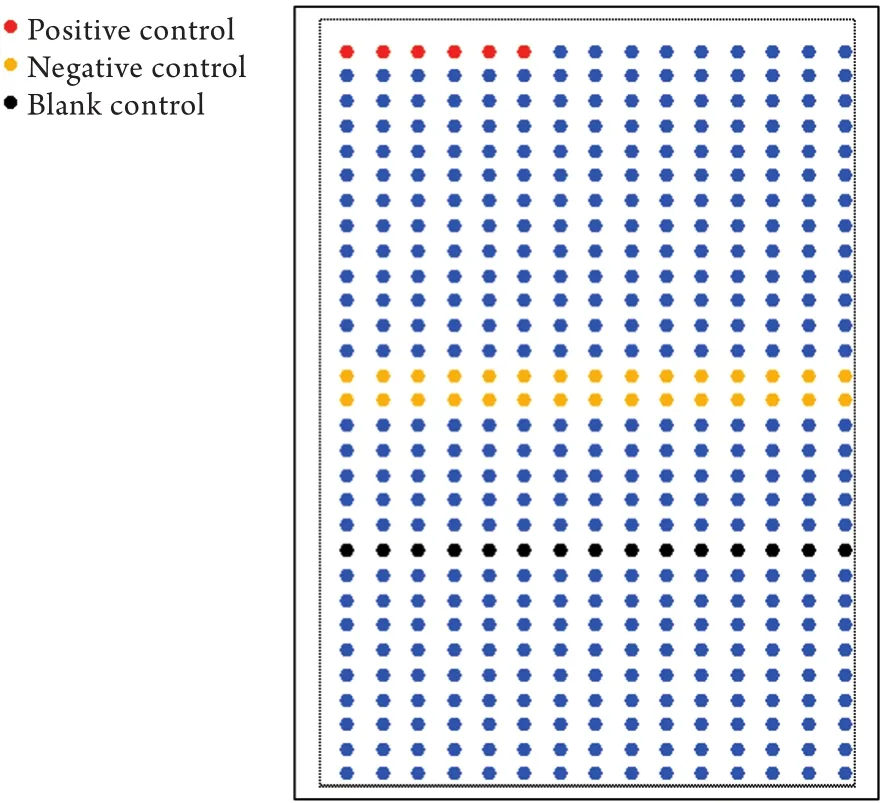
图1 芯片的打印点阵设计Fig.1 Design format of DNA microarray
1.3 统计学处理 采用Feature extraction 7.0软件进行数据分析及标准化处理。
2 结 果
2.1 HSV-2在SH-SY5Y细胞中潜伏感染时的细胞形态观察 从病毒接种第0天开始观察细胞形态,至第14天,HSV-2在SY5Y细胞中均能保持潜伏状态,细胞形态与正常细胞无明显差异。第14天后,细胞出现较大量变圆、死亡现象。在本实验中,HSV-2在SH-SY5Y细胞中最长可潜伏14d。
2.2 HSV-2潜伏感染SH-SY5Y细胞激活后的形态观察 荧光倒置显微镜观察发现,培养的SH-SY5Y对照细胞呈单层生长,细胞呈多角形或梭形,细胞突起长而多,形成树枝状网络(图2A)。胞核圆形或椭圆形,有1~2个清晰的核仁,可见双核细胞,胞质较丰富,易见分裂象细胞。24h出现灶性细胞病变,主要为细胞逐渐变圆、变大,核变大、核膜移位,折光性变差(图2B)。48h病变范围呈片状扩大,可见多数细胞融合成多核巨细胞,染色体边聚、核破碎(图2C)。72h大部分细胞脱落,多核巨细胞裂解(图2D)。
2.3 HSV-2在SH-SY5Y细胞中潜伏、激发的验证在HSV-2潜伏感染SY5Y细胞的第4、6、8天,分别取上清进行PCR,结果显示LAT基因均有表达,而编码gG蛋白的基因未表达,提示处于病毒潜伏期(图3A)。激活后12、24、36h,LAT基因及gG基因均有表达(图3B),提示病毒在细胞中已被激活,病毒基因组大量复制。将扩增出的PCR产物分别进行测序验证,测序结果清晰,信噪比高,经BLAST比对与HSV-2 LAT及gG基因序列相符。

图2 HSV-2潜伏感染SH-SY5Y细胞激活后的形态学改变(相差显微镜 ×200)Fig.2 Morphological changes of SH-SY5Y cells latently infected and reactivated w ith HSV-2(Phase contrast m icroscope ×200) A.Control; B.24h post-reactivation; C.48h post-reactivation; D.72h post-reactivation

图3 HSV-2 gG、LAT基因PCR扩增产物电泳图Fig.3 Electrophoresis of PCR products of HSV-2 LAT and gG geneM.DL2000 standard DNA ladder.A.1, 2, 3.gG gene on 4, 6, 8d post latent infection; 4, 5, 6.LAT gene on 8, 6, 4d post latent infection; B.1, 2, 3.gG gene on 12, 24, 36h post reactivation; 4, 5, 6 LAT gene on 12, 24, 36h post reactivation
2.4 siRNA对LAT mRNA基因表达的影响 从图4可见,空白、阴性对照组LAT mRNA表达量基本无差异,但LAT ORF-siRNA转染后细胞的mRNA表达明显减少。490bp处为内参照GAPDH的特异扩增条带,150bp处为LAT的特异性扩增条带。采用UV凝胶图像分析仪分析电泳结果,转染后24、36和48h,LAT ORF mRNA的表达量分别降低了39%、51%和60%。
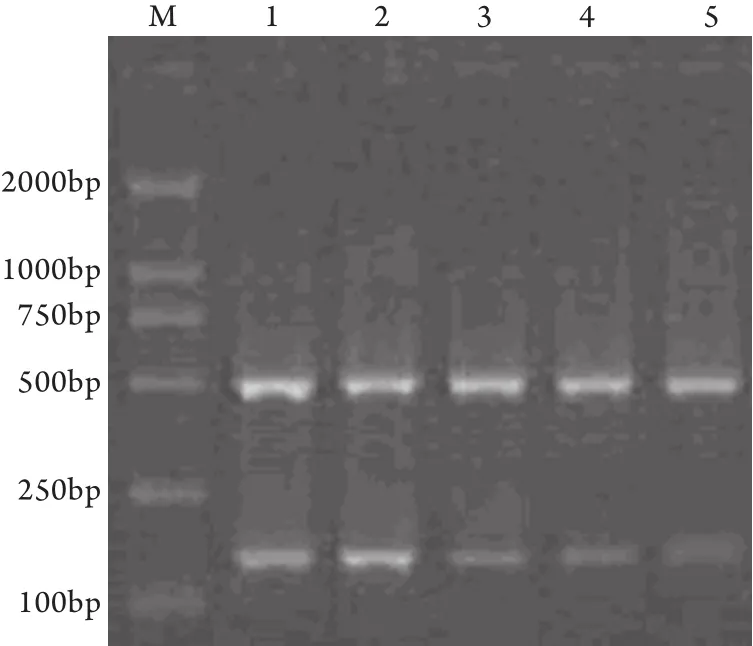
图4 LAT ORF mRNA RT-PCR凝胶电泳图Fig.4 Electrophoresis of the RT-PCR products of LAT ORF mRNAM.DL 2000; 1.Blank control; 2.Negative control; 3.24h after transfection; 4.36h after transfection; 5.48h after transfection
2.5 探针RD-PCR的制备 PAGE结合银染法可清晰显示HSV-2的RD片段(图5),每组平均有7~10条清楚的DNA带,片段长度主要分布在250~750bp。
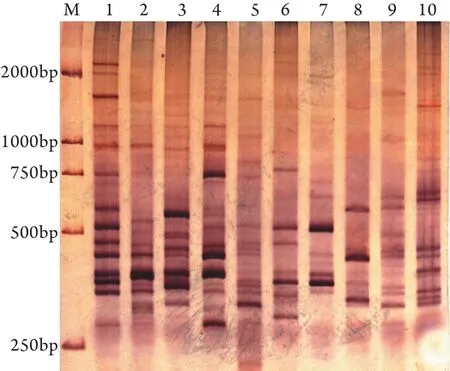
图5 HSV-2 RD-PCR PAGE结合银染法分组图谱Fig.5 RD-PCR patterns of HSV-2 genes, PCR products separated by electrophoresis and stained with sliverM.Marker; 1-10.Positive clones of HSV-2 RD production
2.6 HSV-2 RD产物阳性克隆的PCR鉴定 干胶片切胶回收后,进行3次PCR,HSV-2 PCR产物AT克隆得到的阳性克隆,用pMD 18-T载体引物进行PCR扩增,并行1.5%琼脂糖凝胶电泳鉴定,结果见图6。从电泳图可见扩增条带单一清晰,大小200~800bp。将扩增出的PCR产物分别进行测序验证,测序结果清晰,信噪比高,经BLAST比对与HSV-2基因序列相符。
2.7 样品与芯片杂交后的扫描结果 Cy3标记对照组HSV-2 mRNA,Cy5标记siRNA组HSV-2 mRNA。由红色至蓝色表示信号由强至弱。将Cy3和Cy5扫描图像完全重叠后,红色表示高表达,绿色表示低表达,黄色表示表达水平无改变(图7)。
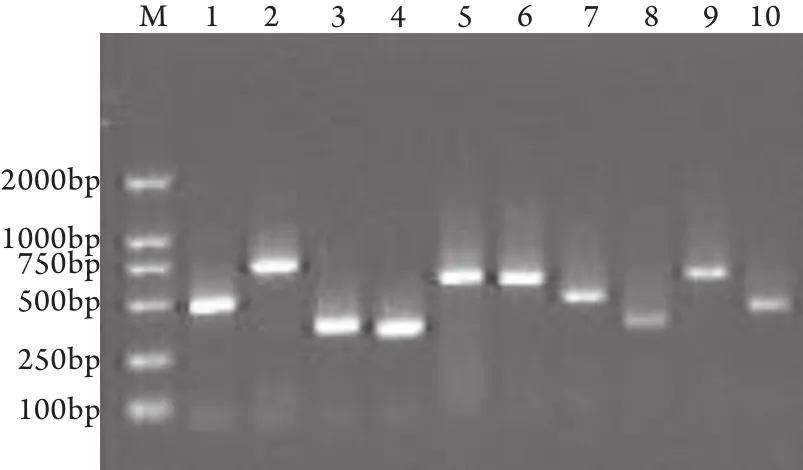
图6 HSV-2 RD产物阳性克隆的PCR鉴定Fig.6 Identification of the positive clone of the RD product of HSV-2M.Marker; 1-10.Positive clones of HSV-2 RD production
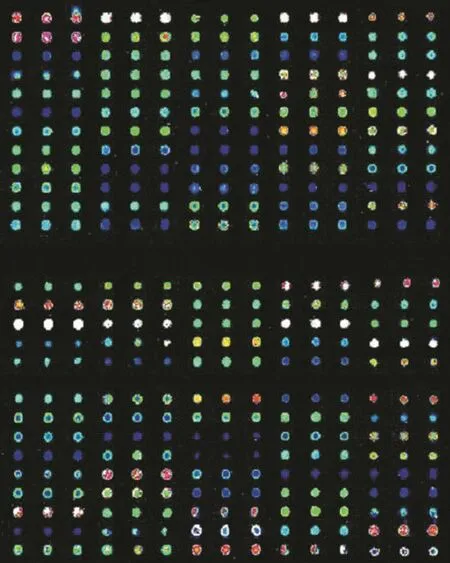
图7 芯片杂交结果(90%激光强度和70%增益值)Fig.7 Hybridization results of microarray (90% laser energy and 70% GMT)
2.8 杂交结果分析 对重复杂交的两张芯片array1、array2结果进行分析,计算每点的平均荧光信号强度,运用SPSS 10.0软件进行相关性分析,并绘制散点图,结果显示相关系数为0.986,P<0.001,表明芯片重复性较好。
2.9 差异表达基因 采用QuantArray软件分析RD标记的芯片杂交图中Cy3和Cy5两种荧光信号的强度及其比值。结果显示,大部分基因表达下调,只有少数表达上调的基因。siRNA组与对照组比较,探针杂交信号Cy5/Cy3比值(array ration)>2.0表示基因高表达,<0.5表示基因低表达,进一步分析共有28个基因表达发生了较为明显的表达变化,其中24个基因上调,4个基因下调,表2列出了部分差异表达基因。
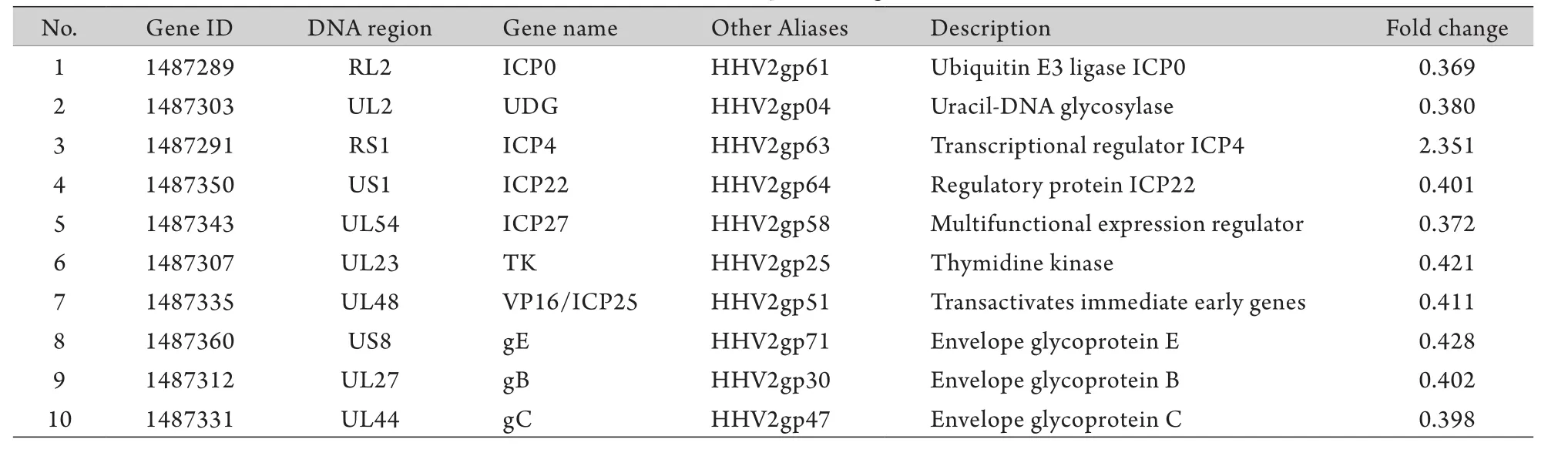
表2 差异表达的部分HSV-2基因Tab.2 Differential expression gene of HSV-2
3 讨 论
HSV-2病毒基因组为线性双链DNA分子,大小约为152kb,由共价连接的长片段(L)和短片段(S)组成,两者分别占病毒DNA的82%和18%,每一片段由中间的独特序列(U)和两端的倒置重复序列组成。HSV-2的主要LAT内的3个ORF分别被命名为ORF1、ORF2和ORF3,各含有214、74和119个密码子,其ATG分别位于HSV-2主要LAT序列的第784、1267和1496位碱基上。我们在设计siRNA过程中选出3个序列,分别针对HSV-2的3个ORF,从实验结果来看取得了较强的沉默效果,转染后24、36、48h,LAT ORF mRNA表达水平分别下降了39%、51%和60%。细胞形态学观察发现,siRNA转染组在加热处理后20~22h开始出现细胞裂解反应,较对照组晚3~5h,但两组细胞形态变化基本一致。
诊断芯片探针的制备一般通过以下两种途径实现:①分子克隆结合PCR扩增基因片段;②在DNA合成仪上人工合成寡核苷酸片段。后者合成大量探针成本高,且长度超过70bp的错配率明显增加[4-5]。为此,本实验采用的是前一种方法。RD技术采用限制性内切酶Sau3AⅠ切割cDNA,然后接上互补接头,再根据接头序列设计通用引物及其3'端延伸若干个碱基的选择性引物进行PCR扩增,使扩增产物有序归类,最后通过电泳显示扩增片段,切胶、3次PCR分离基因片段,可以高效地分离到多个基因片段。在进行分组PCR时,某些组会出现分离片段大小接近而无法用普通琼脂糖凝胶电泳分离的情况,我们利用5%聚丙烯酰胺凝胶电泳分离,电泳结束后银染显色。
对HSV-2 LAT ORF进行干扰后分析差异表达基因,结果显示ICP0表达明显下调(表2)。ICP0具有泛素连接酶E3 (enzyme 3,E3)功能域,可通过多种途径调控病毒基因组及宿主细胞中的基因转录,在调控裂解性感染与潜伏性感染平衡过程中起重要作用[6]。ICP0由编码1~19、20~241、242~775密码子的3个外显子构成的mRNA翻译而来,共含有775个氨基酸残基,可导致特定核结构ND10的降解,与其刺激病毒感染以及激活转录密切相关[7]。另外,ICP0与去乙酰酶(HDAC)4、5、7氨基端之间的相互作用抵消了HDAC氨基端相关的抑制活性,明显地增加了转录活性[8]。除ND10、HDACs外,ICP0还可通过与转录因子BMAL1相互作用而激活转录[9]。自1991年Doerig等[10]首次采用免疫细胞化学及Western blotting方法发现并证实了HSV LAT编码蛋白的存在后,进一步研究显示,LAT蛋白对病毒潜伏及再激活有重要意义,能编码对病毒激活起促进作用的有生物活性的蛋白,对ICP0等起调节作用[11]。Thomas等[12]认为LAT ORF编码一个约30kD的蛋白,功能类似ICP0,在病毒再激活的早期阶段起作用,LAT ORF可以调节甚至替代ICP0在BHK和ND7细胞中的作用,该ORF的表达受严格调控,在潜伏感染时并不表达,而在一些能够激活潜伏HSV的信号存在的条件下,才会被转录和翻译。本研究结果显示,对HSV LAT ORF进行干扰抑制后,降低了LAT对ICP0的调节功能,导致ICP0表达下降。
本研究对差异表达基因进行分析时还观察到ICP4的表达上调。ICP4对于神经细胞从潜伏状态中再激活也是必需的,它可以促进早期基因和晚期基因的表达。ICP4是由病毒编码的磷蛋白,大小约85kD,在病毒感染期间,以同形二聚体的形式存在于感染细胞的胞核中。ICP4为E和L基因的转录激活所必需,LAT对ICP4有反向调节作用[13],推测LAT mRNA受到抑制后ICP4表达上调;HSV-2激活过程中即刻早期基因IE的表达也分先后顺序,首先为ICP0、LAT、ICP4等的表达,随后为ICP27、VP16、RR等[14],当病毒ICP0、LAT表达下调时,有可能引起ICP4代偿性上调而继续触发激活。
此外,本研究还发现RNA干扰后胸苷激酶(TK)表达下调。有研究认为潜伏HSV在体内的再激活与TK有关[15]。TK由HSV早期基因E基因编码合成,能使胸苷(T)或脱氧胞苷(dC)磷酸化。在处于增殖和生长期的细胞中,HSV DNA的复制不需要TK的活性,但是当细胞处于静止期或血清饥饿时,HSV DNA的复制则有赖于TK的活性,因为TK的激酶活性可提高这些细胞中三磷酸胸腺啶(TTP)的水平。ICP22及VP16表达下调,这两者共同参与HSV-2的基因转录调控[16]。ICP22分子量约68kD,主要定位于细胞核的多功能蛋白中,能够影响一些细胞周期蛋白的活性和表达水平[17-18]。近期研究提示,ICP22与被感染细胞RNA polⅡ的磷酸化程度异常有关,提示ICP22在病毒DNA合成开始之前和之后发挥了不同的生物学功能[19]。同时,对HSV-1突变体的研究亦提示,ICP22在病毒基因转录水平上也具有重要的调节作用[20]。这一点得到了其他疱疹病毒家族成员,包括猪、马、牛和水痘-带状疱疹病毒ICP22同源蛋白相关研究的支持[21]。这些ICP22同源蛋白均已被确认为转录调控因子[22]。VP16是病毒的一种内膜蛋白,ICP22对病毒α基因的转录调节作用可被VP16蛋白解除,而VP16发挥该作用依赖于α基因上游的特定序列,表明ICP22与VP16之间存在某种分子生物学的关联,两者可能作为一对调节因子对α基因转录进行协同调控。有研究表明,VP16与宿主细胞因子Oct-1和HCF结合形成VP16诱导复合物,该复合物与病毒α基因启动子区通用转录激活元件TAATGARAT结合,继而VP16羧基端高效的激活功能域可募集相应的细胞转录因子激活α基因转录[23-24]。VP16通过形成诱导复合物锚定于启动子区并与相应转录因子作用,从而行使其转录激活功能。ICP22与转录复合物中各种转录因子存在相互作用,可推测VP16和ICP22对α基因的转录协同调控可能是通过二者与转录复合物中相关蛋白因子的某种未知作用实现的。对LAT ORF的抑制引起ICP22及VP16的下调是否由于ICP0的下调或是其他通路引起,还有待于进一步研究证实。
[1] Sun ZH, Shi YL, Xian J, et al.Study on infection and proliferation of HSV-2 in Vero cells[J].J Clin Res, 2009, 26(5): 753-756.[孙朝晖, 石玉玲, 冼江, 等.HSV-2 333株在Vero细胞中持续感染及增殖特性研究[J].医学临床研究, 2009, 26(5): 753-756.]
[2] Sun ZH, Zheng WL, Zhang B, et al.M icroarray for the detection of HBV and HDV[J].J Biochem Mol Biol, 2004, 7(5): 546-551.
[3] Sun ZH, Wang SY, Wei M, et al.Preparation and clinical application of cDNA m icroarray for combined detection of hep atitis virus[J].J Med Chin PLA, 2007, 32(11): 1179-1183.[孙朝晖, 王蜀燕, 危敏, 等.病毒性肝炎联合诊断cDNA芯片的研制与临床应用性研究[J].解放军医学杂志, 2007, 32(11): 1179-1183.]
[4] Sergei GB, James PA, Vladim ir MZ, et al.Portable system for m icrobial sample preparation and oligonucleotide m icroarray analysis[J].Appl Environ M icrobial, 2001, 67(2): 922-928.
[5] Sun ZH, Zheng W L, Zhang B, et a l.M icroarrays fo r detectingHBV and HDV simultaneously[J].Med J Chin PLA, 2004, 29(4): 327-329.[孙朝晖, 郑文岭, 张宝, 等.乙型肝炎、丁型肝炎病毒联合诊断芯片制备的初步研究[J].解放军医学杂志, 2004, 29(4): 327-329.]
[6] Preston CM.Repression of viral transcription during herpes simplex virus latency[J].J Gen Virol, 2000, 81(1): 1-19.
[7] Everett RD.ICP0, a regulator of herpes simplex virus during lytic and latent infection[J].Bioessays, 2000, 22 (8): 761-770.
[8] Lomonte P, Thomas J, Texier P, et al.Functional interaction between Class II histone deacetylases and ICP0 of herpes simplex virus type 1[J].J Virol, 2004, 78(13): 6744-6757.
[9] Kawaguchi Y, Tanaka M, Yokoymama A, et al.Herpes simplex virus 1 alpha regulatory protein ICP0 functionally interacts with cellular transcription factor BMAL1[J].Proc Natl Acad Sci USA, 2001, 98(4):1877-1882.
[10] Doerig C, Pizer LI, Wilcox CL.An antigen encoded by the latency associated transcript in neuronal cell cultures latently infected w ith herpes simplex type 1[J].J Virol, 1991, 65(5): 2724-2727.
[11] Thomas SK, Gough G, Latchman DS, et al.Herpes simplex virus latency-associated transcript encodes a protein which broatly enhances virus grow th can compensate for deficiencies in immediate-gene expression and is likely to function during reaction from virus latency[J].J Virol, 1999, 73(8): 6618-6625.
[12] Thomas SK, Lilley CE, Latchman DS, et al.A protein encoded by the herpes simplex virus (HSV) type 1 2-kilobase-associated transcript is phosphorylated, localized to the nucleus,and overcomes the rep ression o f exp ression from exogenous promotes when inserted into the quiescent HSV genome[J].J Virol, 2002, 76(8): 4056-4067.
[13] Halford WP, Kemp CD, Isler JA, et al.ICP0, ICP4, or VP16 exp ressed from adenovirus vectors induces reactivation of latent herpes simplex virus type 1 in primary cultures of latently infected trigem inal ganglion cells[J].J Viral, 2001, 75(13): 6143-6153.
[14] Danaher RJ, Jacob RJ, M iller CS.Reactivation from quiescence does not coincide with a global induction of herpes simplex virus type 1 transactivatior[J].Vrius Genes, 2006, 33(2): 163-167.
[15] Kosz-Venechak M, Jacoboson J, Coen DM, et al.Evidence for a novel regulatory pathway for erpes simplex virus gene expression in trigeminal ganglion neurons[J].J Virol, 1993, 67(23): 5383-5393.
[16] Cun W, Guo L, Zhang Y, et al.Analysis of the function of ICP22 and VP16 col-participating on genetic transcriptional control of α gene[J].Sci China C, 2008, 38(12): 1123-1129.[寸伟, 郭磊,张莹, 等.HSV-1立即早期蛋白ICP22与VP16共同参与α基因转录调控的初步分析[J].中国科学C辑, 2008, 38(12): 1123-1129.]
[17] Advani SJ, Brandim arti R, Weichselbaum RR, et al.The disappearance of cyclins A and B and the increase in activity of the G2/M-phase cellular kinase cdc2 in herpes simplex virus 1infected cells require expression of the a22/US1.5 and UL13 viral genes[J].J Virol, 2000, 74(1): 8-15.
[18] Durand LO, Advani SJ, Poon APW, et al.The carboxyl-term inaldomain of RNA polymeraseⅡ is phosphorylated by a complex containing cdk9 and infected-cell protein 22 of Herpes Simplex Virus 1[J].J Virol, 2005, 79(11): 6757-6762.
[19] Fraser KA, Rice SA.Herpes simp lex virus imm ediate-early protein ICP22 triggers loss of serine 2-phosphorylated RNA polymeraseⅡ[J].J Virol, 2007, 81(10): 5091-5101.
[20] Rice SA, Long MC, Lam V, et al.Herpes sim p lex virus immediate-early protein ICP22 is required for viral modification of host RNA polymeraseⅡand establishment of the normal viral transcription program[J].J Virol, 1995, 69(9): 5550-5559.
[21] Debrus S, Sadzot-Delvaux C, Nikkels AF, et al.Varicellazoster virus gene 63 encodes an immediate-early protein that is abundantly expressed during latency[J].J Virol, 1995, 69(5): 3240-3245.
[22] Koppel R, Vogt B, Schwyzer M.Imm ed iate-early p rotein BICP22 of bovine herpesvirus 1trans-represses viral promoters of different kinetic classes and is itself regulated by BICP0 attranscriptional and posttranscriptional levels[J].Arch Virol, 1997, 142(12): 2447-2464.
[23] Babb R, Huang CC, Aufiero DJ, et al.DNA recognition by the herpes simplex virus transactivator VP16: a novel DNA-binding structure[J].Mol Cell Biol, 2001, 21(14): 4700-4712.
[24] Mahajan SS, Little MM, Vazquez R, et al.Interaction of HCF-1 with a cellular nuclear export factor[J].J Biol Chem, 2002, 277(45): 44292-42299.
Effects of siRNA targeting HSV-2 LAT ORF on the virus latency and reactivation
SUN Zhao-hui1, YANG Hui-lan1, WEI M in2, LIN Wu-rong3, XIAN Jiang11Department of Clinical Laboratory, General Hospital of Guangzhou Command, Guangzhou 510010, China
2Institute of Genetic Engineering, Southern Medical University, Guangzhou 510515, China
3Department of Clinical Laboratory, Lanhe Hospital of Nansha District, Guangzhou 511480, China
ObjectiveTo observe the role of open reading frame (ORF) of herpes virus 2 (HSV-2) latency associated transcript (LAT) in reactivation of latent virus infection.MethodsThe neural cell model of HSV-2 latent infection and reactivation in SH-SY5Y cells was established.PCR was used to authenticate the latency and reactivation of HSV-2 and then sequenced.siRNAs targeting the mRNA of HSV LAT ORF were designed and transfected into SH-SY5Y cells through Lipofectam ineTM2000 reagent.The expression of LAT ORF mRNA before and after transfection was assayed by RT-PCR.cDNA m icroarray was prepared to study the changes of gene expression profiles of HSV-2 after inhibition of LAT ORF mRNA.ResultsThe neural cell model system of HSV-2 latent infection and reactivation was established successfully in SH-SY5Y cells.PCR results of LAT and gG genes proved the latency and reactivation of virus.The mRNA expression of LAT ORF in the cells treated by HSV LAT ORF-siRNA at 24, 36 and 48h were significantly reduced by 39%, 51% and 60%, respectively.After hybridization, a statistic analysis following microarray scanning showed that 28 genes differentially expressed in the LAT-siRNA transfected cells as contrast to untransfected cells.An increase of expression was found in 4 genes and a decrease in 24.ConclusionLAT ORF plays an important role in the reactivation of HSV-2 latent infection, and it provides a foundation for understanding the regulatory mechanism of LAT in latent infection and reactivation of HSV-2.
herpesvirus 2; virus latency; RNA interference; oligonucleotide array sequence analysis
R373-33
0577-7402(2014)02-0109-07
10.11855/j.issn.0577-7402.2014.02.06
2013-08-17
2013-10-29)
(责任编辑:李恩江)
This work was supported by the Science and Technology Plan of Guangdong Province (2011B061300021)
广东省科技计划项目(2011B061300021)
孙朝晖,医学博士,主任技师。主要从事病毒功能基因组学方面的研究
510010 广州 广州军区广州总医院检验科(孙朝晖、杨慧兰、冼江);510515 广州 南方医科大学基因工程研究所(危敏);511480 广州 广州南沙榄核医院检验科(林武荣)
