瑞舒伐他汀对急性冠脉综合征患者CD4+T淋巴细胞m iRNA表达的影响
2014-08-02谈红陈瑞敏李晓燕张红明杨永耀陈英剑
谈红,陈瑞敏,李晓燕,张红明,杨永耀,陈英剑
瑞舒伐他汀对急性冠脉综合征患者CD4+T淋巴细胞m iRNA表达的影响
谈红,陈瑞敏,李晓燕,张红明,杨永耀,陈英剑
目的研究瑞舒伐他汀对急性冠脉综合征(ACS)患者外周血CD4+T淋巴细胞基因中微小RNA(miRNA)表达谱的影响,探讨瑞舒伐他汀钙治疗ACS的机制。方法选取2012年3-7月入住济南军区总医院的9例ACS患者,另以因疑似不典型冠心病症状而行320CT示冠脉病变≤50%的住院患者9例作为正常对照组。利用密度梯度法离心分离ACS患者及对照者的外周血单核细胞,免疫磁珠法进一步分离出CD4+T淋巴细胞。采用miRNA基因芯片技术检测CD4+T淋巴细胞m iRNA的表达谱,筛选ACS患者与正常对照组,以及ACS患者用药前后差异表达的m iRNA。选取其中差异性最为显著的3个miRNA,采用实时荧光定量聚合酶链反应(RT-PCR)对差异表达的m iRNA进行验证。结果通过基因芯片共检测基因1900余条,其中有差异的有300余条。与正常对照比较,ACS患者中显著上调的基因有126条,如miRNA-21、m iRNA-142、m iRNA-20a等,显著下调的基因有202条,如m iRNA-4734、m iRNA-1182、m iRNA1273f等。ACS患者服用瑞舒伐他汀钙(20mg,1次/d)10d后,与用药前相比,显著上调的基因有157条,如miRNA-4734、miRNA-1182、miRNA-663b等,显著下调的基因有137条,如m iRNA-4789、m iRNA-5692c、m iRNA-26a等。采用RT-PCR进一步验证,结果与m iRNA芯片检测结果一致。结论瑞舒伐他汀钙可能通过调节m iRNA-4734、m iRNA-1182、m iRNA-4789等m iRNA的表达从而发挥其对ACS的治疗作用。
微RNAs;急性冠脉综合征;瑞舒伐他汀;寡核苷酸序列分析
微小核糖核酸(m icroRNAs,m iRNAs)是一类在人类和动物中广泛存在的高度保守的内源性小分子非编码RNA,是由具有颈环结构的70~90个碱基的RNA前体经Dice酶加工后生成的18~24个碱基的单链小分子RNA[1]。自2006年van Rooij等[2]发现miRNA在心血管疾病中发挥着重要作用以来,m iRNA日益成为心血管领域的研究热点。近年来研究发现,m iRNA参与了动脉粥样硬化(atherosclerosis,AS)发生发展过程中炎性细胞的调控[3-4]。急性冠脉综合征(acute coronary syndrome,ACS)是AS斑块破裂、出血,产生纤维蛋白并激活凝血系统的过程。有研究表明炎症贯穿于这一过程的始末[5-6]。AS是ACS的病理基础,与脂质代谢障碍密切相关。CD4+CD 25+Foxp3调节性T细胞是一种新型的辅助性T细胞,Th17/Treg亚群失衡与ACS的发生密切相关[7]。斑块中T淋巴细胞的大量活化可降低斑块的稳定性,使其易于破裂。
瑞舒伐他汀可明显抑制ACS的炎症反应,抑制外周血单核来源的树突细胞(DCs)成熟,并影响T淋巴细胞的增殖及迁移能力,且可明显改善冠心病患者Th1/Th2细胞亚群的平衡[8]。有研究表明,miRNA参与了CD4+T淋巴细胞亚群的分化和活化过程[9-10]。本实验检测了瑞舒伐他汀对于ACS患者外周血CD4+T淋巴细胞中m iRNA表达谱的影响,旨在探讨瑞舒伐他汀钙对ACS发挥治疗作用的可能机制。
1 资料与方法
1.1 研究对象 选取2012年3-7月入住济南军区总医院心内科的ACS患者9例(ACS组),其中不稳定型心绞痛(UA)、非ST段抬高心肌梗死(NSTEM I)、ST段抬高心肌梗死(STEM I)各3例,男6例,女3例,年龄60.9±10.4岁,体重指数25.4±18.9kg/m2。入选标准:典型的缺血性胸痛等临床表现;典型的缺血性心电图改变(新发的完全性左束支传导阻滞,病理性Q波或一过性ST段、T波改变);如果心脏标记物cTnT/cTn I或CK-MB水平升高,可诊断为AM I,如果标记物没有超过正常范围诊断为UA。因疑似不典型冠心病症状而行320排CT示冠脉病变≤50%的9例住院患者作为正常对照组,其中男5例,女4例,年龄60.3±8.6岁,体重指数24.9±20.8kg/m2。排除标准:感染、全身免疫性疾病、严重的肝肾功能不全、内分泌系统疾病及自身免疫性疾病,既往有结核、肝炎、肿瘤等慢性病史。两组患者年龄、性别、体重指数差异均无统计学意义。入选前两组均签署知情同意书。ACS患者给予瑞舒伐他汀钙(可定,阿斯利康制药公司)20mg,1次/d,共10d,分别采集用药前后外周群脉血留样检查。
1.2 主要试剂及设备 改良的RPM I 1640培养基(美国Hyclone),人淋巴细胞分离液(北京索莱宝科技有限公司),胎牛血清(上海玉博生物科技有限公司),Deso、台酚蓝(青岛海泰生物技术有限公司),细胞计数板(南京裕安仪器有限公司),人CD4+免疫磁珠、MS分离柱、磁力架(德国美天旎公司),Trizol(美国Invitrogen),核酸蛋白测定仪(美国Bio-Rad),m iRNeasy试剂盒(北京华夏远洋科技有限公司),荧光显微镜(日本O lympus公司),杂交炉(美国Agilent);Gene Pix 4000B微阵列扫描仪(美谷分子仪器有限公司);分光光度计(ND 1000,美国Nanodrop);m iRCURYTM阵列功率标记试剂盒,ABI Sybr Green PCR Master M ix(北京萌壮科技有限公司),ABI Stepone Plus型荧光定量PCR仪(上海创萌生物科技有限公司)。
1.3 CD4+T淋巴细胞的分离与鉴定 在征得患者知情同意后,于住院次日晨采集新鲜外周静脉血12m l于肝素抗凝试管中。采用密度梯度离心法分离人外周血单个核细胞,以CD 4+免疫磁珠分选试剂盒进一步从单个核细胞中分离出CD4+T淋巴细胞。台盼蓝鉴定CD4+T淋巴细胞的活细胞数,然后加入冻存液于-80℃中冻存待用。ACS患者入院后给予瑞舒伐他汀钙20mg口服,1次/d,10d。10d后再次抽取患者外周血12m l,提取CD4+T淋巴细胞,同样于-80℃中冻存待用于基因筛选。
1.4 差异性表达m iRNAs的筛选 取收集的CD4+T淋巴细胞,采用Trizol一步法提取细胞总RNA,取40μg总RNA,用聚乙二醇(polyethylene glycol,PEG)法分离纯化m iRNA。用分光光度计测定RNA的浓度,甲醛变性凝胶电泳质检RNA的质量。采用m iRCURYTMArray Power标记试剂盒,用Hy3TM标记miRNA得到荧光探针,在标准条件下使用Phalanx的热收缩杂交袋将标记好的探针和m iRNA芯片杂交。使用GenePix4000B微阵列扫描仪扫描芯片的荧光强度,GenePix Pro 6.0图像分析软件对图像进行分析,把图像信号转化为数字信号,然后用SAM软件对数据进行处理,筛选出ACS患者与正常对照者CD4+T淋巴细胞差异表达的m iRNA。判断基因差异表达的标准:归一化强度的比值(fold chang)≥1.5时表示基因表达上调,≤0.67时表示基因表达下调。
1.5 瑞舒伐他汀钙干预后CD 4+T淋巴细胞差异表达m iRNA的RT-PCR验证结果 根据基因芯片筛选结果,选取其中表达差异最为显著的3个m iRNA(m iR4734、m iR1182、m iR4789)进行验证。选取2012年3-7月入住我科ACS患者48例(包括UA、NSTEM I、STEM I各16例),其中男28例,女20例,年龄74.0±7.91岁,分别抽取入院第2天及服用瑞舒伐他汀钙(20mg/d,共10d)后的空腹血,用免疫磁珠法分离CD 4+T淋巴细胞,分离后加入冻存液-80℃冻存,待病例收集完后一起行RT-PCR验证。采用Trizol一步法提取细胞RNA,用分光光度计测定RNA浓度,甲醛变性凝胶电泳质检RNA的质量。使用ABI SybrGreen PCR Master M ix试剂盒进行反转录,ABI Stepone Plus型荧光定量PCR仪进行PCR反应。m iRNA验证引物及内参照U 6引物由上海生工股份有限公司提供。U 6:正义5'-CTCGCTTCGGCAGCACA-3',反义5'-AACGCTTCACGAATTTGCGT-3';m iR-4734:正义5'-ACACTCCAGCTGGGGCTGCGGGCTGCG GTC-3',反义5'-TGGTGTCGTGGAGTCG-3';m iR-1182:正义5'-ACACTCCAGCTGGGGAGGGTCTTG GGAGGG-3',反义5'-TGGTGTCGTGGAGTCG-3';miR-4789:正义5'-ACACTCCAGCTGGGCACACATA GCAGGTGT-3',反义5'-TGGTGTCGTGGAGTCG-3'。扩增条件:95℃ 2m in;95℃ 10s,60℃ 40s,72℃30s,40个循环。然后进行熔解曲线分析。引物大小通过琼脂糖凝胶电泳进行验证。为确保所有试验数据的有效性,每次试验都常规设置阴性对照。
1.6 统计学处理 采用SPSS 13.0软件进行统计分析。计量数据以x±s表示,组间比较采用t检验;计数资料以率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 CD4+T淋巴细胞活细胞数及总RNA质量鉴定情况 经0.2%台盼蓝鉴定CD4+T淋巴细胞活细胞数为94.6%±2.4%。RNA质量检测显示符合m iRNA芯片实验要求。
2.2 基因芯片筛选结果 本实验通过m iRNA基因芯片检测1900余条基因信号,筛选结果显示,相对于正常对照者,ACS患者外周血中CD4+T淋巴细胞中差异性表达的基因有328条,其中显著上调的基因有126条,如m iRNA-21-5p、m iRNA-142-3p、miRNA-20a-5p等(表1),显著下调的基因有202条,如miRNA-4734、miRNA-1182、miRNA-1273f等(表2)。
2.3 瑞舒伐他汀钙干预后差异性表达的m iRNA瑞舒伐他汀钙药物干预10d后,与用药前比较差异性表达的基因共有294条,其中显著上调的基因157条,如m iRNA-4734、m iRNA-1182、m iRNA-663b等(表3),显著下调基因有137条,如m iRNA-4789-3p、m iRNA-5692c、miRNA-26a-5p等(表4)。
2.4 差异表达m iRNA的RT-PCR验证结果 RTPCR结果显示,与用药前相比,ACS患者使用瑞舒伐他汀钙(20mg/d,10d)后,hsa-m iR-4734、hsam iR-1182表达均显著上调,hsa-m iR-4789表达显著下调,差异均有统计学意义(P<0.05),与基因表达谱芯片检测结果一致(图1)。
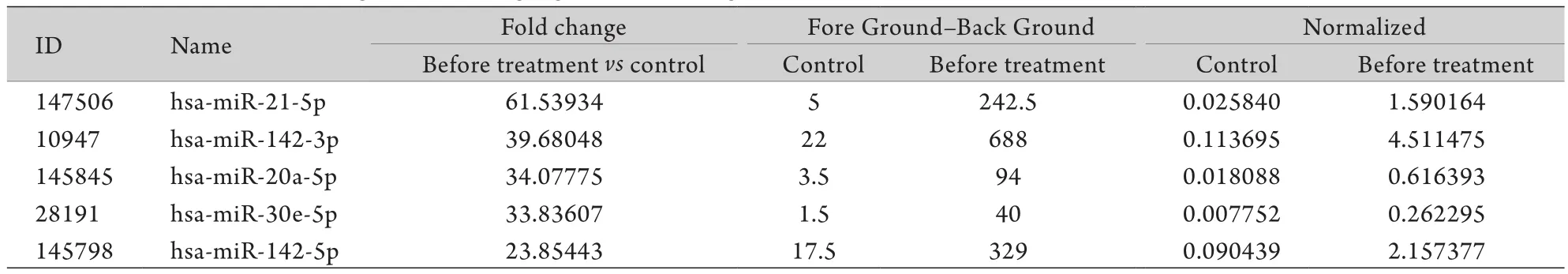
表1 与对照组比较ACS患者显著上调的前5位基因Tab.1 Top 5 genes show ing significant up-regulation in ACS patients compared w ith normal controls
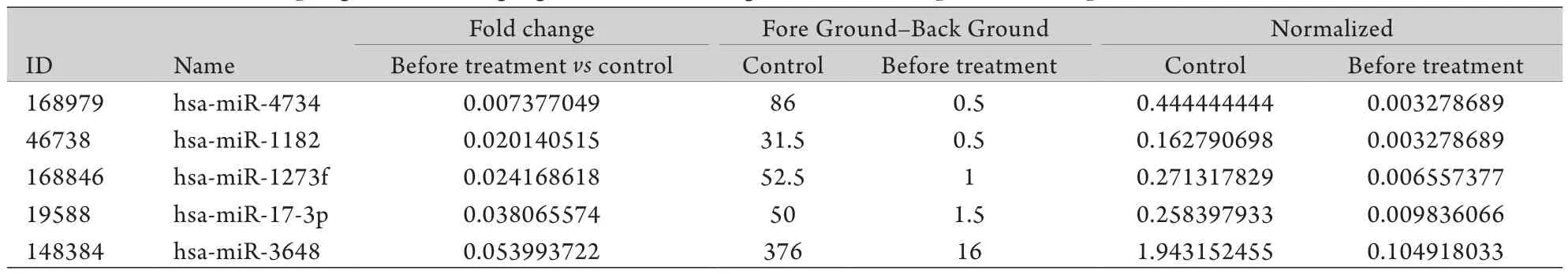
表2 与对照组比较ACS患者显著下调的前5位基因Tab.2 Top 5 genes showing significant down-regulation in ACS patients compared with normal controls
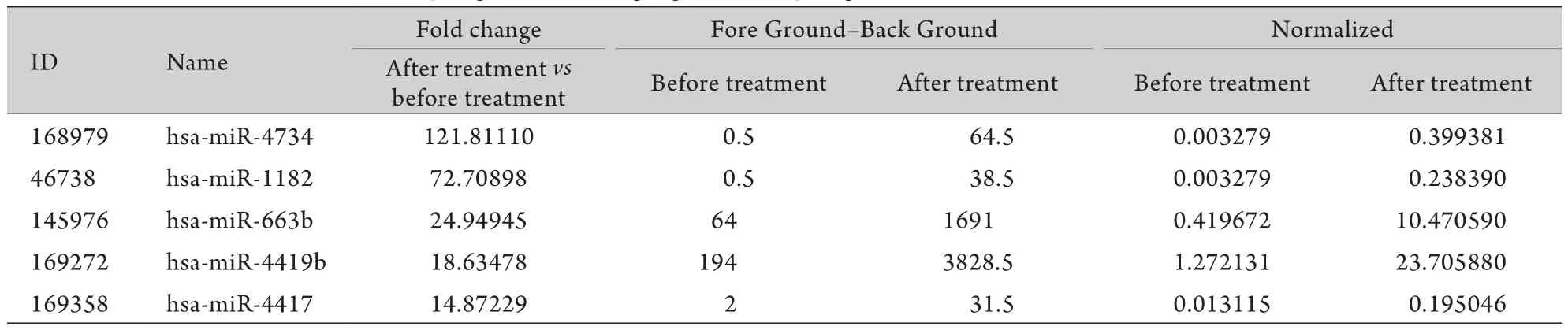
表3 瑞舒伐他汀钙药物干预后表达显著上调的前5位基因Tab.3 Top 5 genes showing significant up-regulation after rosuvastatin treatment
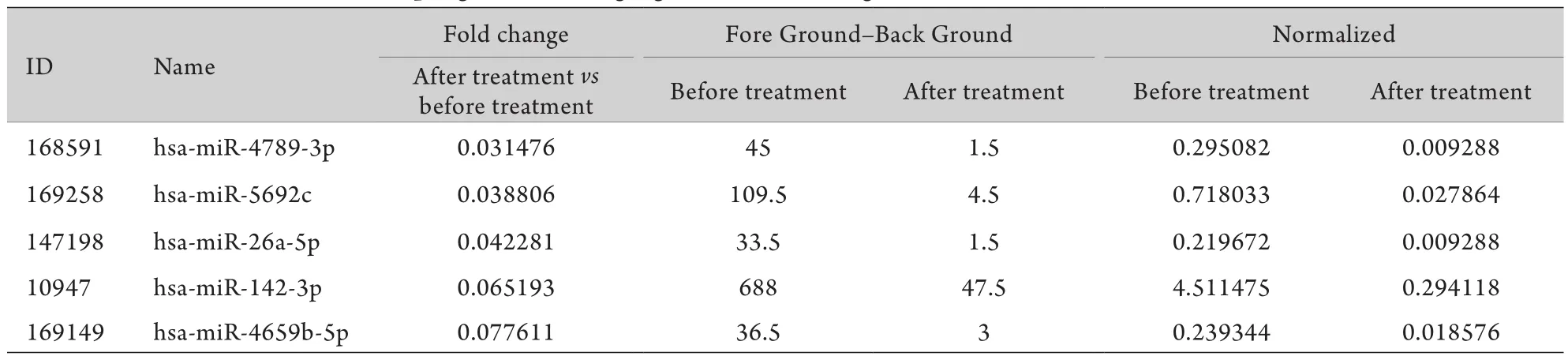
表4 瑞舒伐他汀钙药物干预后表达显著下调的前5位基因Tab.4 Top 5 genes show ing significant down-regulation after rosuvastatin treatment
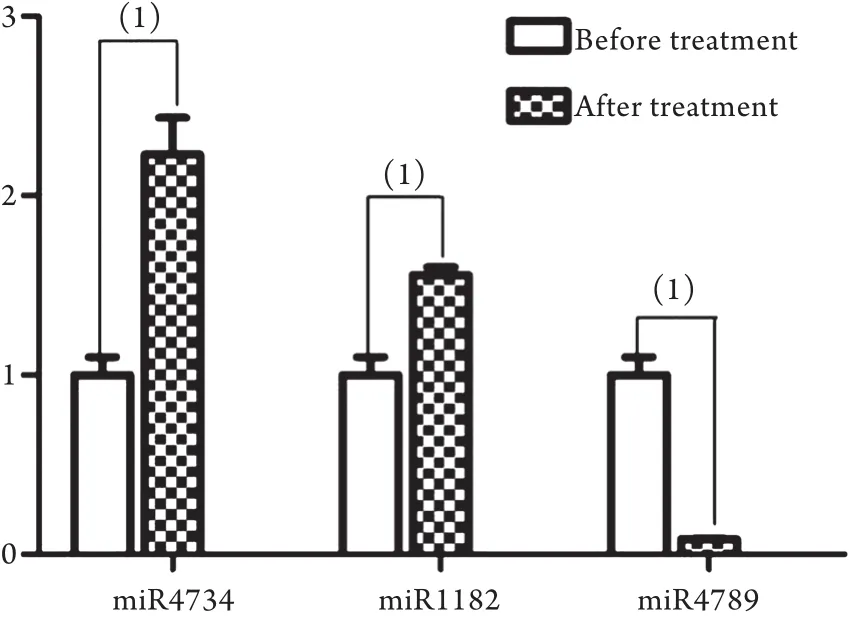
图1 瑞舒伐他汀钙用药前后差异表达m iRNA的实时定量PCR验证Fig.1 Differential expression of m iRNA detected by real-time quantitative PCR(1)P<0.05 compared with before treatment
3 讨 论
瑞舒伐他汀是一种新型3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,2002年在荷兰上市,被认为是目前作用最强的他汀类降脂药。对于ACS患者,欧洲血脂指南强调应进行强化降脂,即无论低密度脂蛋白胆固醇(LDL-C)水平如何,都应该将血脂降低到700mg/L以下,或在原来基础上降低50%。因为只有高强度他汀降脂才能阻断粥样斑块进展。有研究发现,长期大剂量服用瑞舒伐他汀在稳定粥样斑块的同时,还可以起到逆转斑块的作用[11-12]。对瑞舒伐他汀类药物的研究发现,对于ACS患者,短期大剂量给药并不能明显降低LDL-C,但可以显著降低IL-6、高敏C-反应蛋白、基质金属蛋白酶9(MMP-9)等炎性因子,减少体内凝集素诱导的白细胞翻转、黏附及迁移,而血管内皮细胞合成、分泌一氧化氮明显增加[13-14]。血管性血友病因子(VWF)是反映急性内皮损伤的特异性炎性因子,其血浆水平是ACS的独立预后因素。研究表明,短期应用大剂量瑞舒伐他汀可使血浆VWF水平明显降低[15]。Link等[16]研究发现瑞舒伐他汀治疗能够显著降低促炎细胞因子TNF-α和IFN-γ的血浆浓度,同时可使活化T淋巴细胞中TNF-α和IFN-γ的生成显著降低,从而起到稳定斑块的作用。近年来,瑞舒伐他汀独立于调脂作用外的抗炎作用越来越受到重视[17]。
m iRNA在心血管方面起着重要的作用,从最初的心脏发育到最终的心肌细胞凋亡坏死都有相对特异的m iRNA的参与[18]。m iRNA在外周循环血中稳定表达,使其可能作为冠心病潜在的生物学标志物[19]。研究发现,miRNA-125a-5p可调节单核/巨噬细胞摄取脂质并且减少IL-2、IL-6、TNF-α和TGF-β等炎性因子的分泌[3]。M inam i等[20]报道阿托伐他汀治疗可通过降低m iRNA-221/m iRNA-222水平从而增加冠心病患者内皮袓细胞(EPCs)的数量,而普伐他汀效果甚微,提示m iRNA可能是部分他汀类降脂药的作用靶点。本实验通过比较ACS患者与正常对照组,以及ACS患者用药前后外周血CD4+T淋巴细胞中m iRNA的变化情况,了解其变化规律,进一步阐明瑞舒伐他汀在ACS中的作用机制,并发现一种或几种高度差异表达的m iRNA,以方便应用于以后的临床研究。经基因芯片技术筛选后我们得出的许多m iRNA同文献报道一致[20-23],但仍有个别m iRNA存在差异,可能与病例收集人群(本文病例选取范围更广泛,包含UA、NSTEM I、STEM I患者,而相关文献中只针对UA患者)、采样时间、样本处理、样本量大小等有一定关系。目前鲜有调脂药对ACS患者m iRNA表达影响的研究,本文通过m iRNA基因芯片技术检测短期给予大剂量瑞舒伐他汀钙后ACS患者CD 4+T淋巴细胞中m iRNA的差异表达情况,结果显示m iRNA-4734、m iRNA-1182、m iRNA-663b、m iRNA-4419b、m iRNA-4417等表达显著上调,m iRNA-4789-3p、m iRNA-5692c、m iRNA-26a-5p、m iRNA-142-3p、m iRNA-4659b-5p等表达显著下调,而通过该基因芯片检测ACS患者与正常对照组的miRNA表达差异发现,ACS患者m iRNA-4734、m iRNA-1182的表达与正常对照比较显著下调,但药物干预后却急剧升高。虽然m iRNA-4789-3p的表达水平在ACS患者与正常对照中无明显差异,但在ACS患者中用药后显著下降,变化幅度较大。因此我们推测,m iRNA-4734、m iRNA-1182、m iRNA-4789-3p在ACS中可能具有重要作用,大剂量短期应用瑞舒伐他汀可能通过调节m iRNA-4734、m iRNA-1182、m iRNA-4789-3p等m iRNA的表达来改善ACS患者的预后。
综上所述,短期大剂量应用瑞舒伐他汀钙可能通过调节ACS患者m iRNAs的表达而引起外周血CD4+T淋巴细胞亚群的变化,进而起到改善患者预后的作用,该结果从分子机制上进一步阐述了瑞舒伐他汀钙在ACS治疗中的作用,但其具体的信号通路及作用机制仍需进一步研究探讨。
[1] Bartel DP.M icroRNAs: genom ics, biogenesis, mechaism, and function[J].Cell, 2004, 116(2): 281-297.
[2] van Rooij E, Sutherland LB, Liu N, et al.A signature pattern of stress-responsive microRNAs that can evoke cardiac hypertrophy and heart failure[J].Natl Acad Sci USA, 2006, 103(48): 18255-18260.
[3] Chen T, Huang Z, Wang L, et al.M icroRNA-125a-5p partly regulates the inflammatory response, lipid uptake and ORP9 expression in oxLDL-stimulated monocyte/macrophages[J].Cardiovase Res, 2009, 83(1): 131-139.
[4] Fleissner F, Jazbutyte V, Fied ler J, et al.Short communication: asymmetric dimethylarginine impairs angiogenic progenitor cell function in patients with coronary artery disease through a m icroRNA-21-dependent mechanism[J].Circ Res, 2010, 107(1): 138-143.
[5] Bona RD, Liuzzo G, Pedicino D, et al.Anti-inflammatory treatment of acute coronary syndromes[J].Curr Pharm Des, 2011, 17(37): 4172-4189.
[6] Sun X, Tong H, Zhang M, et al.The com parative study of Rosuvastatin and Simvastatin on carotid intima-media thickness in patients w ith coronary heart disease[J].Chin J Pract Inter Med, 2012, 32(6): 452-454.[孙晓, 佟浩, 张曼, 等.瑞舒伐他汀和辛伐他汀对急性冠脉综合征颈动脉内中膜厚度影响对比研究[J].中国实用内科杂志, 2012, 32(6): 452-454.]
[7] Cheng X, Yu X, Ding YJ, et al.The Th17/Treg imbalance in patients with acute coronary syndrome[J].Clin Immunol, 2008, 127(1): 89-97.
[8] Li XY, Zhang HL, Han SF, et al.Changes of Th1/Th2 cell ratio in the peripheral blood of patients with both coronary heart disease and diabetes[J].Chin J Clin (Electron Ed), 2011, 5(17): 4976-4979.[李晓燕, 张华丽, 韩淑芳, 等.冠心病合并糖尿病患者外周血Th1/Th2细胞水平的研究[J].中华临床医师(电子版), 2011, 5(17): 4976-4979.]
[9] Guo M, Mao X, Ji Q, et al.Inhibition of IFN regulatory factor-1 down-regulate Th1 cell function in patients with acute coronary syndrome[J].J Clin Immunol, 2010, 30(2): 241-252.
[10] Muljo SA, Ansel KM, Kanellopoulou C, et al.Aberrant T Cell differentiation in the absence of Dicer[J].J Exp Med, 2005, 202(2): 261-269.
[11] Hirayama A, Saito S, Ueda Y, et al.Qualitative and quantitative changes in co ronary p laque associated w ith ato rvastatin therapy[J].Circ J, 2009, 73(4): 718-725.
[12] Guo SP, Zhang X, Gao CY.Effect of large dose rosuvastatin on hs-CRP, MMP-9 and cardiac function in patients w ith acute myocardial infarction[J].J Zhengzhou Univ (Med Sci), 2013, 48(6): 836-838.[郭素萍, 张霞, 高传玉.大剂量瑞舒伐他汀对急性心肌梗死患者血清高敏C反应蛋白、MMP-9及心功能的影响[J].郑州大学学报(医学版), 2013, 48(6): 836-838.]
[13] Li B, Liu WW, Wo JS.Influence o f rosuvastain on serum Ang2 and in flammatory factors in patients w ith m d tabolic syndrome[J].Chin Gen Pract, 2012, 7(15): 2402-2404.[李波,刘薇微, 沃金善.瑞舒伐他汀对代谢综合征患者血清血管生成素2和炎症因子水平的影响[J].中国全科医学杂志, 2012, 7(15): 2402-2404.]
[14] Liao ZJ, Lin ZP.Study on changes in serum MMP-9 levels o f rosuvastain treatm ent in patients w ith acute co ronary syndrome[J].Chin J Med Guide, 2012, 2(14): 257-257.[廖志坚, 林泽鹏.瑞舒伐他汀短期治疗急性冠脉综合征患者血清MMP-9水平变化的研究[J].中国医药导刊, 2012, 2(14): 257-257.]
[15] Yang CB, Li L.The clinical research of the correlation between VWF and ACS and the therapeutical effect of different doses of resuvastain[D].Zhengzhou: Zhengzhou University, 2010.[杨长宝, 李莉.VWF与ACS的相关性及不同剂量瑞舒伐他汀治疗作用的临床研究[D].郑州: 郑州大学, 2010.]
[16] Link A, Ayadhi T, Böhm M, et al.Rapid immunomodulation by rosuvastatin in patients with acute coronary syndrome[J].Eur Heart J, 2006, 27(24): 2945-2955.
[17] Li JJ.Lipid regulating effect and its mechanism of non statins[J].Chin Circ J, 2011, 26(4): 313-314.[李建军.他汀类药物非调脂作用及其机制[J].中国循环杂志, 2011, 26(4): 313-314.]
[18] Wu G, Huang ZP, Wang DZ.M icroRNAs in cardiac regeneration and cardiovascular disease[J].Sci Chin Life Sci, 2013, 56(10): 907-913.
[19] M itchell PS, Parkin RK, Kroh EM, et al.Circulating m icroRNAsas stable blood-based markers of cancer detection[J].Proc Natl Acad Sci USA, 2008, 105(30): 10513-10518.
[20] M inam i Y, Satoh M, Maesawa C, et al.Effect of atorvastatin on m icroRNA 221/222 expression in endothelial progenitor cells obtained from patients with coronary artery disease[J].Eur J Clin Invest, 2009, 39(5): 359-367.
[21] Zhang Y, Zhao YX, Guo HY, et al.Prelim inary study o f circu lation m icroRNA exp ression p ro files in patients w ith auricular fibrillation[J].Med J Chin PLA, 2012, 37(3): 195-199.[张瑜, 赵月香, 郭红阳, 等.心房颤动患者循环m iRNA表达谱的初步研究[J].解放军医学杂志, 2012, 37(3): 195-199.]
[22] He YJ, Guo L, Ding ZH, et al.Advances in microRNAs molecular m iR-24[J].Med J Chin PLA, 2009, 34(9): 1145-1147.[何英杰,郭玲, 丁振华, 等.m iRNA分子m iR-24的研究进展[J].解放军医学杂志, 2009, 34(9): 1145-1147.]
[23] Cheng Y, Zhang C.M icroRNA-21 in cardiovascular disease[J].J Cardiovasc Transl Res, 2010, 3(3): 251-255.
Differences of CD4+ T lymphocyte miRNA gene expression in acute coronary artery syndrome(ACS) patients and the effects of rosuvastatin on its expressions
TAN Hong1, CHEN Rui-min1, LI Xiao-yan1*, ZHANG Hong-m ing1, YANG Yong-yao2, CHEN Ying-jian31Department of Cardiology,3Department of Clinical Laboratory, General Hospital of Jinan Command, Jinan 250031, China
2Department of Cardiology, People’s Hospital of Guizhou Province, Guiyang 550002, China
*
, E-mail: lixiaoyan902006@126.com
ObjectiveTo investigate the effects of rosuvastatin on the expression profile of peripheral blood CD4+T lymphocytes m iRNA gene in the patients w ith acute coronary syndrome (ACS) and screen the differentially expressed m iRNAs before and after treatment, and elucidate the mechanisms of rosuvastatin calcium in the treatment of patients with ACS.MethodsNine cases were selected from the patients w ith ACS treated in the General Hospital of Jinan M ilitary Command from Mar.to Jul.of 2012, w ith other 9 cases selected as controls, whose degree of coronary artery stenosis was less than 50% as confirmed by 320CT.Peripheral blood mononuclear cells were isolated by density gradient centrifugation, and CD4+T lymphocytes were isolated by immunomagnetic beads method.m iRNAs of CD4+T lymphocytes were detected by m iRNA gene chip technology.The differentially expressed m iRNAs between ACS patients and normal control, and those in ACS patients before and after treatment were screened.Three of the maximum difference miRNAs were selected and followed by verification by real-time polymerase chain reaction (RT-PCR).ResultsMore than 1900 genes were detected by gene m icroarray, of which more than 300 genes showed significant differences in expression.Comparing the ACS patients and normal controls, 126 genes were significantly up-regulated, including miRNA-21, miRNA-142, and m iRNA-20a; and 202 genes were significantly down-regulated, including miRNA-4734, miRNA-1182, and m iRNA-1273f.A total of 157 genes were significantly up-regulated after treatment w ith rosuvastatin calcium (20mg/d×10d),such as m iRNA-4734, miRNA-1182, and m iRNA-663b; and 137 genes were significantly down-regulated, such as miRNA-4789, m iRNA-5692c, and m iRNA-26a.The results were validated by RT-PCR and they were same as m iRNA m icroarray.ConclusionRosuvastain may play a role in the treatment of patients with ACS by regulating a series of m iRNAs such as miRNA-4734, miRNA-1182, and miRNA-4789.
m icroRNAs; acute coronary syndrome; rosuvastatin; oligonucleotide array sequence analysis
R541.4
0577-7402(2014)02-0099-06
10.11855/j.issn.0577-7402.2014.02.04
2013-08-07;
2013-12-02)
(责任编辑:张小利)
This work was supported by the Scientific and Technological Project of Guizhou Province [SY20103081]
贵州省科技攻关项目[SY(20103081)]
谈红,医学博士,主任医师。主要从事冠状动脉粥样硬化相关的基础及临床研究
250031 济南 济南军区总医院心内科(谈红、陈瑞敏、李晓燕、张红明),检验科(陈英剑);550002 贵阳 贵州省人民医院心内科(杨永耀)
李晓燕,E-mail:lixiaoyan902006@126.com
