不同培养基对骨髓间充质干细胞免疫学特性的影响
2014-07-25傅歆肖苒
傅歆 肖苒
间充质干细胞(Mesenchymal stem cells,MSC)来源于胚胎发育期的中胚层,广泛分布于胎儿和成体的多种组织中(如骨髓、脂肪组织、骨骼肌和脐带血等),是一类具有自我更新和多向分化潜能的非造血成体干细胞[1-3]。MSC特殊的低免疫原性和免疫调节功能,使其在自身免疫性疾病和细胞治疗等方面具有广阔的临床应用前景[4-5]。骨髓来源的间充质干细胞(Bone marrow mesenchymal stem cells,BMSC)是如今研究最为广泛的一类MSC[6]。在体外培养过程中,商品化的干细胞培养基可显著提高BMSC的增殖效率。但是,不同培养基中的成分及添加的生长因子对BMSC免疫学特性的影响尚不明确。本实验比较了BMSC在ScienCell(SCI)干细胞培养基和低糖(Low-glucose,LG)DMEM完全培养基培养条件下的免疫学特性。
1 材料与方法
1.1 主要试剂和细胞
低糖DMEM、PBS和双抗(HyClone公司);MSC干细胞培养基(ScienCell公司,货号:7501);细胞培养相关试剂(Gibco公司);如无特殊说明,化学药品(Sigma公司);一抗HLA-A,B,C-APC、HLA-DRAPC、CD40-PE、CD80-APC、CD86-FITC、B7-H1-APC、B7-H2-PE、B7-H3-PE、B7-H4-PE及B7-DC-APC(Biolegend公司);StemflowTM人MSC分析试剂盒(BD公司);CellTiter 96RAQueous单溶液细胞增殖检测(MTS)试剂盒(Promega公司)。
1.2 BMSC的分离纯化和体外培养
BMSC来源于齿槽嵴裂患者髂骨骨髓(获患者知情同意)。采用密度梯度离心法分离BMSC,加含10%胎牛血清(Fetal bovine serum,FBS)和1%双抗的LG DMEM完全培养基,悬浮后转移到T25培养皿中,置于37℃、5%CO2孵箱中培养。接种7~10 d后,待形成较大克隆时,0.25%胰蛋白酶消化,1∶2比例传代。待第3代细胞铺满培养皿80%~90%时,用胰蛋白酶消化BMSC,以1∶2比例分别培养于SCI干细胞培养基或LG DMEM完全培养基,至细胞即将汇合时,消化细胞,收集第4代细胞进行相关检测。
1.3 流式细胞鉴定BMSCs表面标志物
取第2代BMSC,按StemflowTM试剂盒说明书标记表面标志物。样本用FACSAriaTMⅡ流式细胞仪检测蛋白表达。
1.4 BMSC的定向诱导和鉴定
[7]的方法,进行BMSC成骨和成脂诱导及鉴定。
1.5 单向(One-way)混合淋巴细胞反应(Mix Lymphocyte Reactions,MLR)
为了检测BMSC的免疫原性,抽取两名健康志愿者(知情同意)静脉血,采用密度梯度离心法分离外周血单个核细胞(Peripheral blood mononuclear cells,PBMC)[8]。其中部分PBMC用25 μg/mL丝裂霉素C 37℃灭活处理20 min后作为刺激细胞(PBMC stimulator,PBMCs),另一部分未经灭活处理的PBMC作为反应细胞(PBMC responder,PBMCr)。取第4代SCI组和LG组的BMSC,经上述方法灭活处理后,分别以1×105个/孔的密度接种于96孔板中,隔天每孔加入1×105PBMCr并在200 μL淋巴细胞培养液(含RPMI 1640,10%血清和1%双抗)中共培养,将分别来自两个不同供体的PBMCr和PBMCs混合培养作为阳性对照组,每组均取3个复孔。共培养5 d后,每孔加入40 μL MTS孵育3~4 h后,酶联免疫检测仪测定490 nm波长处吸光度值(Absorbance,Ab)。单向混合淋巴细胞增殖率(Proliferation index,PI)计算公式如下,PI≥1表示具有免疫原性。
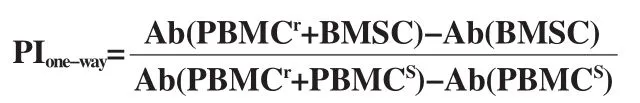
1.6 双向(Two-way)MLR
为检测BMSC的免疫抑制能力,取第3代SCI组和LG组的BMSC,按上述方法将灭活的BMSC分别以1×103个/孔和1×104个/孔的密度接种于96孔板中,隔天每孔再加入两个不同人来源的PBMCr(分别称为PB1和PB2),细胞均为1×105个/孔,共培养5 d。只含有PB1和PB2混合共培养的孔作为对照组,只含有淋巴细胞培养基的孔(Medium)作为背景组,每组均取3个复孔,同法加入MTS。双向混合淋巴细胞增殖率计算公式如下。
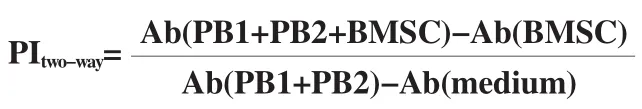
1.7 伽马干扰素(Interferon-γ,IFN-γ)刺激
IFN-γ用PBS重悬后,按0、10、1 000 U/mL梯度浓度加入第4代SCI组和LG组的BMSC细胞培养液中,培养72 h后,收集细胞检测免疫分子的表达。
1.8 统计学分析
应用SPSS 16.0软件进行统计学分析,数据以均数±标准差表示,采用独立样本t检验,P0.05为差异有统计学意义。
2 结果
2.1 BMSC培养及其生物学特性鉴定
第2代BMSCs呈梭形平铺生长(图1A),表达CD90、CD73、CD105(90%);低表达造血干细胞标志物CD34、CD116、CD19、CD45和HLA-DR(Neg Cocktail,0.5%)(图1B),BMSCs成骨诱导21 d后茜素红染色可见深红色钙化结节(图1C);成脂诱导14 d后油红O染色可见橘红色脂滴(图1D)。
2.2 SCI组和LG组BMSC的免疫学特性比较
One-way MLR结果显示,共培养5 d后,与SCI组和LG组BMSCs共培养的PBMCr的PI值均显著低于与异体来源PBMCs共培养后的PI值(P0.05,图2A),提示两组BMSC均未对PBMC产生促增殖作用。其中,PBMCr与SCI组BMSCs共培养后的PI值显著高于与LG组BMSCs共培养后的PI值(P0.05,图2A)。
Two-way MLR结果显示,共培养5 d后,PBMCs的增殖受到明显抑制,且抑制效应随细胞数量增加而升高。两组BMSCs对异体PBMC刺激导致的PBMC增殖的抑制能力未见显著差别(图2B)。
2.3 BMSCs的免疫分子表达
SCI组和LG组BMSCs均高表达主要组织相容性复合物Ⅰ类(Major histocompatibility complex classⅠ,MHC-Ⅰ)分子HLA-A、B、C(99.0%和81.6%),但MHC-Ⅱ类分子HLA-DR在SCI组BMSCs中的表达水平(4.84%)显著低于LG组(34.4%)(P0.05,图3A、B、G)。SCI组和LG组BMSCs均不表达免疫共刺激分子CD80、CD86和B7-H2(0.5%),但部分表达CD40,且CD40在SCI组的表达水平显著高于在LG组(17.7%vs 9.87%,P0.05,图3C、D、G)。SCI组和LG组BMSCs均高表达免疫共抑制因子B7-H3(99%),极低表达B7-H4(0.5%),部分表达B7-H1和B7-DC,且后两者在SCI组的表达显著低于LG组(3.85%/5.32%vs 40.2%/67.9%,P0.05,图3E-G)。
2.4 IFN-γ刺激后BMSCs免疫分子的表达
为了检测炎症因子刺激下两组BMSCs免疫分子表达的变化,我们采用不同浓度的IFN-γ(10 U/mL和1 000 U/mL)刺激BMSCs,并检测其表面免疫分子的表达水平。结果显示,IFN-γ(10 U/mL和1 000 U/mL)可显著上调SCI组BMSCs中HLA-A、B、C阳性表达细胞比例及两组BMSCs中HLA-DR阳性表达细胞比例(90%)。低浓度的IFN-γ(10 U/mL)可少量上调LG组BMSCs的CD40表达水平。高浓度IFN-γ(1 000 U/mL)可显著提高两组BMSCs中CD40和B7-H1阳性表达细胞比例,以及SCI组BMSCs中B7-DC阳性表达细胞比例(图4)。
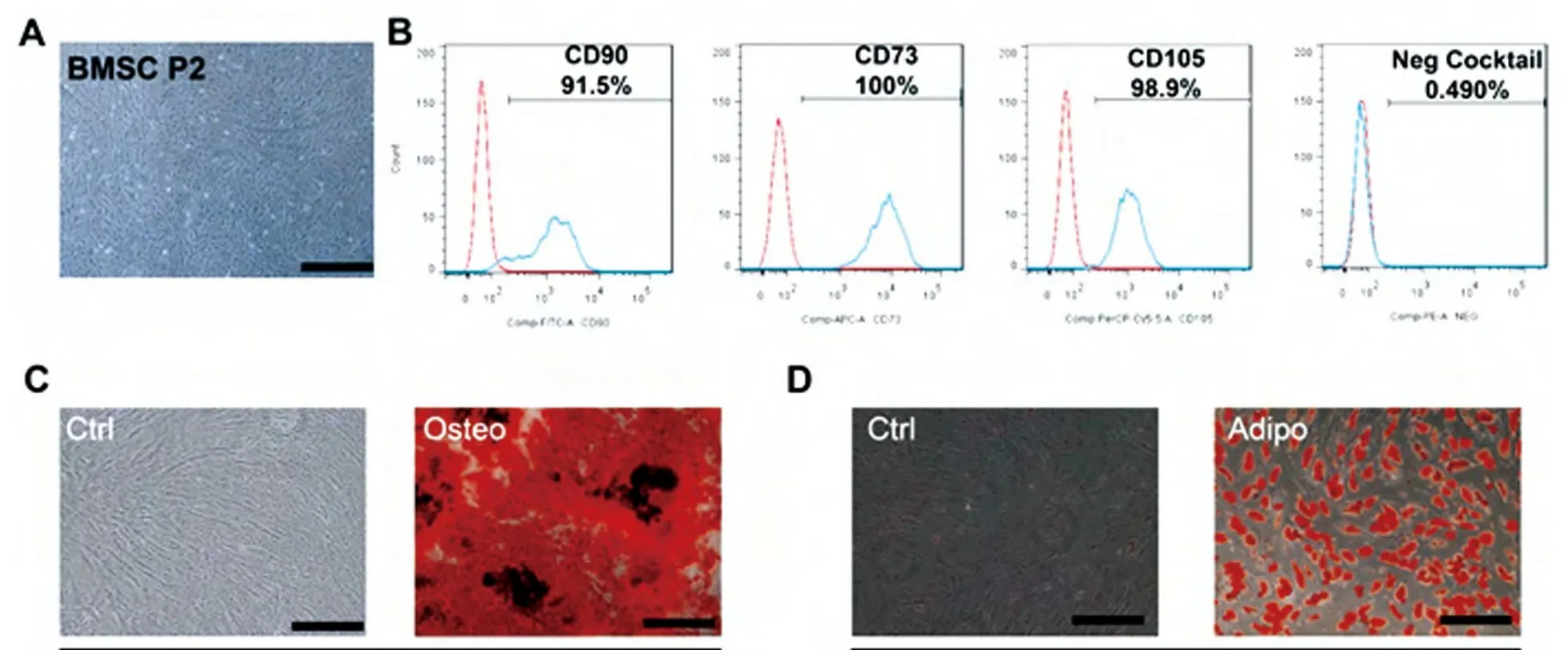
图1 BMSC的生物学特性检测Fig.1Characterizations of BMSC

图2 混合淋巴细胞反应检测BMSCs免疫原性Fig.2Immunogenicity testing of BMSCs by mix lymphocyte reaction
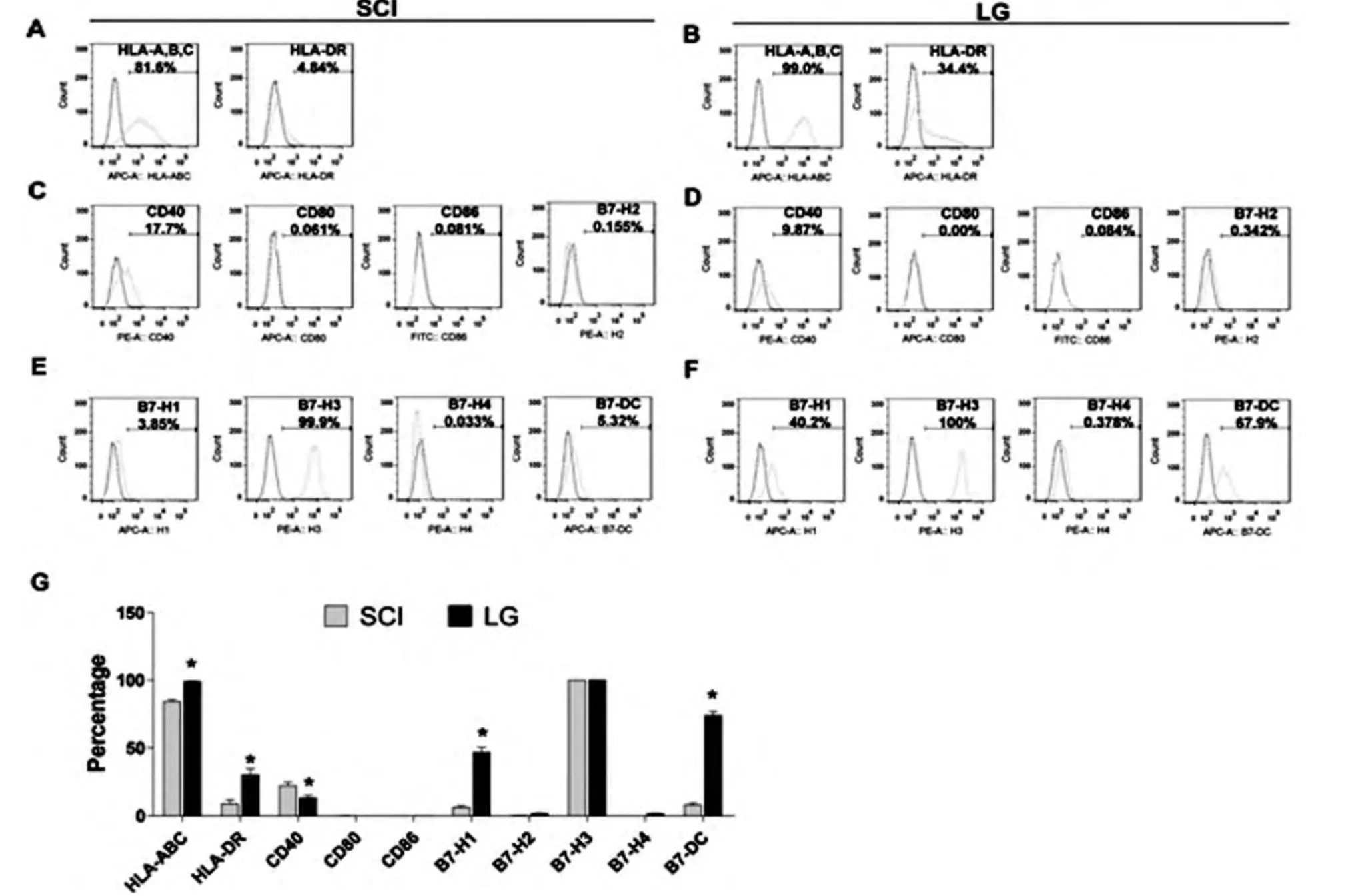
图3 免疫相关分子在BMSC中的表达Fig.3Expressions of immune molecules on BMSC

图4 IFN-γ刺激后BMSCs中免疫分子的表达Fig.4Expression of immune molecules on BMSCs after IFN-γ stimulation
3 讨论
BMSC具有获取方便、增殖能力强以及多向分化潜能等优点,是近年来再生医学和组织工程极具研究及利用价值的种子细胞。不仅如此,BMSC的低免疫原性和免疫调节功能,使其在抑制免疫排斥和治疗自身免疫性疾病方面同样具有广阔的应用前景。但BMSC仅占骨髓中单个核细胞的0.001%~0.01%,难以满足科研和临床应用的需要,所以需要在体外进行分离纯化并培养扩增[9]。常规的BMSC培养基是添加了10%FBS的低糖DMEM,可保证BMSC未分化增殖[10]。但是,由于血清中含有许多未确定成分和各种生长因子,且不同批次血清成分不稳定、生长因子浓度不确定,不利于将来BMSC临床应用的标准化[11],而且常规培养基培养的BMSC在体外易出现老化及增殖能力的下降。商品化的ScienCell干细胞培养基降低了FBS的浓度,含有确定浓度的FGF-2、EGF、BSA、转铁蛋白、胰岛素和氢化可的松等,可显著提高BMSC的扩增效率[12],并能在一定程度上规范BMSC的培养条件,提高实验的可重复性[13]。
但是,培养基中各种添加成分是否改变BMSC的免疫学特性,目前并不明确。本研究比较了BMSC在ScienCell干细胞培养基和低糖DMEM完全培养基培养下的免疫学特性。发现ScienCell干细胞培养基可改变BMSC表面免疫分子的表达,BMSC在SCI培养基中的免疫原性高于在LG完全培养基中,但免疫抑制能力未见明显差别。
HLA-DR是人的MHC-Ⅱ类分子,可形成细胞膜上MHC-Ⅱ分子的功能片段,同抗原肽有关。多数研究认为,BMSC几乎不表达MHC-Ⅱ类分子。但是最新的研究发现,BMSCs也表达HLA-DR,其表达水平受个体差异及细胞微环境的影响[14]。本实验中,在LG培养基培养下,BMSC中HLA-DR有一定表达,而SCI干细胞培养基条件可降低BMSC的HLA-DR表达。有研究发现,BMSCs向成脂方向的分化伴随着HLA-DR表达水平的降低[15],SCI干细胞培养基中添加的胰岛素、氢化可的松和转铁蛋白均能够诱导脂肪前体细胞发生成脂分化[16]。因此,SCI组BMSC中HLA-DR水平的降低可能与SCI干细胞培养基潜在的促成脂分化功能有关。
BMSCs中MHC-Ⅱ类分子的表达水平对其免疫学特性的影响仍存在争论。有研究发现,IFN-γ刺激后,BMSC中HLA-DR表达水平上调,会刺激T细胞发生增殖,提高其免疫原性[17]。但也有报道指出,BMSC中HLA-DR水平的升高并不会提高其免疫原性[18]。已知免疫活性细胞活化需要双信号刺激。第一信号是抗原提呈细胞(Antigen presenting cells,APC)表面抗原肽-MHC分子复合物与淋巴细胞表面抗原识别受体结合;第二信号即协同刺激信号,是APC表面协同刺激分子与淋巴细胞表面协同刺激分子受体结合。因此,MSC的低免疫原性还与其低表达多种免疫共刺激分子(如CD40、CD80和CD86等)有关[19]。CD40是CD40L的受体,属于肿瘤坏死因子受体(Tumor necrosis factor receptor)超家族的成员[20]。CD40的配体CD40L主要表达于活化的T细胞表面。CD40与CD40L结合可促进活化T细胞的进一步增殖[21]。本研究中,LG组BMSC中HLADR的表达水平高于SCI组,但其免疫共刺激分子CD40的表达水平低于SCI组,这可能是LG组BMSC免疫原性较SCI组低的原因之一。
此外,SCI组BMSC中表达免疫共抑制因子B7-H1和B7-DC的细胞比例也显著低于LG组。B7-H1和B7-DC与其他5个已知的成员:CD80(B7.1)、CD86(B7.2)、B7-H2、B7-H3和B7-H4均属于B7家族,他们通过与淋巴细胞上对应的受体结合,传达“共刺激”或“共抑制”的信号对免疫反应起调节作用[22]。B7-H1和B7-DC的受体为CD279(也称为PD-1),在T细胞和B细胞上均有表达。B7-H1或B7-DC与淋巴细胞上的PD-1结合后对淋巴细胞的增殖发挥负性的调控功能,抑制T细胞和B细胞的功能[23-25]。因此,BMSC在SCI培养基中免疫原性的上调可能与免疫共抑制因子B7-H1和B7-DC的表达下调也有关。
IFN-γ是免疫反应中主要由活化的天然杀伤细胞和T细胞分泌的一种促炎因子,是MHC分子最主要的诱导物,可通过诱导多种细胞表达MHC-Ⅰ和MHC-Ⅱ类分子,从而增强免疫应答[26]。研究证实,在体外培养过程中,炎症因子IFN-γ的刺激会造成人BMSCs中HLA-DR表达水平的上调[27],与本实验结果一致。此外,我们发现,低浓度IFN-γ仅少许上调LG组BMSC中CD40的表达水平,其他分子在两组均保持稳定不变;但是,高浓度IFN-γ刺激后,两组BMSCs的免疫分子表达均上调且并无显著差异,提示在体内高浓度炎症因子微环境中,两组培养基培养下的BMSC的免疫学特性可能会趋于一致。
综上所述,我们认为培养基中添加的生长因子和其他成分会改变BMSC表面免疫分子的表达情况,导致其免疫原性的改变。因此,BMSC的临床应用需要评估所使用培养基对BMSC免疫学特性的影响,保证其临床应用的安全性和有效性。
参考文献
[1]Nombela-Arrieta C,Ritz J,Silberstein LE.The elusive nature and function of mesenchymal stem cells[J].Nat Rev Mol Cell Biol,2011,12(2):126-131.
[2]Lennon DP,Caplan AI.Isolation of human marrow-derived mesenchymal stem cells[J].Exp Hematol,2006,34(11):1604-1605.
[3]In't Anker PS,Scherjon SA,Kleijburg-van der Keur C,et al.Isolation of mesenchymal stem cells of fetal or maternal origin from human placenta[J].Stem Cells,2004,22(7):1338-1345.
[4]Mauney JR,Volloch V,Kaplan DL.Role of adult mesenchymal stem cells in bone tissue engineering applications:current status and future prospects[J].Tissue Eng,2005,11(5-6):787-802.
[5]Bradley JA,Bolton EM,Pedersen RA.Stem cell medicine encounters the immune system[J].Nat Rev Immunol,2002,2(11):859-871.
[6]Batsali A,Pontikoglou C,Kouvidi E,et al.Comparative analysis of bone marrow and wharton’s jelly mesenchymal stem/stromal Cells[J].Blood,2013,122(21):1212.
[7]杨珣,李秋晨,吴欢欢,等.KLF2和KLF15基因在hBMSCs定向分化中的动态表达[J].基础医学与临床,2012,32(8):899-905.
[8]Liu H,Kemeny DM,Heng BC,et al.The immunogenicity and immunomodulatory function of osteogenic cells differentiated from mesenchymal stem cells[J].J Immunol,2006,176(5):2864-2871.
[9]Adesida AB,Mulet-Sierra A,Jomha NM.Hypoxia mediated isolation and expansion enhances the chondrogenic capacity of bone marrow mesenchymal stromal cells[J].Stem Cell Res Ther,2012,3(2):9
[10]Haynesworth SE,Goshima J,Goldberg VM,et al.Characterization of cells with osteogenic potential from human marrow[J].Bone,1992,13(1):81-88.
[11]Pittenger MF.Mesenchymal stem cells:methods and protocols[M].Totowa:Humana Press,2008.
[12]Gharibi B,Hughes FJ.Effects of medium supplements on proliferation,differentiation potential,and in vitro expansion of mesenchymal stem cells[J].Stem Cells Transl Med,2012,1(11):771-782.
[13]Gong Z,Calkins G,Cheng EC,et al.Influence of culture medium on smooth muscle cell differentiation from human bone marrowderived mesenchymal stem cells[J].Tissue Eng Part A,2009,15(2):319-330.
[14]Bocelli-Tyndall C,Zajac P,Di Maggio N.Fibroblast growth factor 2 and platelet-derived growth factor,but not platelet lysate,induceproliferation-dependent,functionalclassIImajor histocompatibility complex antigen in human mesenchymal stem cells[J].Arthritis Rheum,2010,62(12):3815-3825.
[15]Le Blanc K,Tammik C,Rosendahl K,et al.HLA expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells[J].Exp Hematol,2003,31(10):890-896.
[16]Weaver RE,Donnelly D,Wabitsch M,et al.Expression of glucosedependent insulinotropic polypeptide receptors is coupled to differentiation in a human adipocyte model[J].Int J Obes(Lond),2008,32(11):1705-1711.
[17]Chan WK,Lau AS,Li JC,et al.MHC expression kinetics and immunogenicity of mesenchymal stromal cells after short-term IFN-gamma challenge[J].Exp Hematol,2008,36(11):1545-1555.
[18]Hoch AI,Leach JK.Concise review:optimizing expansion of bone marrow mesenchymal stem/stromal cells for clinical applications[J].Stem Cells Transl Med,2014,3(5):643-652.
[19]Ryan JM,Barry FP,Murphy JM,et al.Mesenchymal stem cells avoid allogeneic rejection[J].J Inflamm(Lond),2005,2:8.
[20]Tarte K,Gaillard J,Lataillade JJ,et al.Clinical-grade production of human mesenchymal stromal cells:occurrence of aneuploidy without transformation[J].Blood,2010,115(8):1549-1553.
[21]Poggi M,Jager J,Paulmyer-Lacroix O,et al.The inflammatory receptor CD40 is expressed on human adipocytes:contribution to crosstalk between lymphocytes and adipocytes[J].Diabetologia,2009,52(6):1152-1163.
[22]Ollins M,Ling V,Carreno BM.The B7 family of immune-regulatory ligands[J].Genome Biol,2005,6(6):223.
[23]Augello A,Tasso R,Negrini SM,et al.Bone marrow mesenchymal progenitor cells inhibit lymphocyte proliferation by activation of the programmed death 1 pathway[J].Eur J Immunol,2005,35(5):1482-1490.
[24]Sheng H,Wang Y,Jin Y,et al.A critical role of IFNgamma in priming MSC-mediated suppression of T cell proliferation through up-regulation of B7-H1[J].Cell Res,2008,18(8):846-857.
[25]Seo SK,Seo HM,Jeong HY,et al.Co-inhibitory role of T-cellassociated B7-H1 and B7-DC in the T-cell immune response[J].Immunol Lett,2006,15,102(2):222-228.
[26]Zhao M,Flynet FL,Hong M,et al.MHC class II transactivator(CIITA)expression is upregulated in multiple myeloma cells by IFN-gamma[J].Mol Immunol,2007,44(11):2923-2932.
[27]Romieu-Mourez R,Francois M,Boivin MN,et al.Regulation of MHC class II expression and antigen processing in murine and human mesenchymal stromal cells by IFN-gamma,TGF-beta,and cell density[J].J Immunol,2007,179(3):1549-1558.
