嗜肺军团菌SBT、PFGE、AFLP分子分型方法的比较
2014-07-23郭玉梅周吉坤张慧贤秦丽云剧慧栋
郭玉梅,周吉坤,张慧贤,秦丽云,赵 冬,剧慧栋
(1.石家庄市疾病预防控制中心微生物检验所,河北石家庄 050011;2.河北省血液中心检验科,河北 石家庄 050011)
嗜肺军团菌(Legionella pneumophila,Lp)可引起急性呼吸道传染病,临床类型至少有肺炎型和庞蒂亚克热型。嗜肺军团菌有15个血清型,环境和临床标本中以血清1型最常见。目前对嗜肺军团菌的分子分型方法有基因序列分型(Sequence based typing,SBT)、脉冲场凝胶电泳分型(Pulsed Field Gel Electrophoresis,PFGE)、扩增片断长度多态性分型(Amplified Fragment Length Polymorphism,AFLP)等。AFLP方法曾经作为流行病学分型的快速筛查方法,首次被EWGLI所采用[1-2];PFGE方法在国内外也一直是被认可的细菌溯源研究的分型方法[3];近年,基于多个等位基因序列差异的SBT分型方法,受到研究者的关注,日益成为研究细菌分型方法的主流方法,Ratzow[4]在Gaia做SBT分型研究的基础上增加了neuA提高了SBT的分辨率。该方法目前已广泛应用于细菌性疾病暴发的分子溯源和进化研究[5]。SBT分型方法通过大量的测序序列与生物分析软件相结合,便于研究者的比对分析,为流行病学调查和建立细菌分子生物学数据库积累资料。本文选用了SBT、PFGE、AFLP三种分型方法对石家庄市6所医院冷却塔水来源的嗜肺军团菌进行了分子分型。
1 材料与方法
1.1 材料
1.1.1 菌株 收集石家庄市6所医院冷却塔水标本分离的32株嗜肺军团菌,菌株经生化鉴定及军团菌胶乳凝集试剂盒进行血清学分型,其中Lp1型24株,Lp2-14型8株。标准菌株为嗜肺军团菌ATCC 33152,由中国疾病预防控制中心传染病所馈赠。
1.1.2 主要仪器与试剂 PTC-200型PCR扩增仪(美国 M.J.Research PCR 公司)、QIAxcel型全自动毛细管电泳仪(德国 Qiagen公司)、bioMerieux DENSIMAT比浊仪、Chemi Genius2型凝胶成像系统(美国SYNGENE公司)、ND-1000型DNA浓度测定仪(美国Thermo Nanodrop公司)、CHEF Mapper型脉冲场凝胶电泳仪(美国Bio-Rad公司)。CYE基础培养基、BCYE添加剂和GVPC添加剂均购自英国Oxoid公司,DNA提取试剂盒(德国 Qiagen公司),Seakem Gold琼脂糖(美国Cambrex公司),AscI核酸内切酶(英国 Neb公司),XbaI核酸内切酶、蛋白酶 K均购自日本TaKaRa公司,PCR引物由大连宝生物合成,dNTP、DNA Polymerase、PrimeSTAR TM Buffer均购自日本TaKaRa公司,Pst1内切酶、T4 DNA连接酶、T4 DNA Ligase Buffer连接缓冲液均购自瑞士Roche公司,1×TE Buffer核酸电泳缓冲液(上海生工生物工程公司)。
1.2 方法
1.2.1 嗜肺军团菌DNA的制备 复苏冻存嗜肺军团菌菌株,挑取典型菌落传代于BCYE培养基,37℃,5%CO2培养24 h。菌株DNA提取按照试剂盒操作,提取的DNA置于-20℃保存备用。
1.2.2 基因序列分型(SBT) 选取7个等位基因,引物序列见表1。PCR反应体系:5×Prime-STAR TM Buffer(Mg2+)10 μL、dNTP(各 2.5 mmol/L)4 μL,上、下游引物(各 10 μmol/L)1 μL,DNA Polymerase(2.5 U/μL)0.5 μL,模板DNA 4 μL(100 ng),无菌纯水定容至50 μL。PCR反应条件为94℃预变性5 min;94℃变性30 s、57.4℃ 退火30 s、72℃ 延伸40 s,35个循环;72℃终末延伸10 min。PCR产物经毛细管电泳后由上海生工进行纯化和测序。测序结果经Chromas软件校对后用ContigExpress软件进行序列拼接,将拼接好的7个管家基因序列在线提交到嗜肺军团菌SBT分型数据库网站上(http://www.hpabioinformatics.org.uk)进行分析比对,获得7个管家基因等位基因谱并确定其序列型(ST)。

表1 目的基因和PCR引物序列Table1 Purpose gene and amplification primers

续表
1.2.3 脉冲场凝胶电泳(PFGE) 操作方法参照文献[6]。制备胶块的菌悬液浓度为4.0~4.5个麦氏单位,将嗜肺军团菌包埋于1%SeaKem Gold琼脂糖内,胶块凝固后,用含有25 μL蛋白酶K(20 mg/mL)的细胞裂解液(CLB)进行裂解。每个胶块用40 U的AscI酶37℃酶切4 h。沙门菌Braenderup血清型菌株H9812作为分子质量标准,每个胶块用40 U的XbaI酶37℃酶切4 h。脉冲场凝胶电泳条件:电压为6.0 V/cm,电场夹角为120°,电泳时间19 h,电泳起始脉冲时间为6.8 s,终止脉冲时间为54.2 s。电泳结束后,将胶块放入含1 μg/mL溴化乙锭的纯水中染色并用纯水脱色。采用凝胶成像仪获取图像。
1.2.4 扩增片段长度多态性分型(AFLP) 操作方法参照文献[7]。提取嗜肺军团菌DNA,采用DNA浓度测定仪测定DNA含量,含量需达到1.5 μg/μL以上。将模板DNA进行限制性酶切与连接反应。酶切体系为50 μL,包括1.5 μg/μL 基因组DNA 模板40 μL、PstI酶(20 U/μL)1 μL,10×缓冲液5 μL、100×BSA 溶液0.5 μL、灭菌蒸馏水3.5 μL。连接体系为30 μL,包括酶切产物6 μL、AFLP-LG1 6 μL、AFLP-LG2 6 μL、10×缓冲液3 μL、T4 DNA连接酶1 μL、灭菌蒸馏水8 μL。PCR反应体系:DNA 模板 5 μL,AFLP-PstI-G 0.4 μL,PCR Beads,灭菌蒸馏水19.6 μL,总体积25 μL。PCR反应条件:95℃预变性5 min,95℃变性30 s,50℃退火30 s,72℃延伸150 s,35个循环,72℃终末延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳后用凝胶成像仪获取图像。
1.2.5 统计学处理 ①聚类分析:采用BioNumerics4.0软件,选择Dice相关系数和非加权配对算数平均法(unweighted pair group average method,UPGMA)进行聚类分析;②分辨系数DI(Dimpson公式):

N:样本全部菌株数,nj被归入j组的菌株数;③相似性系数:2个图像之间的相似性系数用距离法(Dice系数,dice coefficients,SD)计算,其计算方法为,其中,nx—菌株x的总条带数;ny—菌株y的总条带数;nxy—菌株x和菌株y共有的条带数。SD值反映不同菌株PFGE图像之间的相似性程度,范围在0~l之间(0代表完全不同,1代表完全相同)。
2 结果与分析
2.1 嗜肺军团菌SBT型别分布
24株Lp1血清型嗜肺军团菌共分为4种ST型,SBT分型方法的分辨系数为0.239 1。分别为ST1型、ST345型、ST1201型和1株因neuA基因缺失而未分型。其中,ST1型为优势型占87.50%(21/24),其余型别均为4.16%(1/24),见表2。
从EWGLI网站数据库中对中国来源的嗜肺军团菌绘制进化树,显示ST345型和ST1201型为本地区独特型,且ST345型和ST1201型亲缘关系最近。未实现分型的嗜肺军团菌与其余23株菌分属不同的克隆系,亲缘关系较远,见图1。

图1 1997至2009年EWGLI网站数据库中收录的来自中国嗜肺军团菌系统发生树Fig.1 Phylogenetic tree of Legionella-pneumophila from 1997 to 2009 in our country from EWGLI database

表2 32株嗜肺军团菌SBT、PFGE、AFLP分型结果Table2 Subtyping results by SBT.PFGE and AFLP method of 32 Legionella-pneumophila

续表
2.2 嗜肺军团菌脉冲场凝胶电泳图谱(PFGE)分析
用SfiI内切酶对32株嗜肺军团菌进行限制性酶切后可产生8条左右大小为20~800 kb的电泳条带。可分为15型,分辨系数为0.925 4,见图2。相似性系数最大为100%,最小为50%。
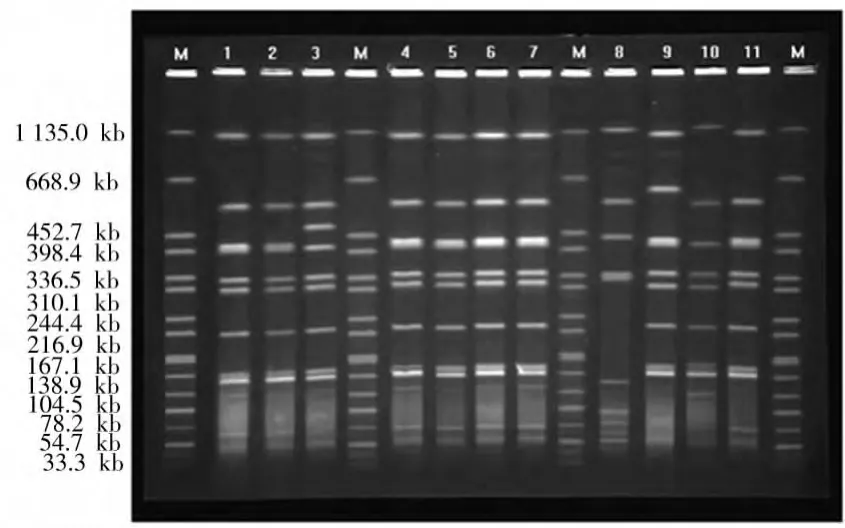
图2 嗜肺军团菌的脉冲场凝胶电泳图Fig.2 Legionella-pneumophila pulse field gel electrophoresis figure
2.3 嗜肺军团菌扩增片段长度多态性(AFLP)电泳图谱分析
32株嗜肺军团菌菌株经AFLP分析,都扩增得到7条左右大小为300~2 500 bp之间的电泳条带。相似性系数最大为100%,最小为20%。32株Lp1血清型共分为23种AFLP型别,分辨系数为 0.973 7,见图 3。

图3 嗜肺军团菌的AFLP电泳图Fig.3 Legionella-pneumophila amplified fragment length polymorphism figure
3 讨论
SBT分型技术是Gaia等[8]根据多位点测序分型原理建立的以测序为基础的嗜肺军团菌流行病学分型方法。它通过分析多个管家基因的内部片段的核苷酸序列,从而对菌株的等位基因进行多样性的比较,与国际数据库比对获得该菌株各管家基因的等位基因谱,并确定菌株的序列型即ST型。查阅国际菌株数据库可确定其是新ST型或已有ST型。目前,SBT技术主要用于嗜肺军团菌血清1型的分型,主要是由于嗜肺军团菌交叉凝集现象严重,很难将Lp2-14型再进一步分型,所以对非1型嗜肺军团菌流行病学调查受到限制。
PFGE又称宏量限制性内切酶分析(Macrorestriction analysis,MRA),目前这项技术已经广泛应用于各种致病菌所致疾病的溯源。PFGE方法可分析所有军团菌,但PFGE技术操作复杂,且还未制定国际上的标准操作方法。因此,一般只限于一些具有熟练技能的操作人员以及相应设备的参考实验室使用。
AFLP是由一个简单的限制性连接反应和PCR扩增2步组成。首先,基因组DNA经酶消化后,限制性片段连接到特殊构建的接头上。然后以PCR方法通过引物与接头互补的方式,扩增这些标记好的限制性片段,再经凝胶电泳找出限制性片段长度的多态性。欧洲军团菌感染工作组已经建立了嗜肺军团菌血清1型AFLP分型的标准操作方法,但是此种分型方法所用引物取决于接头,而接头又和所用限制酶相联系,因此对接头技术要求较高且结果不稳定。
本研究分别采用SBT、PFGE、AFLP分型方法对32株嗜肺军团菌分离株进行了分子分型。结果显示采用PFGE方法可将30株嗜肺军团菌分为15个PFGE型,分辨系数为0.925 4,用AFLP方法可将32株嗜肺军团菌分为23种AFLP型别,分辨系数为0.973 7。SBT方法可将24株Lp1嗜肺军团菌分为4个ST型,分辨系数为0.239 1,低于PFGE法和AFLP法,与文献报道相一致[9-10]。与此同时,ST型相同的菌株具有不同的PFGE和AFLP型别,提示在溯源研究方面,PFGE方法和AFLP方法优于SBT分型方法。
但是,SBT在分析菌株的进化关系和流行分布方面具有一定的优势。本研究所分出的4个ST型中,ST1型为国内外长期流行菌株并广泛存在,ST345和ST1021型为本地区独特型,ST345型仅出现在国外临床来源菌株,国内还未见有报道,而ST1021型国内外还未见有报道。ST345和ST1021型作为本地区独特型,在进化树上遗传距离近,与ST1型和ST未分型遗传距离较远。SBT结果还显示,医院冷却塔水来源的嗜肺军团菌7个等位基因的基因谱呈明显的分子多态性。
综上,SBT、PFGE、AFLP三种方法在嗜肺军团菌分子分型方面各有侧重点,其中,PFGE和AFLP分型能力强,但耗时长且实验操作复杂,不能进行全球菌株资料的比对。SBT虽然分型能力低,但此方法最快速、简便并能提供明确的结果,且在全球流行病学分布及遗传进化方面优于AFLP和PFGE法。
[1]Fry NK,Bangsborg JM,Bernander S,et al.Designation of the European Working Group on Legionella Infection(EWGLI)amplified fragment length polymorphism types ofLegionella pneumophilaserogroup 1 and results of intercentre proficiency testing using a standard protocol[J].Eur J Clin Microbiol Infect Dis,2002,21(10):722-728.
[2]Fry NK,Bangsborg JM,Bernander S,et al.Assessment of intercentre reproducibility and epidemiological comcordance ofLegionella pneumophilaserogroup 1 genotyping by amplified fragment length polymorphism analysis[J].Eur J Clin Microbiol Infect Dis,2000,19:773-780.
[3]Ragull S,Garcia nunez M,Pedro-Botet ML,et al.Legionella pneumophilain cooling towers:fluctuations in counts,determination of genetic variability by pulsed-field gel electrophoresis(PFGE),and persistence of PFGE patterns[J].Appl Environ Microbiol,2007,73(16):5382-5384.
[4]Ratzow S,Gaia V,Helbig JH,et al.Addition of neuA,the gene encoding N-acylneuraminate cytidylyl transferase,increases the discriminatory ability of the consensus sequence-based scheme for typingLegionella pheumophilaserogroup 1 strains[J].Clin Microbiol,2007,45:1965-1968.
[5]王洪敏,柯昌文,潘武滨,等.2005年广东省临床分离猪链球菌的MLST分子分型研究[J].南方医科大学学报,2008,28(8):1438-1442.
[6]Haijian Zhou,Hongyu Ren,Bingqing Zhu,et al.Optimization of pulsed-field gel electrophoresis forLegionella pneumophilasubtyping[J].Applied and environmental microbilolgy,2010,76(5):1334-1340.
[7]Huang B,Heron BA,Gray BR,et al.A predominant and virulentLegionella pneumophilaserogroup 1 strain detected in isolates from patients and water in Queensland,Australia,by an amplified fragment length polymorphism protocol and virulence gene-based PCR Assays[J].J Clin Microbiol,2004,42(9):4164-4168.
[8]Gaia V,Fry NK,Afshar B,et al.Consensus sequence-based scheme for epidemiological typing of clinical and environmental isolates ofLegionella pneumophila[J].J Clin Microbiol,2005,43(5):2047-2052.
[9]Seaturro M,Losardo M,De Ponte G,et al.Comparison of three molecular methods used for subtyping ofLegionella pneumophilastrains isolated during an epidmic of Legionellosis in Rome[J].J Clin Microbiol,2005,43(10):5348-5350.
[10]Su HP,Tzeng SC,Chou CY,et al.Compare molecule typing method with pulsed-field gel electrophoresis and multilocus aequence typing inLegionella pneumophila[J].Biomed Lab Sci,2009,21:8-12.