污水处理系统中厌氧氨氧化菌分布及影响因素
2014-07-19郑冰玉彭永臻张亮杨岸明张树军
郑冰玉,彭永臻,张亮,杨岸明,张树军
1 北京工业大学 北京市水质科学与水环境恢复工程重点实验室 北京市污水脱氮除磷与过程控制工程技术研究中心,北京 100124
2 北京城市排水集团有限责任公司,北京 100022
污水处理系统中厌氧氨氧化菌分布及影响因素
郑冰玉1,彭永臻1,张亮2,杨岸明2,张树军2
1 北京工业大学 北京市水质科学与水环境恢复工程重点实验室 北京市污水脱氮除磷与过程控制工程技术研究中心,北京 100124
2 北京城市排水集团有限责任公司,北京 100022
郑冰玉, 彭永臻, 张亮, 等. 污水处理系统中厌氧氨氧化菌分布及影响因素. 生物工程学报, 2014, 30(12): 1817−1827.
Zheng BY, Peng YZ, Zhang L, et al. Distribution and influence factors of Anammox bacteria in sewage treatment systems. Chin J Biotech, 2014, 30(12): 1817−1827.
基于厌氧氨氧化的污水生物脱氮工艺近年来发展迅速,污水处理系统中厌氧氨氧化菌的分布和多样性成为了重要的研究方向。目前,在污水处理系统中曾检测出多种厌氧氨氧化(Anaerobic ammonium oxidation,Anammox)菌,最常被检测出的是待定布罗卡地菌Candidate Brocadia和待定斯图加特库氏菌Candidate Kuenenia的Anammox菌,并且研究发现单一生境下往往只存在一种类型的Anammox菌,但是影响Anammox菌分布和多样性的因素与机制目前仍不明确。系统总结了污水处理系统中,不同工艺形式和运行条件下的Anammox菌分布情况,归纳分析了关键因素对Anammox菌分布的影响,包括底物浓度和微生物比生长速率、污泥性质与微生物生境、多重因素的联合作用和影响等。在此基础上,阐述了Anammox菌分布机制研究的工程意义,并对该领域的研究方向和思路进行了展望。
厌氧氨氧化菌,分布,影响因素,待定布罗卡地菌,待定斯图加特库氏菌
厌氧氨氧化 (Anammox) 菌在厌氧条件下能够利用亚硝酸盐作为氧化剂将氨氧化为氮气。厌氧氨氧化现象在某反硝化流化床反应器被首次发现[1],Strous等[2]在1999年确认这一新菌种的存在。目前,已经发现了5个属的Anammox菌,它们均隶属于浮霉状菌门(Phylum Planctomycetales)[3]。其中最早发现的为待定厌氧氨氧化布罗卡地菌Candidatus Brocadia anammoxidans,此后研究者们又陆续发现了待定斯图加特库氏菌Candidatus Kuenenia stuttgartiensis、待定布罗达氏阶梯烷菌Candidatus Scalindua brodae、待定韦格氏阶梯烷菌Candidatus Scalindua wagneri、待定黑海阶梯烷菌Candidatus Scalindua sorokinii、待定丙酸厌氧氨氧化球菌Candidatus Anammoxoglobus propionicus、待定亚洲杰特氏菌Candidatus Jettenia asiatica、待定荧光布罗卡地菌Candidatus Brocadia fulgida和待定硫酸盐厌氧氨氧化球菌Candidatus Anammoxoglobus sulfate[4-5]。
Anammox菌广泛分布于自然水生生态系统、陆地生态系统以及污水处理系统中。在自然水生生态系统中,较为常见的为Scalindua属[6-8],但也有部分环境中仅检测到Brocadia属[9-10]。相比之下,陆地生态系统中的Anammox种群多样性水平更高,多种陆生环境中均检测到了Kuenenia stuttgartinsis、Brocadia fulgida、Scalindua wagneri和Jettenia asiatica[11-12]。
Anammox菌在自然环境中的丰度、分布和多样性研究,促进了环境微生物和地球物质循环领域的研究进展。该菌目前已经被成功地应用于污水处理,特别是高氨氮废水处理系统中[13-15],而在这一系统中,Kuenenia和Brocadia属最为常见,但是有关这两种菌在污水处理系统这一人工环境中的分布规律及其影响机制的研究仍然较少。本文主要对污水处理系统中的上述两个Anammox菌属分布情况以及相应的影响因素进行总结归纳,旨在对其生理生化性能和分布机制有更全面的了解,并对厌氧氨氧化工程实践起到一定的指导意义。
1 污水处理系统中的Anammox菌
在不同的污水处理系统中,还有多种Anammox菌被检测到:Liu等[16]在处理含硫酸盐废水的反应器中检测到了Anammoxoglobus sulfate;Kindaichi等[17]在模拟海水的含盐配水试验中检测到了Scalindua属的Anammox菌;Quan等在运行颗粒污泥厌氧氨氧化反应器的过程中发现了新种Jettenia asiatica[18]。另外,有机酸如乙酸盐和丙酸盐的投加有利于Anammoxglobus propionicus的增殖[19]。然而,在实际污水处理厂以及用以污水处理的中试规模的生物反应器中,常被检测到的只有Brocadia和Kuenenia属的Anammox菌[14],并且它们首次被发现均是在污水处理系统中。
1.1 Brocadia属的Anammox菌
目前发现的Brocadia属的Anammox菌共有两种:Brocadia anammoxidands和Brocadia fulgida。
Brocadia anammoxidans是第一种被鉴定和富集的Anammox菌,发现于荷兰的Gist-Brocades污水处理厂,并因此而得名[20]。该种大致呈球状,细胞表面有火山口状结构,细胞壁不含肽聚糖,细胞质内含有约占整个细胞30%−60% 的厌氧氨氧化体(Anammoxosome),它可能是厌氧氨氧化发生的场所[21]。以亚硝酸为主要电子受体,以CO2为唯一碳源,不能利用小分子有机酸,如甲酸、丙酸等[4,22]。
Brocadia fulgida与Brocadia anammoxidans具有高达96% 的相似度,并且该种具有Anammox菌的一般特征:存在厌氧氨氧化体,厌氧氨氧化体脂中含有阶梯烷 (Ladderane),能在存在羟胺时产生联氨。但是,这种细菌形成的大量胞外聚合物 (Extracellular polymer substances,EPS) 能够发出明亮的自体荧光,这也是目前发现的所有Anammox菌中唯一的一种[23]。该种虽然同样以亚硝酸为电子受体,以二氧化碳为碳源,但它在小分子有机酸如乙酸存在的情况下相对其他种具有竞争优势[24]。
1.2 Kuenenia属的Anammox菌
目前发现的Kuenenia属的Anammox菌只有Kuenenia stuttgartiensis一种。1999年,Schmid等首先在生物滤池中发现这一菌种[25]。
目前,Strous等已经完成了该细菌全基因组序列的测序工作[26]。Kuenenia属与Brocadia属具有较远的亲缘关系,相似度低于90%[23]。除了具有与前述Brocadia属一致的细胞特征外,该种还有其特殊之处:可以利用有机酸进行硝酸盐的还原,通过异化作用还原硝酸盐到氨氮[27]。
2 Kuenenia与Brocadia在不同污水处理系统中的分布特点及影响因素
2.1 Kuenenia与Brocadia的分布情况
表1和表2列出了在几种利用Anammox反应处理污水的系统中,典型Anammox菌Kuenenia和Brocadia的分布情况。在这些系统中,均只检测到了Kuenenia和Brocadia其中的一种。从表中数据可以看出,在同样的反应器形式下可观察到不同的优势菌种,反应器形式对Anammox菌的种属影响并不显著。接种污泥Anammox菌的优势菌种也没有决定性的作用。接种污泥中可能同时含有低丰度的Kuenenia与Brocadia,在反应器运行的过程中某些Anammox菌具有较高的生长速率,从而在长期运行过程中表现为优势菌种。此外,去除负荷对两种菌的分布也无显著影响,说明两种Anammox菌均能应用于污水自养脱氮,并取得良好的去除效果。
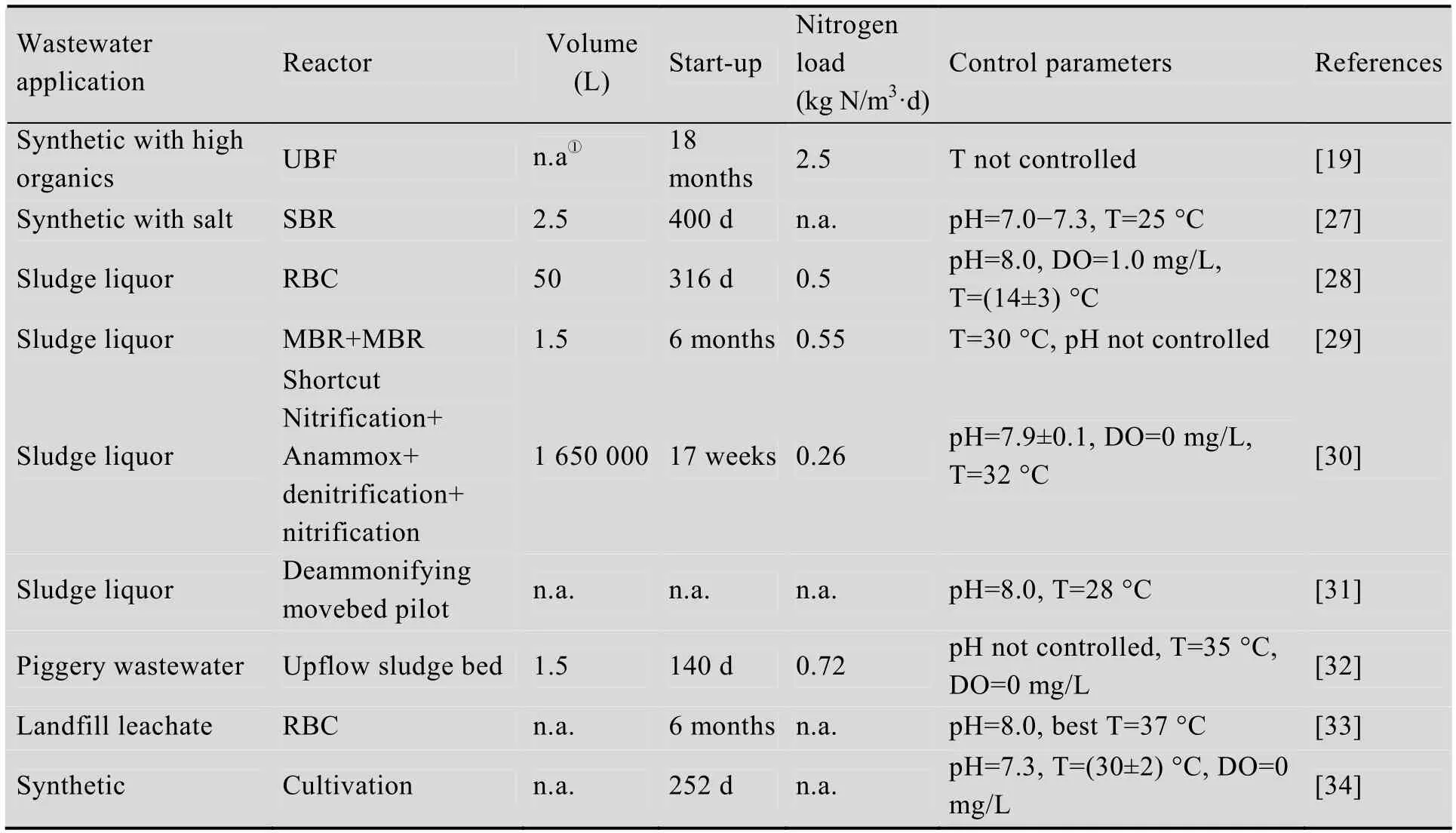
表1 以Kuenenia为主要功能菌的污水处理系统Table 1 Sewage treating systems including Kuenenia as the main functional bacteria
微生物多样性的影响因素众多,作用机制复杂,从单一优势菌种的环境中难以直接归纳出Anammox菌的分布机制。但是人们发现在某些污水处理系统中,Kuenenia与Brocadia会共存于同一生境,如表3所示。这说明两种菌之间没有明显的排斥作用,其分布主要是由生态位重叠产生的生长竞争引起的。此外,在运行过程中,当某些条件发生变化时,可观察到Anammox菌由一种向另一种转变的现象,进一步说明了两种菌最佳生长条件不同可能是其分布的主要影响机制。根据以上试验结果,本文将进一步分析影响Kuenenia和Brocadia生长的关键因素。
2.2 Kuenenia与Brocadia分布的主要影响因素和作用机制
由前文可见,各种控制参数甚至接种污泥等因素对于在各种系统中Anammox菌的种类都未见有决定性的影响;相比之下,以下各种因素的影响更加显著,是影响Anammox菌分布的潜在原因。

表2 以Brocadia为主要功能菌的污水处理系统Table 2 Sewage treating systems including Brocadia as the main functional bacteria
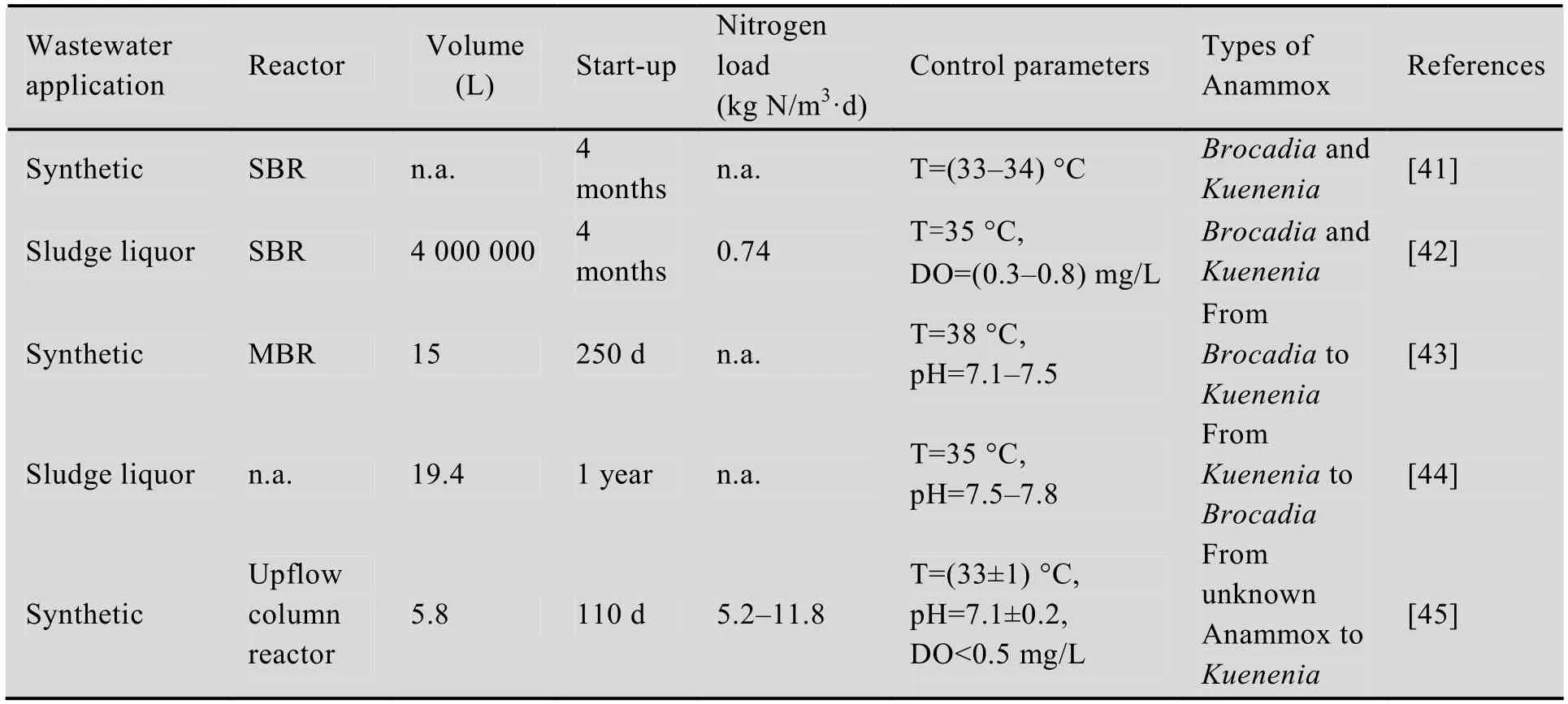
表3 Brocadia与Kuenenia共存或存在Anammox菌种之间转化的污水处理系统Table 3 Sewage treating systems including both Kuenenia and Brocadia or their mutual transformation
2.2.1 底物浓度和微生物比生长速率
厌氧氨氧化菌生长需要的底物包括亚硝酸盐 (NO2--N)、总氮 (Total nitrogen,TN) 和无机碳源。不同种属的厌氧氨氧化菌的底物亲和能力有所不同,因此底物浓度和种类会影响厌氧氨氧化菌的生长速率,在特定的污泥龄条件下生长速率快的菌种逐渐被富集,成为优势菌种。
研究发现污水中NO2--N的浓度是影响污水处理系统中厌氧氨氧化菌的种类的关键因素之一,主要表现为Kuenenia对亚硝酸盐的浓度比Brocadia有着更强的适应力,从而在与Brocadia的竞争中占据优势。Sun等[34]在育种过程中发现,当系统中亚硝酸盐浓度成为抑制菌种生长的限制因素时,由于Kuenenia对亚硝酸盐浓度的半饱和常数Ks (0.2−3 mmol/L) 低于Brocadia (5 mmol/L),对亚硝酸盐亲和力更强的Kuenenia就更具有竞争性,在系统中逐渐被选择出来,而Brocadia逐渐被淘汰。此外,在van der Star等[43]运行的MBR小试试验中发现,当SRT (Sludge retention time,污泥龄) 为16 d时,在101 d内发生了菌种由Brocadia向Kuenenia的转变。由此得出结论:在如此短的时间内,两种Anammox菌的最大比生长速率μmax不足以成为影响菌种选择的主要因素,对亚硝酸盐浓度的半饱和常数Ks才是促进菌种转变的最可能原因;亚硝酸盐的半饱和常数Ks是选择Kuenenia的主要策略 (即Kuenenia是生物进化策略中的K型策略者),而最大生长速率μmax是选择Brocadia的主要策略 (即Brocadia是生物进化策略中的r型策略者)。
由表1和表2可以看出,Kuenenia大多存在于处理TN浓度较高的污泥消化液[28-31]、养猪废水[32]、垃圾渗滤液[33]等的工艺流程中,这可能同样表明了该种相对于Brocadia,对较高的TN浓度具有更好的适应性。Yang等[45]发现,在较高的TN负荷 (5.2−11.8 kg N/m3·d) 下长期运行的反应器中,菌种发生了转变,由起初的未知菌种KSU-1转化为Kuenenia和另一未知菌种KU-2,这一结果也同样证明了上述观点。
有研究表明[45],当碳源以高浓度的NaHCO3形式添加时,生物膜系统中的菌种发生了由未知菌种到Kuenenia的转变,这说明该菌种对于无机物有较强的耐受力。此外,在存在小分子有机物如甲酸盐、乙酸盐、丙酸盐、甲胺和二甲胺的条件下,Brocadia fulgida相对于其他Anammox菌具有更强的竞争优势。根据计算,如果反硝化细菌能够利用所提供的全部乙酸进行反硝化过程,Brocadia fulgida 将会占到全菌的40%,然而试验中这一数字为70%−80%[24]。这说明该菌的细胞能够将乙酸作为电子供体氧化亚硝酸盐,也进一步表明Anammox反应能够应用到富含有机物的污水中,如表2中的污泥消化液[15]、味精废水[19]、养猪废水[40]等。
2.2.2 污泥性质与微生物生境
除底物浓度和种类外,污泥性质与微生物的生存环境对其多样性也有十分显著的影响。
在污水处理系统中,研究发现在同一反应器中,不同的污泥聚集形态存在不同的优势菌种。Van der Star[43]等在颗粒污泥培养系统中发现,Anammox菌的优势菌种从接种污泥的Brocadia逐渐转化为Kuenenia。Innerebner等[15]在DEMON反应器中发现在絮体污泥中Anammox细菌优势菌种为Kuenenia,颗粒污泥中Anammox细菌的优势菌种为Brocadiafulgida。在笔者所在的研究团队内,两段式Anammox颗粒污泥系统中,颗粒污泥所含Anammox菌97% 为Brocadia,仅有2% 为Kuenenia;在两段式Anammox絮体污泥系统中,絮体污泥中93% 为Kuenenia,仅有7% 为Brocadia;在一体化Anammox颗粒污泥系统中,颗粒污泥所含的Anammox菌全部为Brocadia属。主要原因可能在于颗粒污泥和生物膜系统中污泥结构密实[46],且污泥中含有EPS,构成了整个结构的骨架;而在絮体污泥中,EPS的量要少于前者。此外,颗粒污泥和生物膜系统提供了利于Brocadia生长的环境,包括较长的世代时间,避免溶解氧的潜在抑制,也可能是其在两种系统中占主导地位的重要原因。
污泥中EPS的含量及组成的变化是影响污泥聚集形态的重要原因,而EPS的分布与细菌所处的生长环境有关,并且各菌种EPS所含物质的比例也具有很大差异。对于Kuenenia和Brocadia两种Anammox 菌,其EPS中所含多糖和细胞蛋白质的百分比分别为 (2.1±0.3)%和(1.0±0.2)%[46]。当EPS含量显著降低时,已形成的Anammox颗粒污泥会迅速解体,系统内的优势菌种也会由Brocadia转变为Kuenenia;此外,EPS组成上的变化会影响细菌的表面特征和物理特性,在厌氧颗粒污泥系统中,EPS多糖与蛋白质的比例在1∶6到1∶2之间[47],这也反过来表明该比例更高的Brocadia更适应于生长在颗粒污泥的系统中。但是系统内污泥形态、污泥中的EPS和Anammox菌适宜的生境的相互关系仍缺乏直接的试验证据,Anammox菌的适宜生境仍需要进一步的研究。
2.2.3 多重因素的联合作用和影响
在污水处理系统内,存在影响Anammox菌分布的多种因素。这些因素相互影响,共同作用决定了系统中优势菌种的种类。比如系统中的亚硝酸盐不仅是厌氧氨氧化菌的底物之一,也是影响污泥聚集形态和EPS的重要因素。随着亚硝酸盐浓度的提高,Anammox菌会受到抑制,而当亚硝酸盐浓度达到100 mg/L时,这种抑制会导致污泥形态由颗粒裂解成絮体。这是因为:作为形成颗粒污泥骨架的EPS的主要成分为多糖和蛋白质,使得EPS的合成需要大量的腺嘌呤核苷三磷酸 (Adenosine triphosphate,ATP),而高浓度的亚硝酸盐会破坏跨膜质子梯度从而抑制ATP的合成,导致EPS的含量降低和颗粒污泥结构的瓦解[47]。颗粒污泥的形成更有利于Brocadia的生存,相反,当亚硝酸盐浓度过高使得颗粒污泥裂解成絮体污泥后,虽然会导致污水处理效果的下降,但合理的降低亚硝酸盐浓度,Kuenenia也会得到积累。
除此之外,盐度也会对Anammox菌的多样性和分布产生影响。提供适当的盐度,能够选择性地富集培养出Kuenenia。Kartal等在两个SBR (SBRsalt和SBRfresh) 中进行了淡水Anammox菌对盐度适应的试验。原泥取自一RBC反应器中,只含2%−5% 的Scalindua,在盐度为30 g/L条件下经过4个月的培养,Anammox菌占总菌的70%−80%,其中含50%的Kuenenia和50% 的Scalindua;360 d时,在两反应器里,Anammox菌仍能占到70%−80%,但在SBRfresh里99% 为Kuenenia,只有1% 为Scalindua;在SBRsalt里70% 为Kuenenia,30% 为Scalindua[27]。如果盐度对淡水厌氧氨氧化菌Kuenenia有不良影响,当盐度增长为30 g/L (海水盐度) 时,Scalindua相对Kuenenia应该更有竞争优势,但事实上优势菌种仍为Kuenenia (70%);并且在两SBR中,厌氧氨氧化活性一致,说明其对反应过程是有贡献的。该试验结果表明,污水处理系统中可能同时存在多个条件,影响厌氧氨氧化菌种的分布和迁移转化。因此在分析系统内厌氧氨氧化菌分布时,应充分考虑不同因素的相互关联和影响。
3 工程意义
在污水系统中,除去特定水质条件下会存在Anammoxoglobus、Scalindua和Jettenia属外,常见的Anammox菌种只有Brocadia和Kuenenia属,因此研究它们的分布和影响其分布的因素显得尤为重要,这一重要性主要体现为两个方面。
3.1 揭示Brocadia和Kuenenia的生理生化特性
近年来,研究者们对于Brocadia和Kuenenia属的Anammox菌的研究取得了许多突破性的进展,阐明了它们各自形态特征、细胞组分特征、富集与分离特性和生态学特征,提出了Anammox反应的数学模型,但是,对于二者的生态位分化的研究并不透彻。因此,将不同条件下运行的污水处理系统中Brocadia和Kuenenia分布情况进行总结归纳,得出其各自生长的最优化条件,对探究其生理生化特性并最终获得它们的纯培养具有重要意义。
3.2 对现行污水处理厂的运行具有指导意义
在污水处理厂的设计阶段,污水处理构筑物可以视为“黑箱”。如果了解不同属Anammox菌所需的运行条件,即便不了解“黑箱”的内部结构,仍可以通过对输入黑箱中的变量 (运行参数)进行控制,得到良好的处理效果。
在污水处理厂的启动阶段,通过合理控制Brocadia和Kuenenia生长繁殖的影响因素,可以实现反应器的快速启动,最大限度的节约能源和运行成本。在污水处理厂的运行阶段,可能由于某些限制性因素 (如处理构筑物的种类、经济条件等),需要特定的方式来运行反应器,就可以根据实际情况来选择性地接种和富集Brocadia和Kuenenia中一种:如利用生物膜法或颗粒污泥法获得Brocadia属的Anammox菌,相应的,在絮体污泥中富集Kuenenia属的Anammox菌;利用两种菌不同的生长策略 (r型和K型),在不同的基质浓度和比生长速率下,分别获得两种不同的菌属。
4 展望
Anammox菌在污水处理系统中扮演着重要的角色,影响不同属的Anammox菌在污水系统中分布的因素往往不是单一的,它们相互影响相互作用,最终选择出适宜在不同条件下生存的Anammox菌。近年来,随着科研手段的提高和理论水平的深入,人们对Anammox菌已经有了初步的认识;但总体而言,人们对于污水处理系统中Anammox菌的分布和影响因素及其机理还不够明晰,仍有较多问题需要通过思路创新、方法创新和技术革新等进行深入研究:
1) 对不同生境下的各属的Anammox菌进行富集培养,并获得其纯培养,阐明其各自的生理生化特性;
2) 不同的污水处理系统中,各种运行参数对不同属的Anammox影响差异较大,需要全面考察系统中的所有影响因子,结合单一因素的影响深入分析其综合效应;
3) 完善各属尤其是Brocadia和Kuenenia属的代谢模型,从微观角度进一步明确它们的代谢途径,为实际污水处理厂获得稳定高效的处理效果提供理论支持。
REFERENCES
[1] Mulder A, Vandegraaf A, Robertson L, et al. Anaerobic ammonium oxidation discovered in a denitrifying fluidized-bed reactor. FEMS Microbiol Ecol, 1995, 16 (3): 177–183.
[2] Strous M, Fuerst A, Kramer M, et al. Missing lithotroph identified as new planctomycete. Nature, 1999, 400(6743): 446–449.
[3] Shen LD, Zheng P, Hu BL. Anaerobic ammonium oxidation in natural ecosystems. Acta Ecol Sin, 2011, 31(15): 4447–4454 (in Chinese).沈李东, 郑平, 胡宝兰. 自然生态系统中的厌氧氨氧化. 生态学报, 2011, 31(15): 4447–4454.
[4] Zheng P, Zhang L. Characterization and classification of anaerobic ammonium oxidation (anammox) bacteria. J Zhejiang Univ: Agric & Life Sci, 2009, 35(5): 473–481 (in Chinese).郑平, 张蕾. 厌氧氨氧化菌的特性与分类. 浙江大学学报: 农业与生命科学版, 2009, 35(5): 473–481.
[5] Guo JH, Peng YZ. Heterotrophic nitrification, anaerobic ammonia oxidation and archaeal ammonia oxidation in a new nitrogen cycle. Acta Sci Circumst, 2008, 28(8): 1489–1498 (in Chinese).郭建华, 彭永臻. 异养硝化、厌氧氨氧化及古菌氨氧化与新的氮循环. 环境科学学报, 2008, 28(8): 1489–1498.
[6] Schubert J, Durisch-Kaiser E, Wehrli B, et al. Anaerobic ammonium oxidation in a tropical freshwater system (Lake Tanganyika). Environ Microbiol, 2006, 8(10): 1857–1863.
[7] Hong YG, Yin B, Zheng TL. Diversity and abundance of anammox bacterial community in the deep-ocean surface sediment from equatorial Pacific. Appl Microbiol Biotechnol, 2011, 89(4): 1233–1241.
[8] Li M, Cao HL, Hong YG, et al. Seasonal dynamics of anammox bacteria in estuarial sediment of the mai po nature reserve revealed by analyzing the16S RNA and hydrazine oxidoreductase (hzo) genes. Microbes Environ, 2011, 26(1): 15–22.
[9] Yoshinaga I, Amano T, Yamagishi T, et al. Distribution and diversity of anaerobic ammonium oxidation (anammox) bacteria in the sediment of a eutrophic freshwater lake, Lake Kitaura, Japan. Microbes Environ, 2011, 26(3): 189–197.
[10] Zhang Y, Ruan XH, den Camp H, et al. Diversity and abundance of aerobic and anaerobic ammonium-oxidizing bacteria in freshwater sediments of the Xinyi River (China). Environ Microbiol, 2007, 9(9): 2375–2382.
[11] Humbert S, Tarnawski S, Fromin N, et al. Molecular detection of anammox bacteria interrestrial ecosystems: distribution and diversity. Isme J, 2010, 4(3): 450–454.
[12] Amano T, Yoshinaga I, Yamagishi T, et al. Contribution of anammox bacteria to benthic nitrogen cycling in a mangrove forest and shrimp ponds, Haiphong, Vietnam. Microbes Environ, 2011, 26(1): 1–6.
[13] Wett B. Development and implementation of a robust deammonification process. Water Sci Technol, 2007, 56(7): 81–88.
[14] Van der SL, Abma R, Blommers D, et al. Startup of reactors for anoxic ammonium oxidation: Experiences from the first full-scale anammox reactor in Rotterdam. Water Res, 2007, 41(18): 4149–4163.
[15] Innerebner G, Insam H, Franke-Whittle H, et al. Identification of anammox bacteria in a full-scale deammonification plant making use of anaerobic ammonia oxidation. Syst Appl Microbiol, 2007,30(5): 408–412.
[16] Liu ST, Yang FL, Gong Z, et al. Application of anaerobic ammonium-oxidizing consortium to achieve completely autotrophic ammonium and sulfate removal. Bioresour Technol, 2008, 99(15): 6817–6825.
[17] Kindaichi T, Awata T, Suzuki Y, et al. Enrichment using an up-flow column reactor and community structure of marine anammox bacteria from coastal sediment. Microbes Environ, 2011, 26(1):67–73.
[18] Quan ZX, Rhee SK, Zuo JE, et al. Diversity of ammonium-oxidizing bacteria in a granular sludge anaerobic ammonium-oxidizing (anammox) reactor. Environ Microbiol, 2008, 10(11): 3130–3139.
[19] Hu BL, Zheng P, Tang CJ, et al. Identification and quantification of anammox bacteria in eight nitrogen removal reactors. Water Res, 2010, 44(17): 5014–5020.
[20] Kuenen G, Jetten M. Extraordinary anaerobic ammonium-oxidizing bacteria. ASM News, 2001, 67(9): 456–463.
[21] Zheng P, Xu XY, Hu BL. Novel theory and technology for biological nitrogen removal. Beijing: Science Press, 2004: 87–89 (in Chinese).郑平, 徐向阳, 胡宝兰. 新型生物脱氮理论与技术, 北京: 科学出版社, 2004: 87–89.
[22] Van der G, Bruijn P, Robertson L, et al. Autotrophic growth of anaerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor. Microbiol, 1996, 142(8): 2187–2796.
[23] Kartal B, Niftrik L, Sliekers O, et al. Application, eco-physiology and biodiversity of anaerobic ammonium-oxidizing bacteria. Rev Environ Sci Biotechnol, 2004, 3(3): 255–264.
[24] Kartal B, Niftrik L, Rattray J, et al. Candidatus 'Brocadia fulgida': anautofluorescent anaerobic ammonium oxidizing bacterium. FEMS Microbiol Ecol, 2007, 63(1): 46–55.
[25] Schmid M, Twachtmann U, Klein M, et al. Molecular evidence for genus level diversity of bacteria capable of catalyzing anaerobic ammonium oxidation. Syst Appl Microbiol, 2000, 23(1): 93–106.
[26] Strous M, Pelletier E, Mangenot S, et al. Deciphering the evolution and metabolism of an anammox bacterium from a community genome. Nature, 2006, 440 (7085): 790–794.
[27] Kartal B, Koleva M, Arsov R, et al. Adaptation of a freshwater anammox population to high salinity wastewater. J Biotechnol, 2006, 126(4): 546–553.
[28] Pynaert K, Smets F, Beheydt D, et al. Start-up of autotrophic nitrogen removal reactors via sequential biocatalyst addition. Environ Sci Technol, 2004, 38(4): 1228–1235.
[29] Wyffels S, Boeckx P, Pynaert K, et al. Nitrogen removal from sludge reject water by a two-stage oxygen-limited autotrophic nitrification denitrification process. Water Sci Technol, 2004, 49(5/6): 57–64
[30] Desloover J, de Clippeleir H, Boeckx P, et al. Floc-based sequential partial nitritation and anammox at full scale with contrasting N2O emissions. Water Res, 2011, 45(9): 2811–2821.
[31] Helmer-Madhok C, Schmid M, Filipov E, et al. Deammonification in biofilm systems: population structure and function. Water Sci Technol, 2002, 46(1/2): 223–231.
[32] Hwang S, Min S, Choi E, et al. Nitrogen removal from piggery waste using the combined SHARON and ANAMMOX process. Water Sci Technol, 2005, 52(10/11): 487–494.
[33] Egli K, Fanger U, Alvarez J, et al. Enrichment and characterization of an anammox bacterium from a rotating biological contactor treating ammonium-rich leachate. Arch Microbiol, 2001, 175(3): 198–207.
[34] Sun WJ, Banihani Q, Sierra-Alvarez R, et al. Stoichiometric and molecular evidence for the enrichment of anaerobic ammonium oxidizing bacteria from wastewater treatment plant sludge samples. Chemosphere, 2011, 84(9): 1262–1269.
[35] Yang Y, Zuo JE, Quan ZX, et al. Study onperformance of granular ANAMMOX process and characterization of the microbial community in sludge. Water Sci Technol, 2006, 54(8): 197–207.
[36] Fujii T, Sugino H, Rouse D, et al. Characterization of the microbial community in an anaerobic ammonium-oxidizing biofilm cultured on a nonwoven biomass carrier. J Biosci Bioeng, 2002, 94(5): 412–418.
[37] Winkler H, Kleerebezem R, van Loosdrecht M. Integration of anammox into the aerobic granular sludge process for main stream wastewater treatment at ambient temperatures. Water Res, 2012, 46(1): 136–144.
[38] Winkler H, Yang JJ, Kleerebezem R, et al. Nitrate reduction by organotrophic anammox bacteria in a nitritation/anammox granular sludge and a moving bed biofilm reactor. Bioresour Technol, 2012, 114: 217–223.
[39] Cho S, Takahashi Y, Fujii N, et al. Nitrogen removal performance and microbial community analysis of an anaerobic up-flow granular bed anammox reactor. Chemosphere, 2010, 78(9): 1129–1135.
[40] Figueroa M, Vázquez-Padín R, Mosquera -Corrala, et al. Is the CANON reactor an alternative for nitrogen removal from pre-treated swine slurry. Biochem Eng J, 2012, 65: 23–29.
[41] Chamchoi N, Nitisoravut E. Anammox enrichment from different conventional sludges. Chemosphere, 2007, 66(11): 2225–2232.
[42] Jeanningros Y, Vlaeminck E, Kaldate A, et al. Fast start-up of a pilot-scale deammonification sequencing batch reactor from an activated sludge inoculum. Water Sci Technol, 2010, 61(6): 1393–1400.
[43] van der Star WR, Miclea I, van Dongen U, et al. The membrane bioreactor: A novel tool to grow anammox bacteria as free cells. Biotechnol Bioeng, 2008, 101(2): 286–294.
[44] Park H, Rosenthal A, Ramalingam K, et al. Linking community profiles, gene expression and N-removal in anammox bioreactors treating municipal anaerobic digestion reject water. Environ Sci Technol, 2010, 44(16): 6110–6116.
[45] Yang JC, Zhang L, Fukuzaki Y, et al. High-ratenitrogen removal by the anammox process with a sufficient inorganic carbon source. Bioresour Technol, 2010, 101(24): 9471–9478.
[46] Irina C, Wim G, John H, et al. Challenging protein purification from anammox bacteria. Int J Biol Macromol, 2006, 39(1-3): 88–94.
[47] Chen TT, Zheng P, Shen LD, et al. Dispersal and control of anammox granular sludge at high substrate concentrations. Biotechnol Bioproc E, 2012, 17(5): 1093–1102.
(本文责编 陈宏宇)
Distribution and influence factors of Anammox bacteria in sewage treatment systems
Bingyu Zheng1, Yongzhen Peng1, Liang Zhang2, Anming Yang2, and Shujun Zhang2
1 Key Laboratory of Beijing Water Quality Science and Water Environment Recovery Engineering, Engineering Research Center for Sewage Nitrogen and Phosphorus Removal and Process Control of Beijing, Beijing University of Technology, Beijing 100124, China
2 Beijing Drainage Group Co. Ltd., Beijing 100022, China
Anammox, distribution, influence factors, Brocadia, Kuenenia
February 20, 2014; Accepted: April 14, 2014
Yongzhen Peng. Tel/ Fax: +86-10-67392627; E-mail: pyz@bjut.edu.cn
Supported by: National Natural Science Foundation of China (No. 21177005), Project of Science and Technology of Beijing (No. D131100003913001).
国家自然科学基金 (No. 21177005),北京市科技计划项目 (No. D131100003913001) 资助。
Abstract: Nitrogen removal techniques based on Anammox process are developing rapidly these years. The distribution and diversity of Anammox have become important research directions. A variety of Anammox have been detected till now, of which only Kuenenia and Brocadia are often detected in wastewater treatment systems. In addition, in a single niche there is only one type of Anammox bacteria. However, the distribution mechanism and transformation of Anammox bacteria in different niches are still ambiguous. Therefore, the distribution of Anammox in various conditions was summarized and analyzed in this article. And the key factors influencing the distribution of Anammox were concluded, including substrate concentration and the specific growth rate, sludge properties and microbial niche, the joint action and influence of multiple factors. The engineering significance research on the distribution and influencing factors of Anammox bacteria in the sewage system and proposed research prospects were expounded.
