缺氧、氧化应激对视网膜色素上皮细胞增殖及葡萄糖调节蛋白78表达的影响
2014-07-08李漫丽戚卉吴雅臻
李漫丽 戚卉 吴雅臻
葡萄糖调节蛋白(glucose-regulated protein,GRP)78属于热休克蛋白(heat shock protein,HSP)70家族,是内质网上最多的分子伴侣蛋白,被认为是细胞应激反应的标志性分子,并具有保护细胞、抵抗细胞凋亡的作用。GRP78涉及到多种细胞的增殖、存活、转移等演化过程,目前被广泛研究[1]。视网膜色素上皮(retinal pigment epithelium,RPE)细胞能够分泌一系列细胞因子,调节局部免疫反应,对维持稳定的视网膜免疫环境起重要作用,RPE的异常病理变化在多种视网膜疾病的发生发展过程中起重要作用。本研究通过体外培养人RPE细胞,以氯化钴(cobalt chloride,CoCl2)诱发缺氧模型[2]、过氧化氢(hydrogen peroxide,H2O2)诱发氧化应激模型[3-4],分别观察缺氧、氧化应激对RPE细胞增殖活力的影响及GRP78表达的变化,为研究RPE细胞对不同应激的反应机制提供依据,也为GRP78的功能研究打下基础。
1 材料与方法
1.1主要材料人RPE细胞株(D407)购自中山眼科中心,GRP78多克隆抗体购自Invotrigen公司,免疫组织化学试剂Biotin SP-HRP Kit、DMEM培养基、小牛血清、胰蛋白酶购自美国Gibco公司,MTT、二甲基亚砜购自美国Sigma公司,细胞培养板购自美国Costar公司。
1.2细胞培养人RPE细胞株(D407)在含体积分数5% CO2的37 ℃培养箱中,用含体积分数10%小牛血清的DMEM培养基进行贴壁培养,用2.5 g·L-1胰蛋白酶进行消化传代。取对数生长期细胞进行胰蛋白酶消化,用含体积分数10%小牛血清的DMEM培养基将细胞制成100×103mL-1的细胞悬液,分别接种于96孔、6孔培养板内。96孔培养板以每孔20×103个细胞接种,用于四甲基偶氮唑蓝(MTT)法测定细胞存活率;6孔培养板中预先放入高压灭菌过的玻璃盖玻片,接种细胞密度为2.5×106个·mL-1,每孔2.5 mL细胞悬液,用于细胞爬片行免疫细胞化学染色实验。
1.3实验分组实验分为量-效关系组和时-效关系组,量-效关系组观察不同浓度的CoCl2、H2O2对RPE细胞增殖的影响,分组方法:(1)空白对照组:常规培养RPE细胞;(2)化学缺氧组:设Co1组、Co2组、Co3组、Co4组,即培养基中CoCl2终浓度分别为100 μmol·L-1、200 μmol·L-1、400 μmol·L-1、800 μmol·L-1;(3)氧化应激组:设H1组、H2组、H3组、H4组,即培养基中H2O2终浓度分别为100 μmol·L-1、200 μmol·L-1、400 μmol·L-1、800 μmol·L-1。其中化学缺氧组和氧化应激组细胞分别经不同浓度的CoCl2、H2O2作用12 h后,更换培养液,使用MTT法检测细胞增殖情况。根据量-效关系组的实验结果,在CoCl2终浓度为200 μmol·L-1、H2O2终浓度为400 μmol·L-1的基础上,设立时-效关系分组,观察CoCl2、H2O2作用不同时间对RPE细胞GRP78表达的影响,分组方法:(1)空白对照组:常规培养RPE细胞;(2)化学缺氧组:加入CoCl2,使其终浓度为200 μmol·L-1,设Co8 h组、Co12 h组、Co16 h组,即CoCl2作用时间分别为8 h、12 h、16 h;(3)氧化应激组:加入H2O2,使其终浓度为400 μmol·L-1,设H8 h组、H12 h组、H16 h组,即H2O2作用时间分别为8 h、12 h、16 h。
1.4MTT法检测细胞活力收集对数期细胞,调整细胞悬液浓度,接种于96孔板,每孔200 μL,置37 ℃、含体积分数5%CO2细胞培养箱内培养使细胞贴壁;小心吸去上清,加入20 μL MTT溶液(以PBS配制成5 g·L-1),继续培养4 h;吸掉上清,每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解;在BIO-RAD550型酶联免疫检测仪(美国)490 nm处测量各孔的吸光值(OD值)。同时设置调零孔(培养基、MTT、二甲基亚砜),对照孔(细胞、相同浓度的药物溶解介质、培养液、MTT、二甲基亚砜)。实验结果以细胞存活率计算:细胞存活率=处理组的OD值/对照组的OD值×100%,各实验组每组设12孔,实验重复3次。
1.5免疫细胞化学染色检测GRP78蛋白表达情况取出细胞爬片,40 g·L-1多聚甲醛固定,正常山羊血清封闭液室温孵育20 min,滴加GRP78多克隆抗体(1500稀释),4 ℃孵育过夜;滴加过氧化物酶标记的二抗,37 ℃孵育1 h,DAB显色5 min,蒸馏水洗涤以终止反应;充分水洗后,苏木素轻度复染,乙醇脱水,二甲苯透明,中性树胶封片。阴性对照采用PBS代替一抗。显微镜下观察RPE细胞中GRP78的表达情况,染色阳性反应物质表现为棕黄色颗粒。每组标本3张爬片,每张爬片随机取5个高倍镜视野,计数棕黄色阳性细胞数,计算阳性细胞率,即阳性细胞率=阳性细胞数/总体细胞数×100%,取平均值进行统计分析。
2 结果
2.1不同浓度CoCl2、H2O2对RPE细胞存活率的影响在光镜下观察,正常体外培养的RPE细胞生长旺盛,呈多角形,细胞紧密排列成簇生长,细胞贴壁能力强,排列紧密,长满后表现为接触性抑制;化学缺氧组、氧化应激组细胞体积明显变小,贴壁能力减弱,可见漂浮的死亡细胞。MTT测定结果显示,化学缺氧各浓度组与空白对照组相比细胞活性均下降,而且细胞的凋亡率与CoCl2诱导浓度呈正相关。对不同浓度CoCl2、H2O2干预组细胞存活率分别行单因素方差分析,组间差异均有统计学意义(均为P=0.000);用SNKq检验分别分析不同药物浓度干预组与空白对照组间的差异情况,结果显示,除100 μmol·L-1和200 μmol·L-1H2O2组与空白对照组间细胞存活率差异无统计学意义(均为P>0.05)外,其余各实验组与空白对照组间差异均有统计学意义(均为P<0.05)。不同浓度CoCl2、H2O2对RPE细胞存活率的影响见图1。
2.2GRP78在RPE细胞中表达的免疫细胞化学分析正常培养的RPE细胞中即有GRP78表达。GRP78表达的典型免疫细胞化学染色结果见图2。各组RPE细胞中GRP78阳性细胞率统计结果显示:空白对照组为(5.4±3.0)%;Co8 h、Co12 h、Co16 h组分别为(34.2±7.1)%、(54.4±9.1)%、(34.7±6.8)%;H8 h、H12 h、H16 h组分别为:(37.8±7.1)%、(57.4±5.1)%、(42.5±3.9)%。对各组GRP78阳性细胞率进行单因素方差分析,结果显示,化学缺氧组、氧化应激组与空白对照组各组间总体差异均有统计学意义(均为P<0.01);化学缺氧组间经SNKq检验发现,除Co8 h组与Co16 h组相比差异无统计学意义(P>0.05)外,其余各组间两两比较差异均有统计学意义(均为P<0.01);氧化应激组间经SNKq检验,除H8 h组与H16 h组相比差异无统计学意义(P>0.05)外,其余各组间两两比较差异均有统计学意义(均为P<0.01)。可见,在200 μmol·L-1CoCl2、400 μmol·L-1H2O2作用下,GRP78的表达均呈先升高后下降的趋势,即CoCl2、H2O2作用12 h组GRP78的表达量最高,当药物作用时间延长到16 h时,GRP78的表达又出现下降,但仍强于空白对照组(P<0.01)。
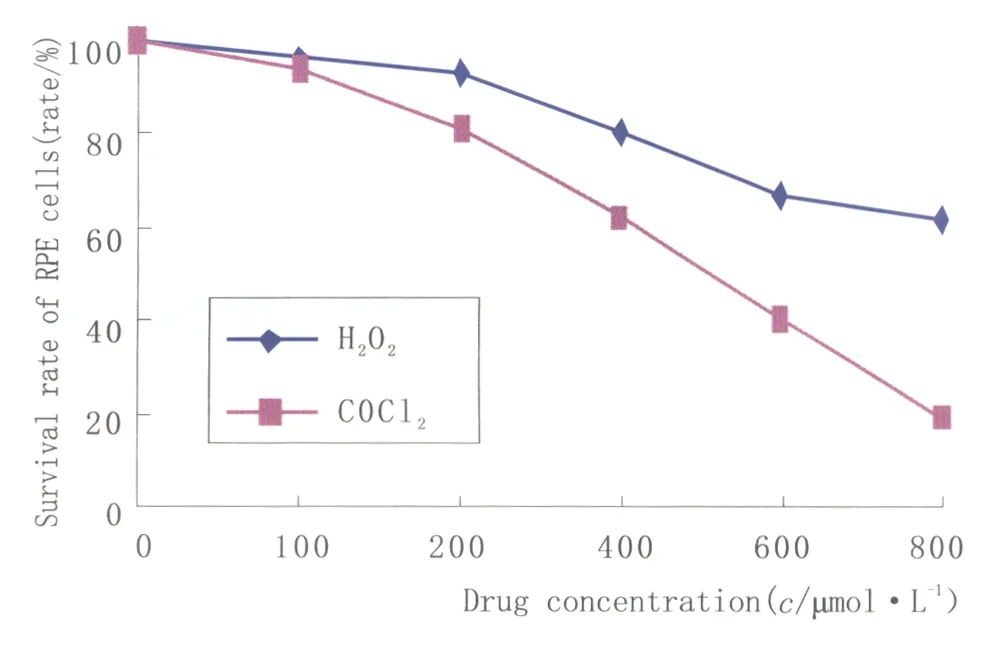
Figure 1 Effects of different concentration of CoCl2,H2O2 on survival rate of RPE cells 不同浓度CoCl2、H2O2对RPE细胞存活率的影响
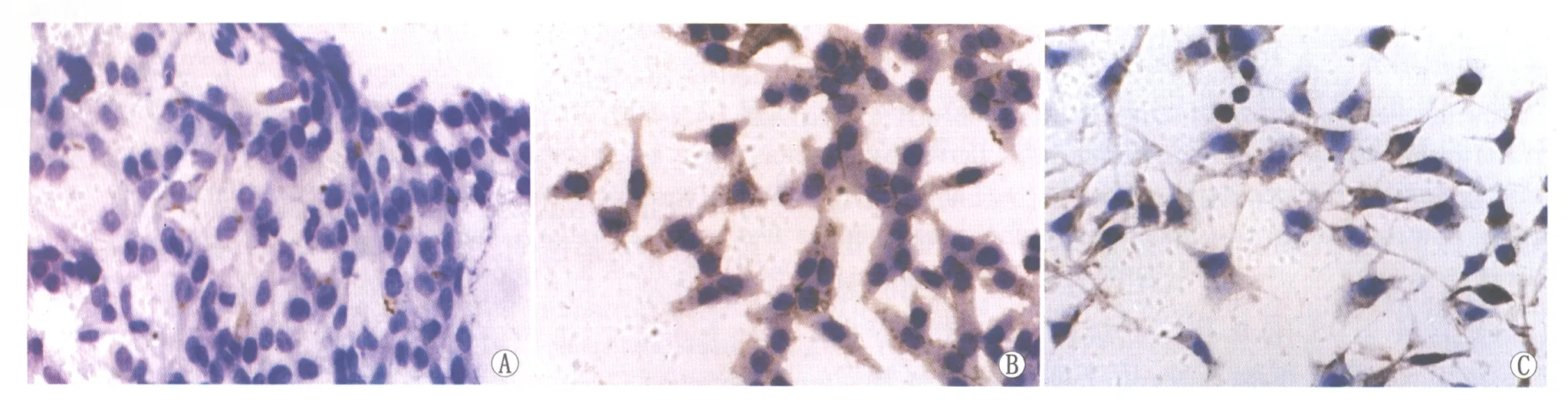
Figure 2 Expression of GRP78 in RPE cells by immunocytochemistry staining(SP,×400).A:Control group,the positive GRP78 cells were seldom observed;B:200 μmol·L-1 CoCl2 group,there were many positive GRP78 cells;C:400 μmol·L-1 H2O2 group,there were many positive GRP78 cells RPE细胞中GRP78表达的免疫细胞化学染色(SP,×400)。A:空白对照组,GRP78少量表达;B:200 μmol·L-1 CoCl2组,GRP78大量表达;C:400 μmol·L-1 H2O2组,GRP78大量表达
3 讨论
深入探讨视网膜损伤的分子生物学机制,选择和评价早期、特异、敏感的生化标志物,对于多种视网膜疾病的诊断、治疗和早期预警都有重要意义。GRP78属于HSP70家族,是内质网上最多的分子伴侣蛋白,生理情况下GRP78在基础水平表达,主要作用是作为分子伴侣参与蛋白质的折叠和亚基的组装、运输以及降解等过程,以满足内质网内新合成多肽链向成熟型蛋白质转化的需要,调节靶细胞的活性和功能,当细胞在缺血、缺氧、低糖、氧化应激、钙离子失衡等环境下时,许多细胞内蛋白发生变性,导致大量多肽链和错误折叠蛋白在内质网内积聚,此时GRP78的表达量显著增高,所以GRP78被认为是内质网应激反应的标志性分子,GRP78的表达多少对决定应激细胞的结局,如抵抗、适应、损伤或凋亡等有重要作用,对这方面的研究无论在科学理论还是在应用前景上都具有重大意义[5-7]。根据目前的研究,GRP78在多种疾病的发生中起重要作用,例如缺血性疾病、神经系统变性疾病、肿瘤、糖尿病和肝炎、胃炎、病毒感染等。近年对GRP78的功能和调节机制有了更深入的了解,证实了检测GRP78的表达情况可敏感反映细胞的受损情况。目前GRP78已被众多学者作为一项重要指标广泛应用于重要组织器官损伤的基础研究中。视网膜代谢旺盛,对缺血、缺氧等刺激很敏感,HSP家族在视网膜细胞中的作用已被广泛研究[8]。Barber等[9]发现,热诱导大鼠视网膜细胞高表达HSP70能抵抗强光导致的视网膜损伤;Bailey等[10]的研究也证明,高表达HSPs的RPE细胞对高浓度H2O2损伤具有抵抗性;Surgucheva等[11]介绍了HSP70在视网膜退行性病变如老年性黄斑病变和视网膜葡萄膜炎中的作用。而作为HSP家族中重要的成员,GRP78在视网膜病变发病中的作用目前少有报道。为深入探讨视网膜缺氧、氧化应激与内质网应激之间的关系,阐明GRP78在视网膜损伤发生发展中的变化规律,及为寻找视网膜损伤敏感特异的生物标志物奠定基础,我们开展了本实验,分析缺氧、氧化应激对RPE细胞GRP78表达的影响。
RPE细胞是视网膜屏障的一部分,参与了脉络膜毛细血管与视网膜感光细胞之间的物质转运,具有重要的生物学及解剖学功能。RPE细胞的异常病理变化在多种视网膜疾病的发生发展过程中占重要地位,所以探讨RPE细胞在缺氧、氧化应激等病理情况下的异常生物学行为可能会为多种疾病的发病机制、预防和治疗奠定理论基础[11-12]。本实验体外培养了人RPE细胞株D407,分别观察缺氧、氧化应激对RPE细胞增殖活力的影响,并研究应激状况下RPE细胞GRP78表达的变化。我们采用化学缺氧方法,以CoCl2成功模拟细胞缺氧环境,同时以H2O2诱导建立体外RPE细胞氧化应激模型,方法简便,条件易控制。同时采用了近年来应用较为广泛的MTT比色法检测细胞活力。实验结果表明,随着细胞培养液中CoCl2和H2O2浓度的增加,体外培养的人RPE细胞在酶标仪490 nm所测定的吸光度值逐渐降低,提示一定程度的缺氧、氧化应激可抑制RPE细胞生长,与相关报道结果一致[13]。我们又通过免疫细胞化学方法观察RPE细胞中GRP78的表达情况。根据He等[14]的研究,胎儿视网膜组织中无GRP78表达,而成人视网膜组织中GRP78中等量表达;我们的实验结果显示,正常体外培养的人RPE细胞中GRP78少量表达。He等[14]的实验通过叔丁基氢过氧化物(tBH)诱导人RPE细胞氧化应激模型,证实了tBH 可诱导GRP的表达显著增高;我们观察固定浓度的CoCl2和H2O2作用于RPE细胞不同时间后,GRP78表达的改变,结果表明,GRP78的表达均呈先升高后下降的趋势,证实了CoCl2、H2O2均可作为应激原刺激RPE细胞中GRP78的高表达。分析其作用机制可能为 GRP78的表达量显著增高,一方面能够识别变性蛋白,协助它们进行重新折叠、装配和跨膜转运;另一方面将无法恢复的蛋白质转移给蛋白降解系统,从而避免细胞进一步受到伤害,此机制提高了细胞在应激情况下的生存能力和促进应激后细胞康复[15-16]。随着应激的加强,GRP78的表达又出现下降,原因可能是长期过强的应激使内质网功能紊乱,GRP78合成受阻,细胞启动内质网相关的凋亡程序,RPE细胞凋亡增加。我们的研究结果表明,短时应激可通过促进GRP78表达增加来保护细胞,但这种缓冲作用是有一定限度的,长期严重的损害使GRP78的合成减少,细胞将启动凋亡程序,使细胞死亡。
综上,GRP78可以作为RPE细胞缺氧、氧化应激的生化标志物,GRP78的表达变化与细胞应激状态有一定依赖关系。对GRP78在视网膜细胞损伤中作用的研究可为多种玻璃体视网膜疾病的发病机制和治疗方法提供新的思路。
1 张莹,孙黎光.GRP78的研究进展[J].国外医学生理、病理科学与临床分册,2005,25(3):251-253.
2 Wang B,Zou Y,Yuan ZL,Xiao JG.Genistein suppressed upregulation of vascular endothelial growth factor expression by cobalt chloride and hypoxia in rabbit retinal pigment epithelium cells[J].JOculPharmacolTher,2003,19(5):457-464.
3 Vadlapatla RK,Vadlapatla RK,Vadlapudi AD,Ponnaluri VK,Pal D,Mukherji M,etal.Molecular expression and functional activity of efflux and influx transporters in hypoxia induced retinal pigment epithelial cells[J].IntJPharm,2013,454(1):444-452.
4 Li GY,Fan B,Zheng YC.Calcium overload is a critical step in programmed necrosis of ARPE-19 cells induced by high-concentration H2O2[J].BiomedEnvironSci,2010,23(5):371-377.
5 Kim MH,Chung J,Yang JW,Chung SM,Kwag NH,Yoo JS.Hydrogen peroxide-induced cell death in a human retinal pigment epithelial cell line,ARPE-19[J].KoreanJOphthalmol,2003,17(1):19-28.
6 Ni M,Zhang Y,Lee AS.Beyond the endoplasmic reticulum:atypical GRP78 in cell viability,signalling and therapeutic targeting[J].BiochemJ,2011,434(2):181-188.
7 Pfaffenbach KT,Lee AS.The critical role of GRP78 in physiologic and pathologic stress[J].CurrOpinCellBiol,2011,23(2):150-156.
8 张士胜.热休克蛋白与视网膜[J].国外医学眼科学分册,2002,26(2):84-88.
9 Barber MF,Tytell M,Grower DJ,Welch WJ.Hyperthemia protects against light damage in the rat retina[J].Science,1988,241(4):1817-1820.
10 Bailey TA,Kanugan N,Romero IA,Greenwood J,Luthert PJ,Cheetham ME.Oxidative stress affects the junctional integrity of retinal pigment epithelial cells[J].InvestOphthalmolVisSci,2004,45(2):675-684.
11 Surgucheva I,Ninkina N.Protein aggregation in retinal cells and approaches to cell protection[J].CellMolNeurobiol,2005,25(6):1051-1066.
12 Decanini A,Nordgaard CL,Feng X,Ferrington DA,Olsen TW.Changes in select redox proteins of the retinal pigment epithelium in age-related macular degeneration[J].AmJOphthalmol,2007,143(4):607-615.
13 郝晓凤,惠延年,王雨生.Racl在缺氧条件下培养的人视网膜色素上皮细胞的表达[J].眼科新进展,2007,27(5):333-336.
14 He S,Yaung J,Kim YH,Barron E,Ryan SJ,Hinton DR.Endoplasmic reticulum stress induced by oxidative stress in retinal pigment epithelial cells[J].GraefesArchClinExpOphthalmol,2008,246(5):677-683.
15 Tytell M,Hooper PL.Heat shock proteins:new keys to the development of cytoprotective therapies[J].ExpertOpinTherTargets,2001,5(2):267-287.
16 Yao J,Bi HE,Sheng Y,Cheng LB,Wendu RL,Wang CH,etal.Ultraviolet(UV) and hydrogen peroxide activate ceramide-ER stress-AMPK signaling axis to promote retinal pigment epithelium(RPE) cell apoptosis[J].IntJMolSci,2013,14(5):10355-10368.
