黄烷酮的合成研究进展*
2014-06-23杨柳阳朱观明
杨柳阳,朱观明
(浙江工业大学药学院,浙江 杭州 310014)
·综合评述·
黄烷酮的合成研究进展*
杨柳阳,朱观明
(浙江工业大学药学院,浙江 杭州 310014)
黄烷酮是含有二氢色原酮骨架结构的黄酮类化合物。本文梳理了合成黄烷酮的文献,总结了其合成方法,按原料结构特征分类论述其合成方法:即从黄烷酮衍生物经官能团变换合成黄烷酮;查耳酮经氧-Michael加成合成黄烷酮;非查耳酮结构构建合成黄烷酮。重点论述了第二类合成方法。
82篇。
黄烷酮;4-二氢黄烷酮;关环;氧-Michael加成;合成;综述
黄烷酮广泛存在于水果和蔬菜等植物中,含量极少,不能满足社会需求。人工合成黄烷酮并对其进行合成方法研究尤为重要。
作为经典合成方法中的重要反应,氧-Michael加成在合成方面的应用已经有综述报道,而对于黄烷酮合成方法的综述却甚少[1-3]。2011年谢晶晶[4]等按照不同的反应介质分类论述了合成黄烷酮的最新研究进展。但随着新技术引入以及构建手性中心新方法的研究和开发,有必要梳理这类化合物的最新研究进展。
本文从合成黄烷酮的原料入手,按结构特征分类简要介绍了黄烷酮的合成方法:(1)从黄烷酮衍生物经过官能团变换合成黄烷酮;(2)查耳酮经过氧-Michael加成合成黄烷酮;(3)非查耳酮结构构建合成黄烷酮。重点对第二类合成方法进行综述。
1 从黄烷酮衍生物经官能团变换合成黄烷酮
从黄烷酮衍生物经过官能团变换合成黄烷酮方法的一个明显特点是其原料具有2-芳基二氢色原酮骨架,在一定条件下发生官能团的变换从而合成黄烷酮。该方法最早是由Berge Diwakar等[5]于1980年报道,即黄烷酮和水合肼形成的腙在二氧化硒存在下被氧化得黄烷酮。之后Shivhara A等[6]报道黄烷酮和芳基甲酰肼的腙在四醋酸铅的作用下被氧化得黄烷酮。随后类似的合成方法被陆续报道,如黄烷醇在氧化条件下被氧化为黄烷酮[7];黄烷酮肟在高碘试剂作用下转变为黄烷酮[8](Scheme 1)等。
除了在氧化条件下实现官能团的变换外,在还原条件下也能实现黄酮转化成黄烷酮[9],收率收率32%(Scheme 2)。
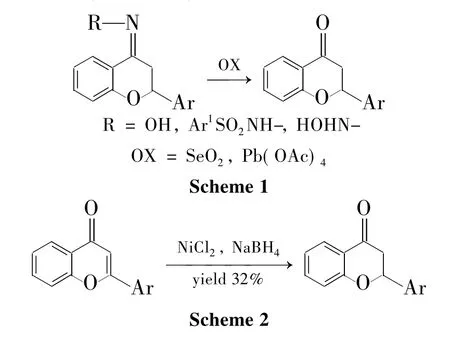
2 查耳酮经氧-M ichael加成合成黄烷酮
条件下黄烷酮是作为副产物存在的(Scheme 3)。此外,尽管有使用光化学[13]和电化学[14]的方法合成黄烷酮的文献报道,但是也没有得到更多的优化和扩展。
醛和苯乙酮的衍生物发生Claisen-Schmidt反应是合成查耳酮的经典方法,已有文献对该方法合成查耳酮进行详尽论述。也有用其他原料合成查耳酮的方法,如Park Ji Yeon等[15]在Lewis酸Me3SiSO3CF3存在下催化邻羟基苯炔对芳基甲醛加成,在水参与下制得烯醇;烯醇再异构化-脱水合成查耳酮(Scheme 4)。
除此之外,过渡金属也可以参与合成查耳酮,比如铑[16],铜和钯[17](Scheme 5);羧酸对芳基炔中间体的加成[18];用载体活化苯乙酮衍生物再和醛反应[19]等也可合成查耳酮(Scheme 6)。
纵观以上文献报道的方法,酸或碱催化邻羟基查耳酮合成黄烷酮的方法是报道最多也是发展比较充分的(Scheme 7)。
2.1 酸性条件下从查耳酮合成黄烷酮
在邻羟基查耳酮合成黄烷酮的方法中,Michael加成受体的亲电性或亲核试剂的亲核性增强均有利于氧-Michael加成反应的进行。Lewis酸或质子酸可以和羰基氧结合增加羰基碳和β-烯碳的缺电性,因此可以用来催化黄烷酮的合成。
黄烷酮衍生物经官能团变换合成黄烷酮的方法并没有实际合成意义。相比较而言,查耳酮经过氧-Michael加成是构建黄烷酮骨架的最经典方法。虽然邻羟基查耳酮在DDQ[10]、过氧化物[11]和醋酸汞[12]等氧化条件下也可以转变为黄烷酮,但这些方法伴随着多种杂质的生成,甚至在一些
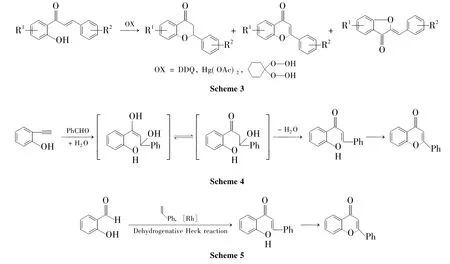
自20世纪80年代以来,已经报道过很多用质子酸催化该反应的方法。1983年,Bradley Jeremy P等[20]报道使用三氟乙酸催化邻羟基查耳酮转变为黄烷酮。之后Sagrera G J等[21]将微波技术引入到该催化体系中,使反应时间缩短至9 min,且收率较高(80%)。也有研究者使用醋酸作为质子酸来催化合成黄烷酮,如Shan Gang等[22]在2012年用该方法催化合成黄烷酮,回流反应144 h的收率为80%。需要说明的是,尽管醋酸体系可以催化这个反应,但由于反应速率慢,需要较长的反应时间才能使反应完全。有趣的是,Nie Aihua等[23]鉴于反应时间的不足,曾在约1.72 MPa条件下回流反应1 h,收率就达到80%。
盐酸[24]和磷酸[25]等质子酸也可用于催化这个反应。与质子酸相比,Lewis酸不会对金属类反应器有腐蚀性,因而开发适当的Lewis酸[26]催化黄烷酮和邻羟基查耳酮的异构化也有报道,如Du Zhi Yun等[27]用氯化铁为催化剂催化黄烷酮的合成。值得注意的是,在催化剂改造方面,由于新型分子筛的合成与应用以及分子筛的修饰理念和负载技术引入,这个领域的新合成方法层出不穷。
主催化剂,助催化剂和载体是组成催化剂的三部分[28]。在已报道的文献方法中,酸催化位点和碱催化位点都是作为主催化剂而存在的。硅胶既可以作载体又可以作主催化剂,但更多是用作载体,如Ahmed Naseem等[29]将Lewis酸氯化铋负载在硅胶上,以水为溶剂,获得了高达93%的收率。杂多酸本身就是一个用于多种有机转化的催化剂,有人将Wells-Dawson杂多酸[30]和十二磷钼酸[31]等负载在硅胶上得到了在分散度和可回收性更好的催化剂,并且把这些催化剂用于催化邻羟基查耳酮和黄烷酮的异构,均获得很好的收率。
除了杂多酸和Lewis酸作为主催化剂,硅胶作为载体制备的新催化剂,质子酸也被作为主催化剂负载在各种载体上。Kumar K Hemanth等[32]将硫酸氢钠负载在硅胶上制备了负载型催化剂,并将微波技术引入到这个反应中。
对于一些具有优良孔道、晶穴和空穴的分子筛,用化学修饰的办法可以大大增加分子筛的催化活性,如Saravanamurugan Shuhmgavel等以新型的分子筛SBA-15作为载体,把各种酸性基团负载这类分子筛上,比如硫酸基[33],1-(3-磺酸丙基)硅三醇[34]等,从而避免了SBA-15催化位点活性弱的不足同时保留了这类载体优良的晶孔,空穴和孔道性能,遗憾的是,这种方法并没有获得很好的转化率。
除了利用化学方法修饰载体获得良好催化剂外,化学家们也希望用共聚物作为模板合成高催化性能的催化剂,如Saravanamurugan S等[35]合成的Mg-SZM-5;Shetti Vasudev N等[36]用制得的具有介孔/微孔分层结构的分子筛;Zhu Yan等[37]用十六烷基三甲基溴化铵模板也制得具有分层介孔结构的分子筛;Sinhamahapatra Apurba等[38]以介孔磷酸锆盐催化这个异构化反应;Kim Kyougsoo等[39]研究了具有众多酸位点的分子筛并且重点分析了在这些纳米晶分子筛里面酸位点的空间分布、强度和脱铝行为。化学家们把以上合成的这些分子筛材料应用于邻羟基查耳酮和黄烷酮的异构化反应中并且实验结果表明这些催化剂具有一定的催化效果。
有文献报道[40]在弱碱条件下邻羟基查耳酮和黄烷酮的异构化反应中平衡将偏向黄烷酮,而不管是在强碱性还是酸性,在这个异构化反应平衡中,邻羟基查耳酮所占的比例将更大。因此除了酸性催化异构化反应的方法之外,也有在碱性条件下催化合成的方法。
2.2 碱性条件下从查耳酮合成黄烷酮
无机碱很早就被应用于合成黄烷酮中,如Patonay Tamas等[41]用无水碳酸钾为碱合成了黄烷酮,收率15%;Mondal Rina等[42]将微波技术引入该方法中,用碳酸铯代替无水碳酸钾也合成了黄烷酮;Fraley Mark E等[43]以氟化钾为催化剂催化合成黄烷酮;Macquarrie D J等[44]以天然磷酸盐作为载体,氟化钾为主催化剂制得新型的碱性催化剂,并将其用于催化芳香醛和邻羟基苯乙酮一锅法合成黄烷酮。该方法虽然转化率很高,但对黄烷酮的选择性不高;四硼酸钠[45]和氢氧化钾也用于这个反应,但氢氧化钾的加入,即使加入了冠醚也要反应3 d[46]。
除无机物之外,有机碱也可用于这个反应中。如醋酸钠[47],吡啶[48]和三乙胺以及DBU[49]等。Aitamamgetov A等[50]报道使用三乙胺催化异构化反应,产物收率为48%。醋酸钠碱性比较弱,化学家们经常用它来催化异构化反应,虽然获得了89%的收率,但异构化慢,时间长依然是这种合成方法的不足之处。在使用醋酸钠催化这个异构化反应中,值得注意的问题是,由于大量存在的醋酸钠晶体以及溶解性比较弱的查耳酮导致反应常常是在非均相状态下进行的,而该反应搅拌不均匀,反应通常不够彻底。在所有有机碱中,吡啶由于具有对极性有机化合物良好的溶解性而在这个转化反应具有极好的应用。自2002年起,有多人报道了在含有吡啶的体系中催化这个反应的方法。后来,为了进一步改进该反应以获得催化剂更强的催化活性和催化剂的可回收利用,Zheng Xu Xu等[51]将吡啶植入聚乙烯的骨架上并且用于催化这个反应,使催化剂的活性进一步加强,在甲醇溶剂中搅拌1 h就即可获得97%的收率。使用这个体系的方法之后也有报道[52]。此外,DBU作为很好的有机碱也被用于催化这个转化。
少数固体碱性催化剂通过对晶孔、空穴和孔道的尺寸和大小以及分布进行调整从而获得高活性的催化剂,如Liu Fu Jian等[53]使用设计好的离子双亲性共聚物作为介孔尺寸模板,制备了与传统ZSM-5和介孔取向杂乱的ZSM-5不同的ZSM-5,这种新型的沸石具有β-轴向分布的空穴,和普通ZSM-5相比,这类催化剂获得了更高的收率。
同时也有多人把碱性基团负载到分子筛上从而获得活性更好的碱性催化剂。和酸性非均相固体催化剂一样,人们也利用负载技术制备得到碱性催化剂并且用于这个化学转化。经常用来作为载体的无机材料是硅胶和SBA-15。SBA-15本身的化学反应活性不高,但是通过化学改性的方法,这类分子筛在分离,催化以及纳米组装方面表现出越来越大的应用价值。Wang Xue Guang等[54]合成了具有高度有序的大孔SBA-15,并将其用氨丙基基团对硅进行官能化,他们把这种催化剂用于催化合成黄烷酮,实验表明这种催化剂在反应转化率和选择性方面都很优秀。之后人们[55]合成了以这类分子筛为载体胺类官能团修饰的催化剂,并且被用于黄烷酮的合成,比如甲基氨丙基官能团化的SBA-15[56],氨基官能团化的短通道SBA-15[57],同时微波[58]等新技术也引入到这个反应中。和SBA-15一样,硅胶[59]和MCM-41介孔分子筛[60]也是经常被用来当做载体的无机物。另外,氧化镁除了本身具有碱性被用做催化剂之外,也可以用作胆碱氢氧化物的载体[61]。
除了碱性官能团负载方法获得碱性催化剂,也有人通过改变阳离子种类获得新型的催化剂,如Yamashior Takashi等[62]评估了碱金属离子交换的β-沸石的碱性并且用于催化邻羟基苯乙酮和芳基醛一锅法合成黄烷酮。尽管生成黄烷酮的选择性不好,但是随着催化剂碱性的升高,选择性也会升高,这为开发新的催化剂指明了方向。继Drexler Michaele T等[63]报道溶剂对氧化镁在黄烷酮合成反应中催化作用的影响之后,Liu Zheng等[64]把各种阴离子植入到氧化镁上从而获得了含有不同碱度的固体并且用来催化一锅法合成黄烷酮,发现中等碱性位点的碱性越弱,Claisen-Schmidt反应的速率降低,而这会影响合成终产物黄烷酮。不过这些修饰的氧化镁固体对反应黄烷酮的选择性没有太大影响。后来,研究者[65]将Li元素掺杂到这类催化剂上,并且研究了Li掺入量对催化剂碱性位点和催化活性的影响。他们发现掺入量0.1 wt%是影响催化表面积和氧化镁晶体尺寸的临界值。除了这类修饰,Saravanamurugan S等[66]以氧化锌为载体将氧化镁负载在上面并且得到对黄烷酮选择性更好的催化剂。
2.3 有机盐条件下从查耳酮合成黄烷酮
因为这些化合物在反应体系中都是以有机盐状态存在的,在这类方法中我们将离子液体、氨基酸类和季铵盐类都归为有机盐类化合物。
氨基酸被用于催化邻羟基查耳酮转变为黄烷酮,如Tanaka Koichi等[67]用L-脯氨酸在碱性条件下催化合成黄烷酮。在该方法中,原料于室温反应1 h就可以获得黄烷酮,收率90%以上,而且对黄烷酮的选择性也非常好。其后,Chandrasekhar S等[68]也报道了用L-脯氨酸催化合成黄烷酮的方法。值得注意的是,该方法尽管可以更多地得到黄烷酮,但是黄烷酮和邻羟基查耳酮的总收率最高为73%。
除了氨基酸外,也有研究者将离子液体[69]作为介质应用于这个反应体系。该方法尽管有很好的转化率,但是对黄烷酮的选择性却很差,最高只有25%的收率。后来有人[70]将微波技术引入到该方法中,不仅大大缩短了反应时间,而且也提高了对黄烷酮的选择性,不过收率仍然不超过60%。不久,研磨技术和离子液体等新技术被Ahmed Shaikh K等[71]结合在一起用于这个反应。实验结果表明,反应时间和选择性都得到了优化。除了咪唑类离子液体之外,吡啶盐类离子液体也用于这个反应,如郑旭煦等[72]以邻羟基苯乙酮和不同的芳基醛反应得到的邻羟基查耳酮在正丁基吡啶盐的作用下合成了一系列的黄烷酮,收率在20%~80%。基于氨基酸和离子液体在有机转化方面的良好催化作用,Morimoto Naoki等[73]制备了离子型氨基酸从而将氨基酸和离子液体的功能融合在氨基酸类的离子液体中,并且用于催化邻羟基查耳酮的环合反应。遗憾的是,尽管能够得到单一的黄烷酮,但收率只有52%。
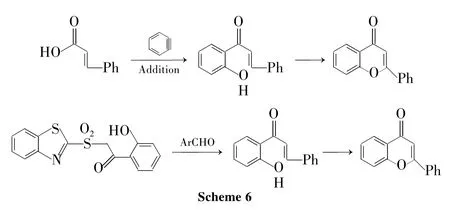
构建手性黄烷酮是化学家们梦寐以求的,遗憾的是很多方法均不能有效地手性合成黄烷酮。到目前为止,这个方面成功的实例非常少。从查耳酮经过氧-Michael加成合成手性黄烷酮是引入手性中心的一个思路。但是邻羟基查耳酮在一定条件下直接进行氧-Michael加成对映选择性地合成黄烷酮的方法由于ee值很低而需要开发更加有效的合成。所以化学家对查耳酮进行了一定修饰。陈骏等[3]在2010年发表的综述论述了2010年之前人们在手性合成黄烷酮的探索。手性合成黄烷酮首先是由Biddle Margare M等完成的,他们[74]首先合成查耳酮的类似物α-烷氧甲酰基化的查耳酮,然后以此作为底物在硫脲催化剂催化下前所未有地得到了最高94%的ee值。之后又有人用镍和N,N'-二氧化合物配体的复合物为催化剂催化这个反应,不过催化效果不好,收率不高[75]。手性合成的方法在2011年再次获得突破,Wang Hai Feng等[76]用双官能化的金鸡纳碱完美地催化了这个反应,收率最高达到98%,ee值为93%(Scheme 8)。
3 从非查耳酮结构合成黄烷酮
基于查耳酮或者其类似物来优化合成黄烷酮方法的同时,化学家们也在寻找着不经过二氢色原酮骨架合成黄烷酮的方法并且在这个方面获得了进展。Sbramanian R Sankara等[77]首次报道了不经过色原酮骨架合成黄烷酮的方法。他们在Lewis酸三氟乙酸汞的作用下活化了碳碳三键,形成了汞杂环丙烯中间体,该中间体作为亲电试剂和芳环发生亲电取代反应得含有苯并吡喃骨架的有机汞中间体,有机汞脱去三氟乙酸汞后还原/水解得黄烷酮。该合成方法避免了查耳酮的氧-Michael加成反应不彻底的不足,不过由于使用了汞而对环境不好(Scheme 9)。
Lee Jae Ln等[78]基于β-羟基-β-苯基邻羟基苯乙酮衍生物的成醚反应方法研究了合成黄烷酮。其中以Mitsunobu反应合成醚的方法能够在比较温和的条件下得到黄烷酮类化合物。这种方法所使用的邻羟基苯乙酮衍生物在一定条件下脱水之后就是查耳酮,而由于这种方法严格控制了温度,使得中间体可以停留在β-羟基酮的阶段并且这个羟基酮经过Mitsunobu反应环合成醚键。该方法产物收率在50%~70%,可能和有一部分β-羟基酮转化为α,β-不饱和羰基化合物有关。尽管在之后的研究中这个方法的收率提高了[79],但是低温(-78℃)给操作带来麻烦(Scheme 10)。
除了上面的中间体成醚合成黄烷酮之外,Huang Shao Hsien等[80]利用1,4-加成反应合成了黄烷酮类化合物。使用苯并吡喃-4-酮为原料,并用钯(II)/2,2'-二吡啶体系催化苯硼酸对苯并吡喃-4-酮1,4-加成从而制得目标产物。尽管会有黄酮副产物产生,但收率达80%。Kim Dong Hee等[81]也报道了相似的方法。这种方法具有很大的优势,因为可以通过改变催化剂配体的手性来获得手性合成黄烷酮的方法(Scheme 11)。
经由金属卡宾的催化反应十分丰富,包括环丙烷化,X-H插入等[82]。Rosales Antonio等将金属卡宾的催化反应应用到黄烷酮的合成上。α-重氮羧酸酯在铑(II)的催化下发生[1,6]C-H插入反应并且得到黄烷,黄烷再经过氧化-脱羧得到目标产物(Scheme 12)。
4 结论与展望
作为一类具有良好生物活性的骨架分子,黄烷酮的合成将受到越来越大的关注,纵览这类化合物的合成方法,尽管收率得到了比较好的提高,但是未来这类化合物合成方法的发展中,如何通过化学方法手性合成这类化合物将是摆在每个化学家面前的新挑战。同时,随着C-C和C-X键构建方法的迅猛发展,不经过邻羟基查耳酮合成黄烷酮已经成为黄烷酮合成的一个新思路,并且还将在不对称手性合成黄烷酮方面发挥其威力。
[1]胡利红,覃章兰,李超,等.黄烷酮化合物的合成研究进展[J].化学通报,2003,(1):12-32.
[2]姜晓华,丁宇,杨光富,等.黄烷酮类植物抗毒素的研究简介[J].华中师范大学学报(自然科学版),2000,34(4):427-432.
[3]陈骏,廖建.光学活性黄烷酮类化合物的不对称合成研究进展[J].合成化学,2010,18(5):529-532.
[4]谢晶晶,郑旭煦,殷钟意,等.在不同介质中合成黄烷酮的最新进展[J].重庆工商大学学报(自然科学版),2011,28(2):212-216.
[5]Berge D.Oxidation of flavanone hydra zoneswith selenium dioxide[J].Chemistry&Industry(London,United Kingdom),1980,(19):787-788.
[6]Shivhare A,Kale A V.Lead tetraacetate oxidation of N-(dichlorosalicyloyl)flavanone hy drazones[J].Chemistry&Industry(London,United Kingdom),1984,(17):633-634.
[7]Singh O V.A convenientmethod for the synthesis of flavanones by the selective oxidation of flavan-4-ols with hypervalent iodine[J].Organic Preparations and Procedures International,1993,25(6):693-695.
[8]Prakash O,Pahuja S,Sawhney S,et al.Oxidative cleavage of 4-oximinoflavans using iodobenzene diacetate[J].Indian Journal of Chemistry,Section B:Organic Chemistry Including Medicinal Chemistry,1989,28 (1):73-74.
[9]Khurana JM,Sharma P.Chemoselective reduction of α,β-unsaturated aldehydes,ketones,carboxylic acids,and esters with nickel boride in methanol-water[J].Bulletin of the Chemical Society of Japan,2004,77 (3):549-552.
[10]Lmafuku K,Honda M,Mcomie JF,et al.Cyclodehydrogenation of 2'-hydroxychalcones with DDQ:A simple route for flavones and aurones[J].Synthesis,1987,(2):199-201.
[11]Jakka K,Liu JY,Zhao C G,et al.Facile epoxidation ofα,β-unsaturated ketones with cyclohexylidenebishydroperoxide[J].Tetrahedron Letters,2007,48(8):1395-1398.
[12]SekizakiH.Synthesis of2-benzylidene-3(2H)-benzofuran-3-ones(aurones)by oxidation of2'-hydroxychalcones with mercury(II)acetate[J].Bulletin of the Chemical Society of Japan,1988,61(4):1407-1409.
[13]Maki Y.Photooxidative cyclization of 2'-hydroxychalcones leading to flavones induced by heterocycle N-oxides:High efficiency of pyrimido[5,4-g]pteridine N-oxide for the photochemical dehydrogenation[J].Tetrahedron,1988,44(11):3187-3194.
[14]Saniĉaninĉ,TabakoviĉI.Electrochemical transformations of 2'-hydroxychalcones into flavanoids[J].Tetrahedron Letters,1986,27(3):407-408.
[15]Park JY,Ullapu PR,Choo H,et al.TMSOTf-promoted addition of alkynes to aldehydes:A novel synthesis of chroman-4-ones[J].European Journal of Organic Chemistry,2008,(32):5461-5469.
[16]Shi Z,Schröder N,Glorius F,etal.Rhodium(III)-catalyzed dehydrogenative heck reaction of salicylaldehydes[J].Angewandte Chemie International Edition,2012,51(32):8092-8096.
[17]De M,Majumdar D P,Kundu N G,et al.A concerted synthesis of hydroxychalcones,flavanones,and benzo[b]furans through palladium-catalyzed reactions[J].Journal of the Indian Chemical Society,1999,77 (11-12):665-674.
[18]Dubrovskiy A V,Larock R C.Intermolecular C-O addition of carboxylic acids to arynes:Synthesis of ohydroxyaryl ketones,xanthones,4-chromanones,and flavones[J].Tetrahedron,2013,69(13):2789-2798.
[19]Kumar A,Sharma S,TripathiV D,etal.Synthesis of chalcones and flavanones using julia-kocienskiolefination[J].Tetrahedron,2010,66(48):9445-9449.
[20]Bradley JP,Jarvis TC,Johnson CD,etal.Stereoelectronic effects in ring closure reactions[J].Tetrahedron Letters,1983,24(28):2851-2854.
[21]Sagrera G J,Seoane G A.Microwave accelerated solvent-free synthesis of flavanones[J].Journal of the Brazilian Chemical Society,2005,16(4):851-856.
[22]Shan G,Yang X L,Ma L L,etal.Pd-catalyzed CH oxygenation with TFA/TFAA:Expedient access to oxygen-containing heterocycles and late-stage drug modification[J].Angewandte Chemie,2012,124 (52):13247-13251.
[23]Nie A H,Gu W,Wang Y J,etal.Synthesis and initially anticancer activity evaluation of novel 2H-1-benzopyran derivatives[J].Chinese Journal of Medicinal Chemistry,2008,18(2):81.
[24]Ankner T,Fridén-Saxin M,Pemberton N,et al.KHMDS enhanced sm I2-mediated reformatsky typeα-cyanation[J].Organic Letters,2010,12(10):2210-2213.
[25]Chen D U,Kuo P Y,Yang D Y,et al.Design and synthesis of novel diphenacoum-derived,conformation-restricted vitamin K2,3-epoxide reductase inhibitors[J].Bioorganic&Medicinal Chemistry Letters,2005,15(10):2665-2668.
[26]Rao V K,Rao M S,Kumar A,etal.Ytterbium(III) triflate:An efficient and simple catalyst for isomerization of 2'-hydroxychalcone and 2'-aminochalcones in ionic liquid[J].Journal of Heterocyclic Chemistry,2011,48(6):1356.
[27]Du Z Y,Ng H F,Zhang K,et al.Ionic liquid mediated Cu-catalyzed cascade oxa-michael-oxidation:Efficient synthesis of flavones undermild reaction conditions[J].Organic&Biomolecular Chemistry,2011,9(20):6930-6933.
[28]王尚弟,孙俊全,徐佩若,等.催化剂工程导论[M].北京:化学工业出版社,2001.
[29]Ahmed N,AnsariW H.An improved procedure for the isomerisation of 2'-hydroxy-substituted chalcones to flavanones using silica supported-BiCl3under dry conditions[J].Journal of Chemical Research,Synopses,2003,(9):572-573.
[30]Bennardi D O,Romanelli G P,Sathicq A G,et al.Wells-dawson heteropolyacid as reusable catalyst for sustainable synthesis of flavones[J].Applied Catalysis A:General,2011,404(1):68-73.
[31]Sakirolla R,YaeghoobiM,Rahman N A,etal.Synthesis of flavanones,azaflavanones,and thioflavanones catalyzed by PMA-SiO2as a mild,efficient and reusable catalyst[J].Monatsheftefür Chemie,2012,143 (5):797-800.
[32]Kumar K H,Perumal P.A simple and facile solventless procedure for the cyclization of 2'-amino-and 2'-hydroxy-chalcones using silica-supported sodium hydrogen sulphate as heterogenous catalyst[J].Canadian Journal of Chemistry,2006,84(8):1079-1083.
[33]Saravanamurugan S.Liquid-phase reaction of 2'-hy droxyacetophenone and benzaldehyde over SO3HSBA-15 catalysts:Influence ofmicrowave and thermaleffects[J].Microporous and Mesoporous Materials,2008,112(1-3):97-107.
[34]Park SE,Prasetyanto E A.Organocatalytic application of direct organo-functionalized mesoporous catalysts prepared bymicrowave[J].Topics in Catalysis,2009,52(1-2):91-100.
[35]Saravanamurugan S,Palanichamy M,Arabindoo B,et al.Liquid phase reaction of 2'-hydroxyacetophenone and benzaldehyde over ZSM-5 catalysts[J].Journal ofMolecular Catalysis A:Chemical,2004,218 (1):101-106.
[36]Shetti V N,Kim J,Srivastava R,et al.Assessment of themesopore wall catalytic activities of MFIzeolite with mesoporous/microporous hierarchical structures[J].Journal of Catalysis,2008,254(2):296-303.
[37]Zhu Y,Hua Z,Zhou J,et al.Hierarchical mesoporous zeolites:Direct self-assembly synthesis in a conventional surfactant solution by kinetic control over the zeolite seed formation[J].Chemistry-A European Journal,2011,17(51):14618-14627.
[38]Sinhamahapatra A,Sutradhar N,Roy B,et al.Mesoporous zirconium phosphate catalyzed reactions: Synthesis of industrially important chemicals in solvent-free conditions[J].Applied Catalysis A:General,2010,385(1):22-30.
[39]Kim K,Ryoo R,Jang H D,et al.Spatial distribution,strength and dealumination behavior of acid sites in nanocrystalline MFI zolites and their catalytic consequences[J].Journal of Catalysis,2012,288:115-123.
[40]Furlong JJ,Nudelman N S.Mechanism of cyclization of substituted 2'-hydroxychalcones to flavanones[J].JChem Soc,Perkin Trans 2,1985,(5):633-639.
[41]Patonay T,Patonay Péli E,Litkei G,et al.Flavonoids,40 synthesis of3-alkyl and arylthioflavanones and their transformations into sulfur-containing flavonoids[J].Tetrahedron,1987,43(8):1827-1834.
[42]Mondal R,Gupta A D,Mallik A K,et al.Synthesis of flavanones by use of anhydrous potassium carbonate as an inexpensive,safe and efficient basic catalyst[J].Tetrahedron Letters,2011,52(39):5020-5024.
[43]Fraley M E.Preparation of 1,2,3,4-tetrahydro-6-(4-pyridylaminomethyl)-benzopyrans and naphthalenes as thrombin inhibitors[P].US 5 792 761,1998.
[44]Macquarrie D,Nazih R,Sebti S,et al.KF/Natural phosphate as an efficient catalyst for synthesis of 2'-hydroxychalcones and flavanones[J].Green Chemistry,2002,4(1):56-59.
[45]Dillard LW.Inhibitors ofβ-secretase[P].WO 2 010 021 680(A3),2010.
[46]Reddy N J.Synthesis of chalcones and flavanones in the absence ofmetal ion[J].Asian Journal of Chemistry,2007,19(4):2885-2890.
[47]SafaviM,Esmati N,Ardestani S K,et al.Halogenated flavanones as potential apoptosis-inducing agents:Synthesis and biologicalactivity evaluation[J].European Journal of Medicinal Chemistry,2012,58: 573-580.
[48]Kang SY,Baek J,Ko Y K,etal.Asymmetric preparation of new N,N-dialkyl-2-amino-1,1,2-triphenylethanol catalysts and a kinetic resolution in the addition of diethylzinc to flavene-3-carbaldehydes[J].Synlett,2013,24(5):630-634.
[49]Bhunia A,Patra A,Puranik V G,et al.NHC-catalyzed reaction of enalswith hydroxy chalcones:Diastereoselective synthesis of functionalized coumarins[J].Organic Letters,2013,15(7):1756-1759.
[50]Aitmambetov A,Kubzheterova A.An improved method for the synthesis of flavanones[J].Russian Journal of Bioorganic Chemistry,2002,28(2):165-166.
[51]Zheng X X.Method for preparation of flavanone-like compound[P].101 935 314,2011.
[52]Zheng X X,Xie JJ,Yin ZY,etal.A simplemethod of cyclization of the 2'-hydroxychalcone with polystyrene-pyridine resine undermild conditions[J].Advanced Materials Research,2011,295:1156-1159.
[53]Liu F,Willhammar T,Wang L,etal.ZSM-5 zeolite single crystals withβ-axis-aligned mesoporous channels as an efficient catalyst for conversion of bulky organic molecules[J].Journal of the American Chemical Society,2012,134(10):4557-4560.
[54]Wang X,Lin K S,Chan JC,et al.Preparation of ordered large pore SBA-15 silica functionalized with aminopropyl groups through one-pot synthesis[J].Chemical Communications,2004,(23):2762-2763.
[55]Saravanamurugan S,Prasetyanto E A,Park S E,et al.Short channeled amino functionalized SBA-15 catalysts for the liquid phase reaction between 2-hydroxyacetophenone and benzaldehyde[J].Studies in Surface Science and Catalysis,2008,174:1271-1274.
[56]Wang X G,Cheng S.Direct synthesis and catalytic reactivity of highly ordered large-poremethylaminopropylfunctionalized SBA-15 materials[J].Australian Journal of Chemistry,2005,58(7):507-510.
[57]Prasetyanto E A,Park SE.Synthesis of short-channeled amino-functionalized SBA-15 and its beneficial applications in base-catalyzed reactions[J].Applied Catalysis A:General,2008,350(2):244-251.
[58]Wang X G,Cheng S.Solvent-free synthesis of flavanones over aminopropyl-functionalized SBA-15[J].Catalysis Communications,2006,7(9):689-695.
[59]Cheng S,Wang X G,Chen SY,et al.Applications of amine-functionalized mesoporous silica in finechemical synthesis[J].Topics in Catalysis,2009,52 (6-7):681-687.
[60]RichardáKloetstra K,Bekkum H.Base and acid catalysis by the alkali-containing MCM-41 mesoporous molecular sieve[J].Journal of the Chemical Society,Chemical Communications,1995,(10):1005-1006.
[61]AbellóS,Medina F,Rodríguez X,et al.Supported choline hydroxide(ionic liquid)as heterogeneous catalyst for aldol condensation reactions[J].Chemical Communications,2004,(9):1096-1097.
[62]Yamashiro T,Narita K,Sato K,et al.Synthesis of chalcone and flavanone derivatives from condensation of 2'-hydroxyacetophenones and benzaldehyde over basicβ-zeolites[J].Journal of the Japan Petroleum Institute,2010,53(6):351-354.
[63]Drexler M T,AmiridisM D.The effectof solvents on the heterogeneous synthesis of flavanone over MgO[J].Journal of Catalysis,2003,214(1):136-145.
[64]Liu Z,Cortés Concepción J A,Mustian M,et al.Effect of basic properties of MgO on the heterogeneous synthesis of flavanone[J].Applied Catalysis A: General,2006,302(2):232-236.
[65]Cortes Concepcion JA,Patcas F,Amiridis M D,et al.Effectof Lion the catalytic activity ofMgO for the synthesis of flavanone[J].Applied Catalysis A:General,2010,386(1-2):1-8.
[66]Saravanamurugan S,Palanichamy M,Arabindoo B,et al.Solvent-free synthesis of chalcone and flavanone over zinc oxide supported metal oxide catalysts[J].Catalysis Communications,2005,6(6):399-403.
[67]Tanaka K,Sugino T.Efficient conversion of 2'-hydroxychalcones into flavanones and flavanols in a water suspension medium[J].Green Chemistry,2001,3(3):133-134.
[68]Chandrasekhar S,Vijeender K,Reddy K V,et al.New synthesis of flavanones catalyzed by L-proline[J].Tetrahedron Letters,2005,46(41):6991-6993.
[69]Formentín P,García H,Leyva A,etal.Assessment of the suitability of imidazolium ionic liquids as reactionmedium for base-catalysed reactions:Case of knoevenagel and claisen-schmidt reactions[J].Journal of Molecular Catalysis A:Chemical,2004,214(1): 137-142.
[70]Kumar D,Patel G,Kumar A,et al.Ionic liquid catalyzed expeditious synthesis of 2-aryl-2,3-dihydroquinolin-4(1H)-ones and 2-aryl-2,3-dihydro-4H-chromen-4-ones under microwave irradiation[J].Journal of Heterocyclic Chemistry,2009,46(4):791.
[71]Ahmed SK,Parveen A.A novel synthesis and antimicrobial activity of flavanone using environmental friendly catalyst H[bimBF4][J].Research Journal of Pharmaceutical,Biological and Chemical Sciences,2010,1(4):809-815.
[72]谢晶晶,郑旭煦,殷钟意,等.溴化正丁基吡啶增敏2'-羟基查耳酮的碱催化环化反应研究[J].化学研究与应用,2011,(2):199-203.
[73]Morimoto N,Takeuchi Y,Nishina Y,et al.Ionic amino acids:Application as organocatalysts in the azamichael reaction[J].Journal of Molecular Catalysis A:Chemical,2013,368-369:31-37.
[74]Biddle M M,Lin M,Scheidt K A,et al.Catalytic enantioselective synthesis of flavanones and chromanones[J].Journal of the American Chemical Society,2007,129(13):3830-3831.
[75]Wang L,Liu X,Dong Z,etal.Asymmetric intramolecular oxa-michael addition of activatedα,β-unsaturated ketones catalyzed by a chiral N,N'-dioxide nickel(II)complex:Highly enantioselective synthesis of flavanones[J].Angewandte Chemie,2008,120 (45):8798-8801.
[76]Wang H F,Xiao H,Wang X W,et al.Tandem intramolecular oxa-michael addition/decarboxylation reaction catalyzed by bifunctional cinchona alkaloids: Facile synthesis of chiral flavanone derivatives[J].Tetrahedron,2011,67(30):5389-5394.
[77]SankaraáSubramanian R.Mercury(II)trifluoroacetate-mediated transformation of 3-bromo-1-phenylprop-2-ynyl aryl ethers:A novel synthesis of flavanones[J].Journal of the Chemical Society,Chemical Communications,1990,(21):1469-1470.
[78]Lee J I,Jung M G,Jung H J,et al.A novel synthesis of flavanones from 2-hydroxybenzoic acids[J].Bull Korean Chem Soc,2007,28(5):859.
[79]Lee J I.Method for preparing flavanone derivatives by cyclodehydration[P].KR 2 009 051 366A,009.
[80]Huang SH,Wu TM,Tsai F Y,et al.pH-Dependent conjugate addition of arylboronic acids toα,β-unsaturated enones catalyzed by a reusable palladium (II)/cationic 2,2'-bipyridyl system in water under air[J].Applied Organometallic Chemistry,2010,24 (9):619-624.
[81]Kim D,Ham K,Hong S,et al.Synthetic approach to flavanones and flavones via ligand-free palladium (II)-catalyzed conjugate addition of arylboronic acids to chromones[J].Organic&Biomolecular Chemistry,2012,10(36):7305-7312.
[82]Ye T,McKervey M A.Organic synthesiswithα-diazo carbonyl compounds[J].Chemical Reviews,1994,94(4):1091-1160.
Research Progress in Synthesis of Flavanones
YANG Liu-yang,ZHU Guan-ming
(College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310014,China)
Flavanones existwith the structure of4-(2H)-chromanone and are kinds of flavonoids.In this review,the synthetic methods of flavanones are summarized based on the reported literatures according to the structure of starting materials,namely method via function group transformation from the flavanone derivatives,classical method from chalcones via oxa-Michael addition and method through the construction of other structure instead of chalcones.The second method were highlighted here.82 referenceswere cited.
flavanones;4-(2H)-chromanone;cyclization;oxa-Michael addition;synthesis;review
O625.42
A
1005-1511(2014)02-0272-09
2013-11-19;
2014-01-26
浙江省自然科学基金资助项目(Y4100558)
杨柳阳(1987-),男,汉族,浙江台州人,硕士研究生,主要从事天然产物合成的研究。
朱观明,E-mail:892534827@qq.com
