新型含氨基二硫代甲酸酯的2(5H)-呋喃酮类化合物的合成及其抗肿瘤活性*
2014-06-23李天才康蕾李学强高晓慧周学章
李天才,康蕾,李学强,高晓慧,周学章
(1.宁夏大学a.化学化工学院宁夏天然药物工程技术研究中心;b.西部特色生物资源保护
与利用教育部重点实验室,宁夏 银川 750021;2.宁夏工业职业学院化学工程系,宁夏 银川 750021)
·研究论文·
新型含氨基二硫代甲酸酯的2(5H)-呋喃酮类化合物的合成及其抗肿瘤活性*
李天才1a,康蕾2,李学强1a,高晓慧1a,周学章1b
(1.宁夏大学a.化学化工学院宁夏天然药物工程技术研究中心;b.西部特色生物资源保护
与利用教育部重点实验室,宁夏 银川 750021;2.宁夏工业职业学院化学工程系,宁夏 银川 750021)
以糠醛和醇[薄荷醇(3a),冰片(3d)和甲醇(3g)]为原料,经3步反应制得中间体5-取代基-3,4-二溴-2 (5H)-呋喃酮(5a,5d和5g);在无溶剂和无催化剂的条件下,5,仲胺和CS2通过“一锅法”快速合成了一系列新型的含氨基二硫代甲酸酯的2(5H)-呋喃酮类化合物(7a~7j),其结构经1H NMR,13C NMR和IR表征。运用MTT法测定了5-(S)-5-(l-孟氧基)-3-溴-4-(N-甲基-N'-苄基氨基二硫代甲酸)-2(5H)-呋喃酮(7c)抑制Hela人宫颈癌细胞增殖的体外活性。结果表明,7c具有较好的抑制活性,其IC50为0.14μM。
2(5H)-呋喃酮;氨基二硫代甲酸酯;合成;抗肿瘤活性
氨基二硫代甲酸酯具有抗菌、抗病毒、抗肿瘤等多种生物活性[1-4],广泛应用于医药、化学和生物学等诸多领域[5-7]。2(5H)-呋喃酮类化合物不仅具有抗菌、抗炎、抗病毒、抗癌等药理活性[8-10],同时还是重要的有机合成中间体[11-12]。特别是3,4-二卤-2(5H)-呋喃酮与各种含氮[13-16]、硫[17-18]、磷[19]、硒[20]等亲核试剂的串联加成-消除反应,近年来一直是国内外杂环化学研究的热点之一。
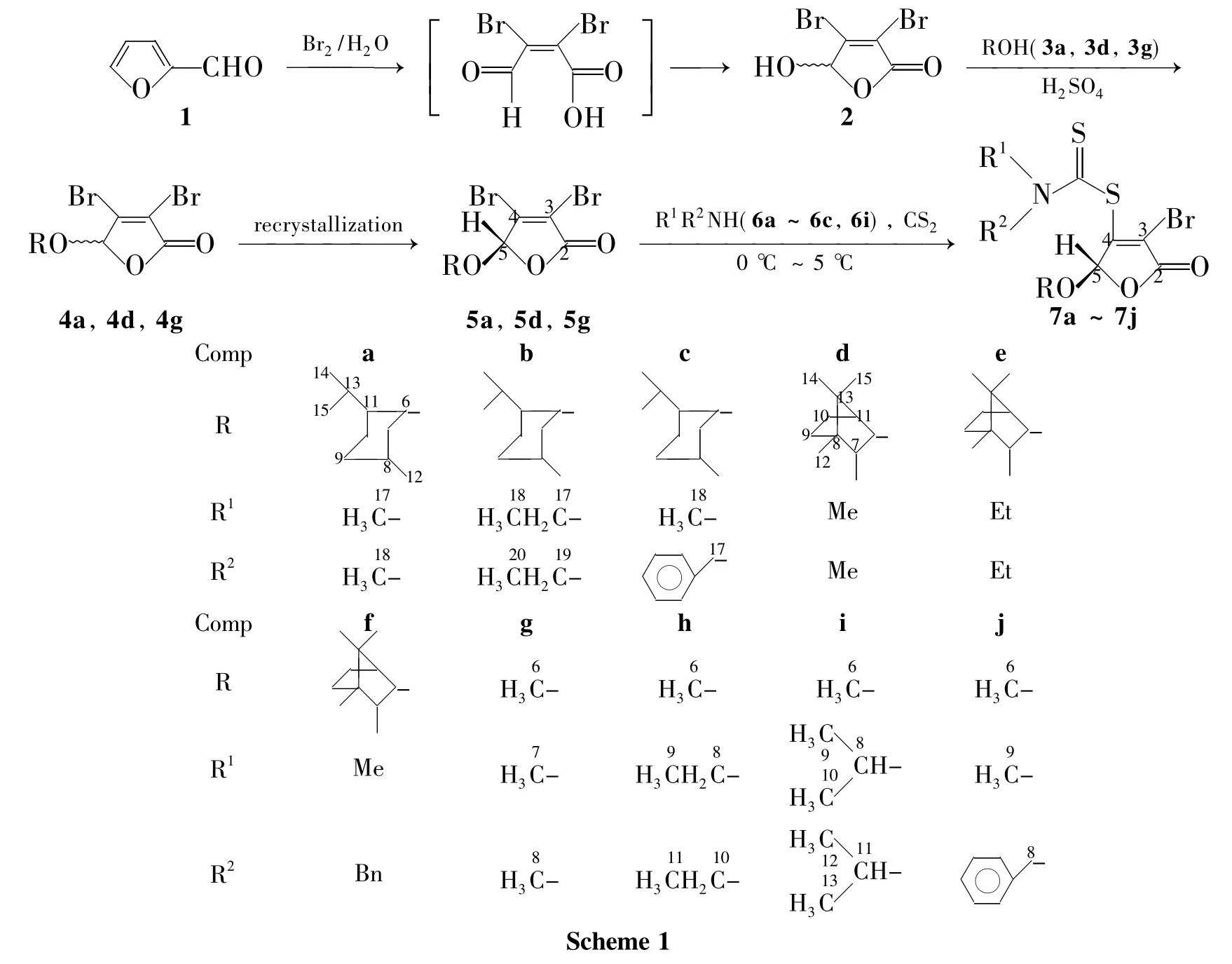
本课题组曾报道了2(5H)-呋喃酮-1,3,4-噻二唑硫醚衍生物[9]的合成,并对其体外抗宫颈癌抑制活性进行了初步的研究,取得了一定的成果。在此基础上,本文以活性亚结构拼接、叠加原理为指导,拟将氨基二硫代甲酸酯结构片段引入2(5H)-呋喃酮分子结构中,设计并合成了10个新型的化合物。以糠醛和薄荷醇(3a)[或(-)-(1S)-冰片(3d),甲醇(3g)]为原料,经3步反应制得中间体5-取代基-3,4-二溴-2(5H)-呋喃酮(5a)(或5d,5g);在无溶剂和无催化剂的条件下,5,仲胺和CS2通过“一锅法”快速合成了一系列新型的含氨基二硫代甲酸酯的2(5H)-呋喃酮类化合物(7a~7j,Scheme 1),其结构经1H NMR,13C NMR和IR表征。采用MTT法对5-(S)-5-(l-孟氧基)-3-溴-4-(N-甲基-N'-苄基氨基二硫代甲酸)-2(5H)-呋喃酮(7c)进行了抑制Hela人宫颈癌细胞增殖的体外活性测试。初步发现7c具有较好的抑制活性,其IC50值为0.14μM。
1 实验部分
1.1 仪器与试剂
X-24型数字显示显微熔点仪(温度未校正); Bruker AvanceⅢ400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);岛津FT-IR-8400S型红外光谱仪(KBr压片)。
5-羟基-3,4-二溴-2(5H)-呋喃酮(2)按文献[21-23]方法合成;其余所用试剂均为分析纯。
1.2 合成
(1)5a,5d和5g的合成
在反应瓶中加入2 8.5 g(33 mmol),3a 4.7 g(30 mmol)和无水苯150 mL,搅拌下滴加3~5滴浓硫酸,回流分水30~40 h(TLC跟踪)。依次用饱和碳酸氢钠溶液、饱和食盐水洗涤,分液,有机层用无水MgSO4干燥,减压蒸除苯得淡黄色固体,用石油醚(30℃~60℃)重结晶数次得白色固体,通过1H NMR分析为单一构型手性化合物5-(S)-5-(1-孟氧基)-3,4-二溴-2(5H)-呋喃酮(5a)6.9 g,收率58%,m.p.141℃~142℃,与文献[22-23]值吻合。
用3d替代3a,用类似的方法合成淡黄色固体5-(1S)-(-)-冰片氧基-3,4-二溴-2(5H)-呋喃酮(5d)5.5 g,收率52%,m.p.133℃~134℃,与文献[23]值吻合。
在反应瓶中加入2 5.1 g(20 mmol),3g 4mL和无水苯50 mL,搅拌下滴加3~5滴浓硫酸,回流分水30 h~35 h(TLC跟踪)。减压浓缩得淡黄色固体,用乙醚100 mL溶解后依次用饱和碳酸氢钠溶液和饱和食盐水洗涤,分液,有机层用无水硫酸镁干燥,减压浓缩后用乙醚重结晶得白色固体5-甲氧基-3,4-二溴-2(5H)-呋喃酮(5g)4.12 g,产率76%[16,22-23],m.p.49℃~50℃;1H NMR δ:5.84(s,1H,5-H),3.60(s,3H,OCH3);13C NMRδ:163.85(C6),143.12(C4),118.69 (C3),103.69(C5),56.20(C6);IRν:2 938 (CH3),1 773(C=O),1 612(C=C),1 366(酮C-O),1 136(C-O-C),998,859,742 cm-1。
(2)7a~7j的合成通法
在圆底烧瓶中加入5 2 mmol和二硫化碳10 mL,搅拌下于0℃~50℃加入仲胺(6a~6c,6i)4 mmol,反应10 min~60 min(TLC跟踪)。加水10 mL,用乙酸乙酯(2×5 mL)萃取,合并萃取液,用无水硫酸钠干燥,旋除溶剂后经硅胶柱层析[洗脱剂: A=V(石油醚)∶V(乙酸乙酯)]纯化得7a~7j。
5-(S)-5-(l-孟氧基)-3-溴-4-(N,N-二甲氨基二硫代甲酸)-2(5H)-呋喃酮(7a,反应时间30 min,A=4∶1):白色固体,收率80%,m.p.125℃~126℃;1H NMRδ:6.77(s,1H,5-H),3.56(ddd,J=4.4 Hz,4.4 Hz,4.8 Hz,1H,6-H),3.48(s,6H,17,18-H),2.23~2.27(m,2H,7,13-H),1.60~1.64(m,2H,9,10-H),1.29~1.40(m,2H,8,11-H),0.99~1.16(m,2H,9,10-H),0.92(t,J=7.0 Hz,6H,14,15-H),0.83~0.87(m,1H,7-H),0.81(d,J=7.2 Hz,3H,12-H);13CNMRδ:187.41(C16),165.32 (C2),152.63(C4),122.95(C3),104.03(C5),84.08(C6),48.06(C8),43.12,44.88(C17,C18),42.27(C7),33.98(C9),31.53(C11),25.54(C10),22.81(C13),22.10,21.09(C14,C15),15.98(C12);IRν:2 948(CH3),1 781 (C=O),1 633(C=C),1 304(C-N),1 030 (C=S)cm-1。
5-(S)-5-(l-孟氧基)-3-溴-4-(N,N-二乙氨基二硫代甲酸)-2(5H)-呋喃酮(7b,反应时间10 min,A=3∶1):白色固体,收率91%,m.p.147℃~149℃;1H NMRδ:6.78(s,1H,5-H),3.72~4.01(m,4H,17,19-H),3.56(ddd,J= 4.4 Hz,4.4 Hz,4.4 Hz,1H,6-H),3.48(s,6H,17,18-H),2.23~2.29(m,2H,7,13-H),1.60~1.67(m,2H,9,10-H),1.45(m,1H,8-H),1.42(t,J=6.2 Hz,3H,18-H),1.37(m,J=6.2 Hz,1H,11-H),0.93~1.10(m,2H,9,10-H),0.91(dd,J=6.8 Hz,6H,14,15-H),0.81~0.85(m,1H,7-H),0.81(d,J=6.8 Hz,3H,12-H);13C NMRδ:186.14(C16),165.45 (C2),152.40(C4),123.87(C3),104.32(C5),83.89(C6),49.35(C8),48.64,48.07(C17,C19),42.33(C7),34.00(C9),31.57(C11),25.50(C10),22.86(C13),22.10,21.03(C14,C15),16.00(C12),12.92,11.43(C18,C20);IR ν:2 954(CH3),1 783(C=O),1 653(C=C),1 307(C-N),1 030(C=S)cm-1。
5-(S)-5-(l-孟氧基)-3-溴-4-(N-甲基-N'-苄基氨基二硫代甲酸)-2(5H)-呋喃酮(7c,反应时间30 min,A=4∶1):淡黄色固体,收率83%,m.p.116℃~118℃;1H NMRδ:7.28~7.43 (m,5H,Ar-H),6.76(s,1H,5-H),4.85~5.37(m,2H,17-H),3.60(ddd,J=4.4 Hz,4.4 Hz,4.4 Hz,1H,6-H),3.36(d,J=24.4 Hz,3H,18-H),2.23~2.29(m,2H,7,13-H),1.63~1.67(m,2H,9,10-H),1.32~1.43(m,2H,8,11-H),0.98~1.10(m,2H,9,10-H),0.91(m,6H,14,15-H),0.83~0.88(m,1H,7-H),0.81(d,J=7.2 Hz,3H,12-H);13CNMRδ:189.35(C16),165.37(C2),152.15(C4),127.21~134.54(Ar-C),123.90(C3),104.24(C5),84.09(C6),58.92 (C17),48.07(C8),42.27(C18),40.09(C7),34.02(C9),31.59(C11),25.52(C10),22.92 (C13),22.11,21.13(C14,C15),16.10(C12);IR ν:2 954(CH3),1 780(C=O),1 650(C=C),1 310(C-N),1 000(C=S)cm-1。
5-(1S)-(-)-冰片氧基-3-溴-4-(N,N-二甲氨基二硫代甲酸)-2(5H)-呋喃酮(7d,反应时间30min,A=3∶1):黄色固体,收率82%,m.p.93℃~95℃;1H NMRδ:6.60(s,1H,5-H),3.98(d,J= 7.2 Hz,1H,6-H),3.51(d,J=9.6 Hz,6H,17,18-H),2.25(m,1H,11-H),1.21~1.89(m,6H,8,9,10,11-H),0.85~0.89(m,9H,12,14,15-H);13C NMRδ:187.07(C16),165.34(C2),153.08(C4),122.28(C3),104.45(C5),88.95 (C6),49.64(C10),47.66(C11),44.95(C7),43.47(C17,C18),36.67(C13),27.92(C8),26.64 (C9),19.60,18.80(C14,C15),13.49(C12);IR ν:2 952(CH3),1 780(C=O),1 620(C=C),1 382(C-N),1 040(C=S)cm-1。
5-(1-(-)-冰片氧基-3-溴-4-(N,N-二乙氨基二硫代甲酸)-2(5H)-呋喃酮(7e,反应50 min,A=4∶1):黄色固体,收率88%,m.p.120℃~123℃;1H NMRδ:6.67(s,1H,5-H),3.75~4.06(m,5H,6,17,19-H),2.25(m,1H,11-H),1.60-1.91(m,12H,8,9,10,11,18,20-H),0.89(m,9H,12,14,15-H);13C NMRδ:185.64 (C16),165.43(C2),153.08(C4),122.17(C3),104.49(C5),88.86(C6),49.65(C10),48.94 (C11),47.70(C7),44.92(C17,C19),36.71 (C13),27.93(C8),26.62(C9),19.60,18.78 (C14,C15),13.69,13.18(C14,C15),11.42 (C12);IRν:2 952(CH3),1 780(C=O),1 600 (C=C),1 340(C-N),1048(C=S)cm-1。
5-(1S)-(-)-冰片氧基-3-溴-4-(N-甲基-N'-苄基氨基二硫代甲酸)-2(5H)-呋喃酮(7f,反应50 min,A=3∶1):白色固体,收率82%,m.p.128℃~130℃;1H NMRδ:7.28~7.43(m,5H,ArH),6.66(m,1H,5-H),4.98~5.38(m,2H,17-H),4.03~4.16(m,1H,6-H),3.39~3.45 (m,3H,18-H),2.25(m,1H,11-H),1.21~1.93 (m,6H,8,9,10,11-H),0.85~0.89(m,9H,12,14,15-H);13C NMRδ:189.40(C16),165.33 (C2),153.02(C4),127.21~134.54(Ar-C),123.85(C3),104.57(C5),88.92(C6),58.95 (C17),49.38(C10),48.13(C11),47.72(C7),44.88(C18),36.69(C13),27.93(C8),26.64 (C9),20.05,19.62(C14,C15),13.69,13.18 (C14,C15),13.66(C12);IRν:2 952(CH3),1 783(C=O),1 603(C=C),1 388(C-N),1 020(C=S)cm-1。
5-甲氧基-3-溴-4-(N,N-二甲氨基二硫代甲酸)-2(5H)-呋喃酮(7g,反应30 min,A=4∶1):白色固体,收率85%,m.p.104℃~107℃;1H NMRδ:6.54(s,1H,5-H),3.57(s,3H,6-H),3.50(s,6H,8,9-H);13C NMRδ:186.70 (C7),165.01(C2),152.30(C4),123.14(C3),103.67(C5),57.47(C6),43.39,45.00(C8,C9);IRν:2 934(CH3),1 780(C=O),1 620 (C=C),1 381(C-N),1 015(C=S)cm-1。
5-甲氧基-3-溴-4-(N,N-二乙氨基二硫代甲酸)-2(5H)-呋喃酮(7h,反应30 min,A=3∶1):黏稠状黄色液体,收率89%;1H NMRδ:6.59(s,1H,5-H),3.60~4.08(m,4H,8,10-H),3.59 (s,3H,6-H),1.41(t,J=7.0 Hz,3H,9-H),1.31(t,J=7.0 Hz,3H,11-H);13C NMRδ: 184.25(C7),165.00(C2),153.29(C4),120.86 (C3),103.60(C5),57.35(C6),49.42,49.30 (C8,C10)11.30,13.16(C9,C11);IRν:2 936 (CH3),1 775(C=O),1 650(C=C),1 335 (C-N),1 010(C=S)cm-1。
5-甲氧基-3-溴-4-(N,N-二乙丙氨基二硫代甲酸)-2(5H)-呋喃酮(7i,反应40 min,A=3∶1):黄色固体,收率80%,53℃~55℃;1H NMRδ:6.93 (s,1H,5-H),3.83(m,1H,8-H),3.72(s,3H,6-H),3.42(m,1H,11-H),1.34(d,J=6.8 Hz,6H,9,10-H),1.10(d,J=6.8 Hz,6H,12,13-H);13C NMRδ:181.51(C7),163.51(C2),162.18(C4),139.23(C3),115.86(C5),53.26 (C6),50.42(C8,C11),45.75,20.01,20.62(C9,C10,C12,C13);IRν:2 972(CH3),1 734(C=O),1 638(C=C),1 335(C-N),1 046(C=S)cm-1。
5-甲氧基-3-溴-4-(N-甲基-N'-苄基氨基二硫代甲酸)-2(5H)-呋喃酮(7j,反应45 min,A= 5∶1):黏稠状黄色液体,收率85%;1H NMRδ: 7.29~7.45(m,5H,ArH),6.61(s,1H,5-H),5.21~5.33(dd,J=14.6 Hz,1H,8-H),5.07 (s,1H,8-H),3.60(d,J=5.6 Hz,3H,6-H),3.40(d,J=11.2 Hz,3H,9-H);13C NMRδ: 186.45(C7),165.03(C2),152.89(C4),127.14~140.04(Ar-C),121.79(C3),103.62(C5),60.11 (C8),57.39(C6),43.07(C9);IRν:2 926 (CH3),1 675(C=O),1 575(C=C),1 340 (C-N),1 000(C=S)cm-1。
1.3 抗肿瘤活性测定
受测试条件局限,随机选取7c采用MTT法[4]进行体外人宫颈癌细胞Hela的抑制活性测试。取对数增殖期的Hela细胞,以1×104个·mL-1细胞密度接种于96孔培养板,每孔100μL。培养24 h贴壁后加入浓度分别为3.1μg·mL-1,6.2μg· mL-1,12.5μg·mL-1,25.0μg·mL-1,50.0 μg·mL-1和100.0μg·mL-1含7c的灭菌DMSO溶液,在收获细胞前4 h,弃孔内上清液,每孔再加入20μL的MTT溶液(5mg·mL-1),于37℃继续培养4 h。每孔加入150μL灭菌DMSO,避光放入培养箱中过夜,使结晶物充分溶解。用酶标仪测定490 nm处各孔吸光度值(A490),以空白对照组调零,实验平行重复5次,取平均值,计算抑制率。
2 结果和讨论
2.1 合成
近年来,胺,CS2和卤代烃通过“一锅煮”合成氨基二硫代甲酸酯的方法被广泛研究[24-26],其研究一般都集中在探索“一锅煮”反应条件上。譬如,各种碱催化剂,如NaOH,EtONa,Et3N,Cs2CO3和氨基甲脒等,或反应溶剂,如DMF,DMSO和甲醇等。尽管这些方法在某些合成领域取得了一些进展,但仍存在一定的缺陷,如反应的前处理较为繁琐、中间产物稳定性差、常伴有副产物的生产、产率不高等等。此外,在大量文献的调研中,我们发现底物卤代烃的结构常为脂肪族卤代烃,鲜有其它亲电结构化合物参与反应的报道。
为了进一步优化探索“一锅煮”法合成氨基二硫代甲酸酯类衍生物的反应条件,扩大亲电试剂底物适用范围,本文利用3,4-二溴-2(5H)呋喃酮化合物中卤素原子所具有的特殊活性,代替普通卤代烃,在无催化剂、无反应溶剂条件下,探索其反应进程,幸运的得到了其4-位的取代产物,成功实现了7的合成。
3,4-二溴-2(5H)呋喃酮,CS2和胺的三组分反应迅速,总体在0.5 h~1.0 h内反应完全。由于CS2沸点低,极易挥发。故在简易条件下,控制较低温度环境下进行反应,有利于反应进行得更为彻底。实验中,经过多次实验摸索,得出该反应的最佳反应温度为0℃~5℃。该反应具有操作简便、后处理简单、反应时间短和产率高等优点。相关文献未详细报道其Michael加成反应机理,根据分析,我们推测其可能的反应机理如Scheme 2。

2.2 7c的抗肿瘤活性
7c对Hela的抑制率见表1。由表1可见,7c对Hela细胞株增殖起到了较好的抑制能力。在用药量为100μg·mL-1时,作用24 h后的抑制率达43.7%;给药时间延长至72 h时,其抑制率可提升至58.7%。这表明7c药效的发挥与作用的时间和浓度成正相关效应,一定程度上呈现与时间、给药浓度的依赖性。

表1 7c对Hela人宫颈癌细胞的抑制率*Table 1 The inhibition rates of7c on Hela cell lines
在倒置显微镜下进一步观察空白和7c作用Hela细胞24 h,48 h和72 h后其形态的变化(图1)。从图1发现,用药后圆形Hela细胞呈现不同程度的晚期凋亡特征,表现为染色质浓缩,体积变小,变形;细胞核逐步裂解为碎块、最终产生凋亡小体。随着药物作用时间的延长,凋亡特征表现愈发显著。通过空白对照组,未给药的Hela细胞则仍具有完整细胞膜,细胞株呈连片堆积增殖的恶性状态,并且观察到这种诱导凋亡效果随抑制作用时间的延长而愈加显著。

图1 7c在不同给药作用时间下Hela细胞形态变化Figure 1 Morphological changes of Hela cells induced by 7c in different intervals of time
应用非线性回归方法计算7c在用药24 h,48 h和72 h后对Hela细胞的半数抑制浓度(IC50)分别为0.18μM,0.16μM和0.14μM。较小的IC50值表明其具有较强选择性抑制人宫颈癌细胞增殖的细胞毒活性,同时也预示着7c具有非常好的潜在应用前景。受初步活性测试结果的鼓舞,其它同系列化合物的抗宫颈癌活性测试研究工作尚在进行当中,将另文发表。
[1]Hou X L,Ge ZM,Wang TM,et al.Dithiocarbamic acid esters as anticancer agent.Part 1:4-Substitutedpiperazine-1-carbodithioic acid 3-cyano-3,3-diphenylpropyl esters[J].Bioorg Med Chem Lett,2006,16 (16):4214-4219.
[2]Dhooghe M,Kimpe N D.Synthetic approaches towards 2-iminothiazolidines:An overview[J].Tetrahedron,2006,62(4):513-535.
[3]Xia S,Wang X,Ge ZM,et al.An efficient synthesis of aryldithiocarbamic acid esters from Michael addition of electron-deficient alkenes with arylamines and CS2in solid media alkaline Al2O3[J].Tetrahedron,2009,65(5):1005-1009.
[4]陈凑喜,李学强,李天才,等.新型18β-甘草次酸氨基二硫代甲酸酯衍生物的合成及抗癌活性研究[J].化学学报,2012,70(7):852-858.
[5]Pedras M S C,Jha M.Toward the control of Leptosphaeriamaculans:Design,syntheses,biological activity,and metabolism of potential detoxification inhibitors of the crucifer phytoalexin brassinin[J].Bioorg Med Chem,2006,14(14):4958-4979.
[6]Hemantha H P,Sureshbabu V V.A simple approach for the synthesis of new classes of dithiocarbamatelinked peptidomimetics[J].Tetrahedron Lett,2009,50 (50):7062-7066.
[7]Chaturvedi D,Mishra N,Mishra V.Triton-B catalyzed,efficient one-pot synthesis of dithiocarbazates[J].Monatsh Chem,2008,139(9):1033-1036.
[8]Juan Hikawczuk V E,Saad JR,Giordano O S,et al.Insect growth regulatory effects of linear diterpenoids and derivatives from baccharis thymifolia[J].J Nat Prod,2008,71(2):190-194.
[9]Wei M X,Feng L,Li X Q,et al.Synthesis of new chiral 2,5-disubstituted 1,3,4-thiadiazoles possessing g-butenolide moiety and preliminary evaluation of in vitro anticancer activity[J].Eur JMed Chem,2009,44 (8):3340-3344.
[10]Pimentel-Elardo SM,Kozytska S,Bugni T S,et al.Anti-parasitic compounds from streptomyces sp.Strains isolated from mediterranean sponges[J].Mar Drugs,2010,8(2):373-380.
[11]Prasad K R,Gandi V R.Facile enantiospecific synthesis of(+)-iso-cladospolide B[J].Tetrahedron: Asymmetry,2010,21(3):275-276.
[12]郁兆莲,胡少强,李森兰,等.新型手性β-烷氨基-γ-(l-孟氧基)丁内酯的合成[J].有机化学,2008,28(6):1119-1122.
[13]宋秀美,汪朝阳,李建晓,等.5-烷氧基-3,4-二卤-2 (5H)-呋喃酮与α,ω-二胺的串联反应[J].有机化学,2009,29(11):1804-1810.
[14]莫阳青,汪朝阳,李建晓,等.5-烷氧基-3,4-二卤-2 (5H)-呋喃酮与氨基酸酯的串联反应[J].有机化学,2010,30(7):1051-1058.
[15]宋秀美,谭越河,李建晓,等.无保护α-氨基酸合成多手性中心2(5H)-呋喃酮化合物[J].有机化学,2010,30(12):1890-1897.
[16]Chen Q H,Geng Z,Huang B.Synthesis of enantiomerically pure 5-(l-menthyloxy)-3,4-dibromo-2(5H)-furanone and its tandem asymmetric Michael additionelimination reaction[J].Tetrahedron:Asymmetry,1995,6(2):401-404.
[17]Devyatova N F,Kosolapova LS,Kurbangalieva A R,etal.Reactions of2-sulfanylethanol with mucochloric acid and its derivatives[J].Russ JOrg Chem,2008,44(8):1225-1232.
[18]Kurbangalieva A R,Devyatova N F,Kosolapova L S,et al.Reactions of 2-mercaptoacetic acid with mucochloric acid and its derivatives[J].Russ Chem Bull,2009,58(1):126-133.
[19]Polezhaeva N A,Volodina Yu M,Kalinina IV,etal.Phosphorylation of 3,4-dichloro-5-hydroxy-2(5H)-furanonewith tributylphosphine[J].Russ JGen Chem,2002,72(8):1202-1206.
[20]Kurbangalieva A R,Bogdanov A V,Movchan A I,et al.First selenium-containingmucochloric acid derivatives[J].Russ JOrg Chem,2004,40(8):1216.
[21]李学强,黄敏,陈庆华.手性4-磷酸二酯基-3-卤-2 (5H)呋喃酮的合成与结构[J].化学学报,2000,58 (3):363-367.
[22]陈庆华,耿哲.新的手性源5-(l-孟氧基)-3,4-二氯-2(5H)-呋喃酮的合成及结构[J].化学学报,1993,51(6):662-624.
[23]李学强,陈庆华.手性膦酸二酯类化合物的合成与结构[J].高等学校化学学报,2001,22(10):1677-1681.
[24]Azizi N,Aryanasab F,Torkiyan L,et al.One-pot synthesis of dithiocarbamates accelerated in water[J].JOrg Chem,2006,71(9):3634-3635.
[25]Ranu BC,Saha A,BanerJee S.Catalysis by ionic liquids:Significant rate acceleration with the use of[pm Im]Br in the three-component synthesis of dithiocarbamates[J].Eur JOrg Chem,2008,(3):519-523.
[26]郭圣荣,袁艳琴,张春牛.无溶剂无催化剂条件下二硫代氨基甲酸酯衍生物的合成研究[J].有机化学,2012,32(5):909-914.
Synthesis and Antitumor Activities of Novel
2(5H)-Furanone Derivatives Containing Dithiocarbamate
LITian-cai1a,KANG Lei2,
LIXue-qiang1a,GAO Xiao-hui1a,ZHOU Xue-zhang1b
(a.School of Chemistry and Chemical Engineering,Development Center of Natural Products and Medication; b.Key Laboratory of Ministry of Education for Protection and Utilization of Special Biological Resources in Western China,1.Ningxia University,Yinchuan 750021,China; 2.Department of Chemical Engineering,Ningxia Vocational College of Industry,Yinchuan 750021,China)
5-Substituted-3,4-dibromo-2(5H)-furanones(5a,5d and 5g)were prepared by a threestep reaction from furfural and menthol(3a)[or borneol(3d),methanol(3g)].A highly efficient and simple synthesis of a series of novel 2(5H)-furanone derivatives(7a~7j)containing dithiocarbamate were first reported by one-pot reaction of secondary amines,CS2and 5 under without catalyst and solvent-free conditions.The structureswere characterized by1H NMR,13C NMR and IR.The in vitro anti-Hela activities of 5-(S)-5-(l-menthyloxy)-3-bromo-4-(N-methyl-N'-benzyldithiocarbamate ester)-2(5H)-furanone(7c)were investigated by MTTmethod.The results showed that7c exhibited the best inhibition activities against A459 with IC50of 0.14μM.
2(5H)-furanone;dithiocarbamate;synthesis;antitumor activity
O626.11;O621.3
A
1005-1511(2014)02-0133-06
2012-12-26;
2014-01-06
国家自然科学基金资助项目(21062014);教育部科学技术研究重点项目(210237);“211工程三期建设高校”重点学科建设项目;宁夏高等学校科学技术研究资助项目(NGY2013171)”;云南大学自然资源药物化学教育部重点实验室开放基金资助项目(200902205)
李天才(1982-),男,汉族,河南周口人,硕士研究生,主要从事有机合成的研究。E-mail:litiancai1982130@163.com
李学强,教授,硕士生导师,Tel.0951-2062406,E-mail:lixq@nxu.edu.cn
