适用于汽油参比燃料TRF的多环芳香烃生成机理
2014-06-23李艳荣裴毅强
李艳荣 裴毅强,* 秦 静,2 张 淼
(1天津大学内燃机燃烧学国家重点实验室,天津300072;2天津大学内燃机研究所,天津300072)
1 引言
近年来,缸内直喷发动机以其良好的燃油经济性和瞬态响应特性备受业内青睐,然而由于其将燃油直接喷入缸内导致缸内燃油与空气混合时间缩短、局部混合气过浓和燃油湿壁现象,造成其碳烟生成量较进气道喷射发动机有显著增加,1-3由于排放法规对内燃机碳烟质量和数量排放的限制日益严格,发展精确的碳烟生成模型受到社会的广泛关注.研究发现,碳烟形成的最后环节是多环芳香烃(PAHs)的物理凝固,不能精确估计燃烧区域PAHs的物质浓度,便不能精确预测碳烟的体积分数、数浓度以及粒度分布.4,5因此,研究燃烧过程中PAHs的生长路径具有重要的指导意义.
汽油由多种具有不同分子重量和化学结构的碳氢化合物组成,包括直链和支链的脂肪烃以及芳香烃,以汽油的真实组分模拟燃料燃烧尤为复杂,因此,一般采用汽油参比燃料替代真实汽油进行研究.汽油参比燃料TRF(toluene reference fuels)即正庚烷、异辛烷、甲苯的混合物,它们是最主要也是最简单的汽油参比燃料.甲苯属于芳香烃,芳香烃与正庚烷和异辛烷相比,更容易促进碳烟和PAH生成,是汽油的重要组分.5-7而基础燃料(PRF)仅为正庚烷和异辛烷的混合物,并未考虑芳香烃在生成碳烟方面的贡献,因此,采用TRF为燃料研究PAH和碳烟生成比采用PRF为燃料更合理.文献5-10发展的TRF机理均得到着火延迟期、层流火焰速度和物质浓度(如乙炔和苯)实验数据的有效校正.而以上机理中只有Blanquart7和Marchal10等提出的机理验证了燃烧过程中大PAHs的物质浓度.Blanquart7和Marchal10等提出的机理是近期发展的研究汽油参比燃料碳烟前驱物的机理,二者均将PAH生成机理发展到芘(A4)水平,并且得到不同火焰环境中小分子碳氢化合物和苯浓度的验证,然而二者均将HACA(hydrogenabstraction-C2H2/C2H4-addition)机理作为PAH生长的主要路径,导致正庚烷火焰中苯(A1)-A4(尤其是A4)物质浓度预测结果较实验值低很多.因此,亟待发展精确的PAH生长模型.
为了研究汽油参比燃料TRF燃烧过程中PAHs的生成机理,本文在前人的研究基础上提出一个包括287种组分和1569个反应的详细化学反应动力学机理,在不同火焰环境中进行定性和定量的实验验证并分析各条反应路径对于PAH生成的贡献率.
2 机理的构建
本文构建的PAH生成机理包含三部分.第一部分中机理以TRF着火氧化开始,主要参考Andrae等9发展的包含137种物质、633个反应的半详细机理(简称Andrae机理).Andrae机理在700-1300 K,1-5 MPa范围内得到激波管、快压机和定容燃烧弹等实验数据的有效验证.本文主要针对PAH生长机理的构建对Andrea机理中甲苯部分进行修正,添加了Qi等11提出的机理中的环戊二烯自由基C5H5、茚基C9H7、C6H4CH3等26种组分和228个反应,引入的C5H5和C9H7物质是PAH生长的关键组分.第二部分是脂肪烃和芳香烃之间的交叉反应,研究表明,烷烃、烯烃和芳烃之间的交叉反应可以解释添加甲苯到PRF燃料,导致PRF的着火延迟期发生较大变化的现象.为得到较为准确的模型并且为后续研究交叉反应对PAH生成的影响做准备,本文应用较为详细的交叉反应,为此加入24个来自Sakai与其合作者8,12提出的机理中的交叉反应,主要包括三类:(1)物质脱氢反应,RH+Q⇌R+QH,RH代表甲苯、苯和苯甲醛,QH代表正庚烷、异辛烷、C3H6和i-C4H8;(2)烷烃和甲苯各自脱氢后其自由基之间的重组反应,此外,C6H5CH2与烯烃自由基C2H3和C3H5的反应也加入该机理;(3)苯基自由基与烯烃反应,主要为β断裂与合成反应,如C6H5+C2H4⇌styrene+H,同时保留了Andrae等9机理中的12个交叉反应,表1为本文中的交叉反应.机理第三部分为PAH生成及生长机理.甲苯燃料的引入增加了PAH生长的路径,其中多个反应对PAH生长起关键作用.本文使用的PAH生长路径主要参考Blanquart机理7的四种路径:(1)第一条路径为熟知的HACA机理,六个碳原子构成的芳香环一般由芳香烃自由基成功添加两个乙炔分子或乙烯形成;13(2)第二条路径是将炔丙基C3H3加成到相应的芳烃替代物,14,15如炔丙基C3H3加成到苯甲基形成A2:A1CH2+C3H3⇌A2+H2;(3)第三种路径是芳香烃自由基加成乙烯基乙炔,随后直接环化形成PAH,16,17如A1―+C4H4⇌A2+H;(4)PAH生长的最后路径为环戊二烯自由基C5H5自合成反应形成A2或者环戊二烯自由基C5H5与茚基C9H7形成A3.反应C5H5+C5H5→A2+2H,首次由Marinov等18提出,被认为是A2生长的关键路径.
此外,本文参考Raj等5机理对A1-A4物质的生长路径进行补充.A1-A4各物质的主要生长路径如下:A1物质的生成路径主要为炔丙基(C3H3)的合成以及C2Hx与C4Hy的合成作用,同时,引入C5H5CH3和C5H4CH3两种来自甲苯燃烧的组分,2条A1生成路径,即C5H4CH2⇌A1和C5H4CH2⇌A1―+H;5,19在前人提出的HACA生长机理的基础上,增加25条A2的生长路径,其中环戊二烯基C5H5自合成作用是A2生长的重要反应,此外添加了苯基、苯甲基和C3物质生成A2的反应路径,如C6H5CH2+C3H3=C10H10,C10H10+H=C10H9+H2,C10H9+H=A2+H2;5,11本文引入三条A3生长的新路径,一条为苯甲基的自合成作用,一条为C9H7+C5H5→A3+2H,5,11一条为C2或C3物质添加到烷基萘或其自由基的反应.与A3的生成路径类似,A4生成路径添加了烷基苯与奇数个碳原子物质 C5H5或 C9H7的反应,C6H5CH2+C9H7→A4+2H2,A2CH2+C5H5→A4+2H2以及 C9H7+C9H7→A4+C2H2+H2.5,20图1为机理中PAHs和四种重要的芳香烃结构示意图.

表1 本文中的交叉反应Table 1 Cross reactions used in this paper
3 机理验证
文章主要以着火延迟期、火焰中重要的小分子及PAHs的物质浓度为目标验证机理的适用性.
3.1 着火延迟
对着火延迟期的准确预测是检验化学反应动力学机理有效性的重要标志,该部分工作主要在激波管中展开.激波管中由于是简单的一维均匀流动,采用预混燃料情况下,可以实现燃烧过程中化学动力学的单独研究,因此是研究着火延迟的首选设备.
计算使用化学反应动力学程序CHEMKIN PRO,21并在定容、均值绝热的定容燃烧弹条件下进行.本文着火定义为OH最大物质浓度出现的位置.
实验研究了温度为700-1350 K条件下着火延迟的问题,本文对PRF、甲苯和TRF的着火延迟均做适当验证以说明机理的广泛适用性.
3.1.1 PRF
图2-4显示了不同压力和化学计量比条件下,正庚烷、异辛烷和一定混合强度的PRF的着火延迟期与温度的变化关系,并与Fieweger等22得到的实验结果进行比较.图2中比较了正庚烷着火延迟的模拟结果与激波管实验数据,由图可知,正庚烷在中间温度区域有明显的负温度系数(NTC)行为,机理预测结果在负温度系数区与实验结果存在一定偏差,最大误差为41%,但模拟结果能很好地反映着火延迟期的变化趋势,与实验结果保持较好的一致性.图3显示异辛烷计算结果与实验结果数值非常接近,并在720-870 K的温度范围内表现出明显的负温度系数行为,该机理对温度和化学计量比表现得较敏感,能很好地预测不同压力和化学计量比条件下温度对着火延迟期的影响.图4是辛烷值为60、80、90的三种基础燃料在压力为4 MPa,化学计量比为1.0条件下着火延迟的模拟结果与实验结果比较.由图可知,机理对NTC区域的模拟结果较实验值偏低,但模拟结果可以很好反映着火延迟随温度的变化趋势,并充分体现出着火延迟随着辛烷值的增加而增加,这与实验结论保持一致,整体误差均在36%以内.
在位于长三角腹地的江苏省无锡市的太湖旁,一家占地6万多平米的企业屹立于此,其在产品领域涉及输送、仓储、拣选、控制、软件等各个环节,能够为不同行业客户量身打造从前期咨询、方案设计、数据仿真、设备制造,到后期运输、安装调试、售后服务的一体化解决方案,这家企业便是无锡中鼎集成技术有限公司(以下简称“中鼎集成”)。日前,《中国储运》杂志记者从CeMATASIA2018现场采访到无锡中鼎集成技术有限公司总经理张科,了解到诸多中鼎集成的前沿信息。
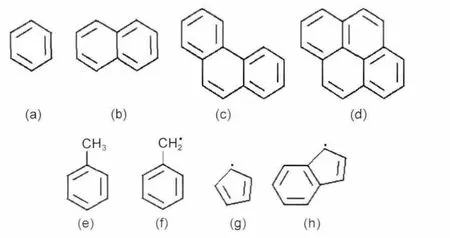
图1 机理中重要物质的分子结构示意图Fig.1 Structures of important species in this mechanism

图2 不同化学计量比(ϕ)下实验(exp)22与计算(mod)中初始温度对正庚烷着火延迟的影响的比较Fig.2 Comparison of experimental(exp)22and calculation(mod)results for the influence of initial temperature on n-heptane ignition delay at different equivalent ratios(ϕ)

图3 不同化学计量比下实验22与计算中初始温度对异辛烷着火延迟的影响的比较Fig.3 Comparison of experimental22and calculation results for the influence of initial temperature on isooctane ignition delay at different equivalent ratios

图4 实验22与计算中初始温度对不同基础燃料着火延迟的影响的比较Fig.4 Comparison of experimental22and calculation results for the influence of initial temperature on ignition delay of different primary reference fuels
3.1.2 甲苯燃料
图5为甲苯着火延迟期的模拟结果与Shen等23的实验结果对比图,由图可知,该机理可以很好地捕捉到由于温度和混合强度变化而导致的着火延迟期的改变,机理对浓甲苯火焰具有较好的预测能力,对于ϕ=1的甲苯火焰,机理能很好地预测中高温区的着火延迟,对于低温火焰,模拟结果比实验结果略小.对甲苯氧化的反应路径分析得到,低温阶段,甲苯主要与OH和C6H5O反应生成苯甲基,苯甲基与O2分子生成C6H5CH2OO,随后发生的反应C6H5CH2OO⇌C6H5CHO+OH是甲苯火焰低温阶段OH的主要来源,而生成OH的另外两个重要反应H2O2=2OH和H+O2=O+OH仅在高温阶段起作用.苯甲基的分支反应C6H5CH2+HO2=A1CH2O+OH,对甲苯火焰高压条件下的着火很敏感,是控制甲苯火焰中间温度区域着火延迟的关键反应.

图5 不同化学计量比下实验23与计算中初始温度对甲苯着火延迟的影响的比较Fig.5 Comparison of experimental23and calculation results for the influence of initial temperature on toluene ignition delay at different equivalent ratios
3.1.3 TRF
很显然,机理对单一燃料具有较强的适用性,对混合燃料不一定适用.因此,本文进一步验证机理对TRF着火延迟期的适用性.选取两组不同配比的TRF与Gauthier等24的实验结果进行比较.燃料配比见表2,图6和图7分别为两种参比燃料在化学计量比为1,3.04 MPa压力条件下着火延迟期的模拟结果与实验结果的对比.
由图可知,两种参比燃料着火延迟期计算值对实验值的预测结果达到很好的吻合,最大误差均在48%以内,由于缺乏两种参比燃料在低温条件下的激波管实验数据,因此,该机理在低温条件的适用性有待进一步的验证.
Vanhove等25和Sakai与其合作者8,12的研究表明,甲苯加入PRF主要起到降低混合物活性的作用,当温度T>1100 K,甲苯起到降低异辛烷着火延迟期的作用,但对正庚烷着火延迟的加速效果并不明显.并指出丙二烯与苯基和苯甲基的交叉反应对异辛烷和甲苯混合物的氧化起到重要作用,因此,本文引入丙二烯与苯基和苯甲基的交叉反应A1―+AC3H4=C6H5CH2+C2H2,A1―+AC3H4=C9H8+H,C6H5CH2+AC3H4=A1C2H4+C2H2和C6H5CH2+AC3H4=C10H10+H,同时添加C6H5CH2OO+C7H16=C6H5CH2OOH+C7H15-1和C6H5CH2OO+C7H16=C6H5CH2OOH+C7H15-2等脂肪烃和芳香烃之间的交叉反应以增强机理对TRF低温阶段着火延迟的预测能力,并为后续交叉反应对PAH生成影响的研究做准备.
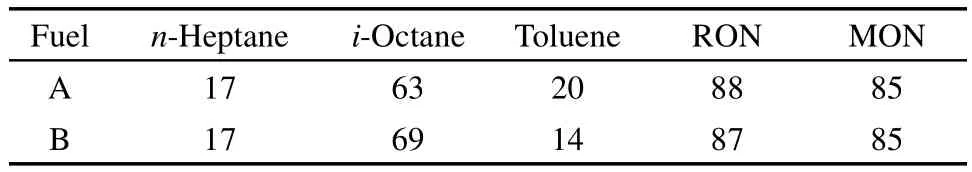
表2 模拟所用的TRF燃料配比(体积分数)Table 2 Fuel proportion(volume fraction)of the TRF used in the simulation

图6 实验24与计算中初始温度对燃料A着火延迟的影响的比较Fig.6 Comparison of experimental24and calculation results for the influence of initial temperature on surrogateAignition delay

图7 实验24与计算中初始温度对燃料B着火延迟的影响的比较Fig.7 Comparison of experimental24and calculation results for the influence of initial temperature on surrogate B ignition delay
通过上述计算结果与实验结果的比较可知,本文提出的TRF化学反应动力学机理对相关实验的着火延迟期具有很好的预测能力,并且对单一燃料和混合燃料都具有广泛的适用性.
3.2 物质浓度
前面部分已验证机理对着火延迟和层流火焰具有较好的适用性,为验证机理对火焰物质浓度的预测能力,本文主要参考国外专家的验证方法,对混合组分的单一燃料物质浓度进行验证,因而本文选取引用率较高的两组正庚烷火焰进行研究.Blanquart等7研究发现,燃烧模式(湍流或层流)对A1的生成途径的影响不大,物质结构是改变A1生成途径的关键因素.因此,本文选取的火焰为预混层流火焰,使用化学反应动力学程序CHEMKIN PRO21进行模拟计算,火焰参数如表326,27所示.
3.2.1 小分子物质浓度
本文以PAH前驱物如C2H2、C2H4、AC3H4、PC3H4和A1等为研究对象验证其物质浓度,主要原因在于C2H2是PAH的重要生长路径(HACA机理)的关键物质且其主要来自C2H4火焰,C2H2和C3H3是生成A1的重要前驱物,AC3H4和PC3H4是C3H3的重要来源.因此,能否精确预测 C2H2、C2H4、AC3H4、PC3H4和 A1物质浓度是该模型预测PAH的关键.图8(a-d)为模拟正庚烷A火焰中小分子的物质浓度随燃烧火焰高度的变化关系,并与Marchal等10提出的机理(简称Marchal机理)进行比较.HAB代表火焰高于燃烧器表面的位置.由图可见,模拟结果与实验结果在一定程度上达到较好的吻合.图8(a)反映燃料和氧化剂燃烧过程的消耗情况,模拟值和实验值在很大程度上达到良好的一致性.图8(b,c)分别为C2物质和C3物质的模拟值与实验值的对比.由图可知,C2物质的模拟值与实验值吻合较好,C2H2和C2H4物质仅在最大物质浓度值处与实验值有较大偏大,最大误差为30%.机理对C3物质最大物质浓度的预测值偏低,模拟结果只能很好反映整个燃烧过程中物质浓度变化趋势但缺乏准确预测最大物质浓度的能力.后续研究中,将进一步校正机理对C3物质的预测能力.从图8(d)可以看出A1物质模拟结果与实验结果在曲线的趋势上达到良好的一致,且最大物质浓度的偏差不大.图9(a,b)为正庚烷A火焰A1和C3H3物质绝对产率分析.由图可知,在正庚烷火焰中,C3H3在生成A1的过程中起主导作用.实验缺乏对C3H3物质浓度的测定但由图9(b)得出C3物质及C2H2为C3H3的重要前驱物,因此,机理对C3H3物质预测性能可由C2H2、C3物质和A1物质浓度间接反映.
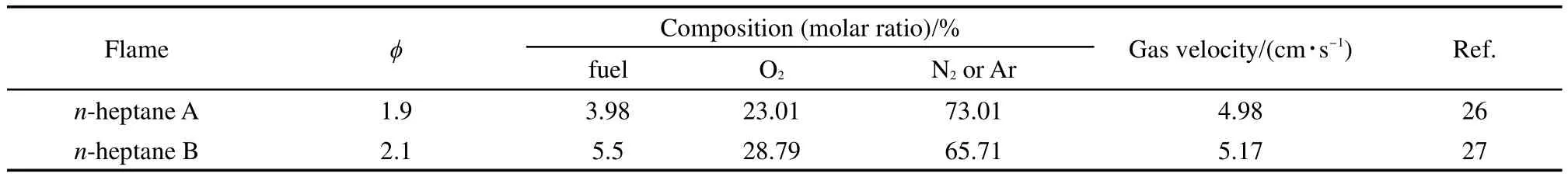
表3 层流火焰的测试条件Table 3 Test conditions of premixed laminar flames
由于缺乏TRF火焰的实验数据,本文无法验证机理对TRF小分子的适用性,随着课题的展开,后续将尝试TRF的相关实验以验证机理对TRF燃料小分子的预测性能.
3.2.2 PAHs物质浓度
本文以正庚烷B火焰为研究对象验证机理对PAHs的预测能力,图10为模拟的正庚烷火焰中PAHs物质浓度随着火焰高度变化曲线与实验结果27的对比并与Marchal机理进行比较.前文已提到Marchal机理将PAH生成机理发展到A4水平并得到多个层流火焰的小分子碳氢化合物及苯的物质浓度验证.模拟采用层流火焰燃烧器模型.实验过程中采用取样探头在燃烧器上方1 cm内取样,取样探头的介入会破坏火焰的速度场和温度场,并且在近燃烧器上表面几毫米处取样探头和燃烧器表面可能发生相互作用,该区域的实验值存在一定误差,被称为是问题区域,因此,较大HAB处模拟结果与实验结果的对比更具有实际意义.由图可知PAH的预测在一定程度上与实验结果达到良好的吻合,HAB<0.6 cm范围,A1-A4浓度预测结果总体上比实验值偏低,A1、A3和A4物质浓度在HAB=0.6 cm以后与实验结果达到一致,A2物质浓度与实验有一定偏差,因此,相应的PAH生成机理还需进一步校正.由于甲苯燃料的引入,使得PAHs生成机理有所更新且理论上更符合实际PAH生成过程,从图中新机理与Marchal机理对比可得到相同结论,该机理对PAHs预测能力较Marchal机理有明显提高.

图8 正庚烷A火焰中小分子物质浓度曲线随火焰高度的变化关系Fig.8 Mole fraction profiles of small hydrocarbons in C7H16premixed flameAas a function of height above the burner

图9 A1和C3H3物质产率(v)Fig.9 Rates of production(v)of A1 and C3H3


图10 正庚烷B火焰中PAH物质浓度随火焰高度的变化关系Fig.10 Mole fraction profiles of PAHs in C7H16premixed flame B as a function of height above the burner
为分析新加入的四种反应路径对PAH生成起到的作用,下面对PAH产率进行分析.
3.3 各反应路径对PAH生成贡献的分析
本文3.2.1部分已对A1物质的产率进行分析,并已证实在正庚烷火焰中,炔丙基C3H3自合成反应是A1生成的唯一关键路径.Marchal等10指出C3物质反应路径在异辛烷火焰中比在正庚烷火焰中更为重要,如:C3H4+H=C2H2+CH3,以及反应C3H6+H=C2H4+CH3(仅存在异辛烷火焰中),并且指出C2H2是生成C3H3的关键物质,在此,对A1的路径分析不再赘述.

图11 A2,A3和A4的绝对产率图Fig.11 Absolute rates of production ofA2,A3,andA4

图11是对A2、A3、A4绝对产率分析图,模拟正庚烷B火焰条件下PAH生成,采用能量方程求解反应温度.由图可知,三种芳香烃的自由基通过使H2、CH4、C3H4脱氢的反应更容易生成对应的PAH,且随着反应温度的升高,各反应速率发生较大变化.从图11(b)可知,在近火焰燃烧器表面低温处,甲苯自由基加成C2H4以及苯自由基加成C4H4的反应是脱氢反应之外生成A2的重要路径,同时C5H5的自合成反应、加成C2物质的反应以及C10H9加氢反应对A2的生成也有较大的贡献.
从图11(c)(A3反应)可以明显看出芳香烃自由基加氢反应与其他反应生成A3产率的差距,分析图11(c,d),得到以下结论.本文添加的A2CH2加成C3H3的反应以及茚基C9H7与环戊二烯自由基C5H5对A3的贡献非常大,是A3生长的重要途径.此外,萘基加成C4H4的反应以及联苯经过HACA机理生成A3的反应都对A3起到重要作用且在中等温度反应较活跃,A2CH2与C3物质的反应对反应温度不敏感.
与A2、A3一样,大部分的A4来自其自由基的加氢反应,由图11(f)分析得到,大部分生成A4的路径在中高温度下较活跃,中低温度区,主要为A4的自由基与C3H4、CH4和H的反应.反应2C9H7→A4+C2H2+H2在低温区并不活跃,而在高温区成为生成A4的关键反应,茚基C9H7与苯甲基C6H5CH2的反应以及芳香烃加成C5H5的反应对A4的生长都具有较大贡献,该部分反应路径是Marchal机理没有的.
通过反应路径和产率的分析,了解到各反应路径对PAH生长起到的作用,验证了前文提到的四种PAH生长路径的重要性,并得出含奇数碳原子的碳氢化合物C5H5和C9H7对PAH生长起到关键作用.各反应路径对PAH生长的贡献有待于在不同火焰环境中进一步分析.
4 结论
(1)构建了一个适用于TRF燃烧过程中PAH生成机理的详细化学反应动力学模型,包括287种组分和1569个反应.该详细机理针对不同混合强度、化学计量比、温度和压力条件下的PRF和TRF,计算得到的着火延迟期与实验结果达到很好的吻合,其中正庚烷、异辛烷或其自由基与甲苯及其自由基之间的交叉反应提高了机理对TRF燃料着火延迟期预测的准确性.
(2)机理模拟两种层流火焰的结果表明,PAH前驱物C2H2、C2H4等物质以及PAHs(A1-A4)的物质浓度曲线的模拟结果与实验结果达到良好的一致性,引入新的PAH生成路径,使得新机理对PAH物质浓度的预测能力较之前机理有明显增强.
(3)通过对PAH产率的分析,指出乙炔(C2H2)、丙炔(C3H3)、乙烯基乙炔(C4H4)以及含有奇数碳原子的环戊二烯自由基(C5H5)和茚基(C9H7)物质对PAHs生成和生长起到重要作用.
(1) Li,J.;Gong,Y.F.;Li,W.;Chen,H.E.;Liu,J.Y.;Li,J.C.;Li,K.;Dou,H.L.Journal of Xi'an Jiaotong University2010,44(7),9.[李 俊,宫艳峰,李 伟,陈海娥,刘金玉,李金城,李 康,窦慧莉.西安交通大学学报,2010,44(7),9.]doi:10.7652/xjtuxb201401001
(2) Gao,J.H.;Li,Y.;Gao,J.D.;Liu,S.X.;Qin,K.J.Journal of Jilin University(Engineering and Technology Edition)2010,40,947.[高俊华,李 淯,高继东,刘双喜,秦孔建.吉林大学学报(工学版),2010,40,947.]
(3) Pan,S.Z.;Song,C.L.;Pei,Y.Q.;Yuan,D.;Wu,W.L.Journal of Tianjin University(Science and Technology Edition)2013,7,629.[潘锁柱,宋崇林,裴毅强,原 达,吴威龙.天津大学学报(自然科学与工程技术版),2013,7,629.]
(4) Wang,H.;Frenklach,M.Combust.Flame1997,110,173.doi:10.1016/S0010-2180(97)00068-0
(5) Raj,A.;Prada,I.D.C.;Amer,A.A.;Chung,S.H.Combust.Flame2012,159,500.doi:10.1016/j.combustflame.2011.08.011
(6)Andrae,J.C.G.;Head,R.A.Combust.Flame2009,156,842.doi:10.1016/j.combustflame.2008.10.002
(7) Blanquart,G.;Pepiot-Desjardins,P.;Pitsch,H.Combust.Flame2009,156,588.doi:10.1016/j.combustflame.2008.12.007
(8) Sakai,Y.;Miyoshi,A.;Koshi,M.;Pitz,W.J.Proc.Combust.Inst.2009,32,411.doi:10.1016/j.proci.2008.06.154
(9)Andrae,J.C.G.;Brinck,T.;Kalghatgi,G.T.Combust.Flame2008,155,696.doi:10.1016/j.combustflame.2008.05.010
(10) Marchal,C.;Delfau,J.L.;Vovelle,C.;Moréac,G.;Mounaim-Rousselle,C.;Mauss,F.Proc.Combust.Inst.2009,32,753.doi:10.1016/j.proci.2008.06.115
(11) Zhang,L.;Cai,J.;Zhang,T.;Qi,F.Combust.Flame2010,157,1686.doi:10.1016/j.combustflame.2010.04.002
(12) Sakai,Y.;Ozawa,H.;Ogura,T.;Miyoshi,A.;Koshi,M.;Pize,W.J.Effects of Toluene Addition to Primary Reference Fuel at High Temperature.InPowertrain&Fluid Systems,SAE Internal,Rosemont,lllinois,Oct.29-Nov.1,2007.
(13) Frenklach,M.;Wang,H.Proc.Combust.Inst.2002,29,2307.doi:10.1016/S1540-7489(02)80281-4
(14) D′Anna,A.;Kent,J.H.Combust.Flame2003,132,715.doi:10.1016/S0010-2180(02)00522-9
(15) McEnally,C.S.;Pfefferle,L.D.;Atakan,B.;Kohse-Hinghaus,K.Prog.Energy Combust.Sci.2006,32,247.doi:10.1016/j.pecs.2005.11.003
(16) Moriarty,N.W.;Frenklach,M.Proc.Combust.Inst.2000,28,2563.doi:10.1016/S0082-0784(00)80673-6
(17)Aguilera-Iparraguirre,A.J.;Klopper,W.J.Chem.Theory Comput.2007,3,139.doi:10.1021/ct600255u
(18) Marinov,N.M.;Pitz,W.J.;Westbrook,C.K.;Castaldi,M.J.;Senkan,S.M.Combust.Sci.Technol.1996,116,211.
(19) Sharma,S.;Green,W.H.J.Phys.Chem.A2009,113,8871.doi:10.1021/jp900679t
(20) Slavinskaya,N.A.;Frank,P.Combust.Flame2009,156,1705.doi:10.1016/j.combustflame.2009.04.013
(21) Kee,R.J.;Rupley,F.M.;Miller,J.A.;Coltrin,M.E.;et al.CHEMKIN PRO,Release 15112;Reaction Design:San Diego,2011.
(22) Fieweger,K.;Blumenthal,R.;Adomeit,G.Combust.Flame1997,109(4),599.doi:10.1016/S0010-2180(97)00049-7
(23) Shen,H.P.S.;Vanderover,J.;Oehlschlaeger,M.A.Proc.Combust.Inst.2009,32,165.doi:10.1016/j.proci.2008.05.004
(24) Gauthier,B.M.;Davidson,D.F.;Hanson,R.K.Combust.Flame2004,139,300.doi:10.1016/j.combustflame.2004.08.015
(25) Vanhove,G.;Petit,G.;Minetti,R.Combust.Flame2006,145,512.doi:10.1016/j.combustflame.2006.01.002
(26) Bakali,A.E.;Delfau,J.L.;Vovelle,C.Combust.Sci.Technol.1998,140,69.doi:10.1080/00102209808915768
(27) Inal,F.;Senkan,S.M.Combust.Flame2002,132,16.
