川芎及土壤中毒死蜱残留检测提取方法
2014-06-13穆向荣马逾英袁茂华蒋桂华
穆向荣, 马逾英, 袁茂华, 马 羚, 蒋桂华, 曹 赟
成都中医药大学药学院,国家中医药管理局中药品种质量鉴定科研三级实验室,成都611137
川芎为常用中药,来源于伞形科植物川芎Ligusticum chuanxiong Hort.的干燥根茎,具有活血祛瘀、行气开郁、止痛等功效[1]。川芎除供药用外,还可用作食品、美白护肤品、洗头液、饲料和烟用香料添加剂等[2],应用范围广泛,需求量大。川芎目前均为人工栽培,在生长过程中,易遭受多种虫害,特别是蛴螬、川芎茎节蛾咬食川芎茎干和根茎,对川芎产量和质量造成极大威胁。据调查,目前在川芎生产过程中,产地药农多使用毒死蜱来防治虫害。
毒死蜱(chlorpyrifos),化学名称为O,O-二乙基-O-(3,5,6,-三氯-2-吡啶基)硫代磷酸酯,是一种广谱杀虫剂,具有胃毒、触杀作用。据报道,毒死蜱已在世界100多个国家登记应用[3]。但毒死蜱能明显引起人和动物红细胞胆碱酯酶的抑制[4],蓄积于神经系统后导致人出现恶心、头晕,甚至神志不清等症状,高浓度暴露可造成呼吸麻痹和死亡[5]。因此国内外越来越重视毒死蜱残留问题及其影响:日本肯定列表制度中规定了毒死蜱在蔬菜中的最高残留限量值为0.01 ~0.05 mg/kg,我国规定的无公害蔬菜中的最高残留限量值为l mg/kg[6]。农药残留的测定属于痕量分析,样品的处理方法至关重要。有关水果、蔬菜等作物中的毒死蜱残留提取及检测方法已有较多研究[7~12],但川芎及其土壤中毒死蜱残留提取方法的研究尚未见报道。本文建立了川芎植株和土壤中农药毒死蜱残留检测的最佳提取方法,为探讨毒死蜱在川芎及土壤中的残留动态奠定基础。
1 材料与方法
1.1 供试材料
川芎(Ligusticum chuanxiong Hort),伞形科植物,由成都中医药大学马逾英教授鉴定。
川芎和土壤样品采集于彭州市敖平镇川芎GAP基地,未使用农药毒死蜱,作为空白样品。
田间试验小区按推荐剂量100g/667m2喷施农药毒死蜱,2 d后采集川芎和土壤样品,作为测定样品。
1.2 标准品与试剂
毒死蜱标准品,纯度>98%,购于北京上立方联合化工技术研究院;正十八烷,购自Accustandard Inc.;无水硫酸钠、弗罗里硅土、乙腈、丙酮、乙酸乙酯均为分析纯。
1.3 仪器与主要设备
气相色谱质谱联用仪(7890A-5975C),配有DB-5MS 色谱柱(30 m × 0.25 mm × 0.25 μm);RE-5203型旋转蒸发仪(上海亚荣生化仪器厂);SHB-Ⅲ型循环水式多用真空泵(郑州长城科工贸有限公司);TD6001型电子天平(天津天与仪器厂);HH-S6型数显恒温水浴锅(河南金博仪器制造有限公司);DCY-12G型氮吹仪(青岛海科仪器有限公司);KQ3200B型数控超声波清洗器(上海越众仪器设备有限公司);层析柱(成都大法玻璃加工有限公司),规格为20cm×1cm(内径)。
1.4 质谱条件
进样口温度为230℃,检测器温度为300℃;载气为高纯氮气(纯度99.999%),流速15mL/min。升温程序:初始温度为100℃,保持 1min;以20℃/min升至 200℃,保持 1min;以 0.5℃/min升至201℃,保持1min;以10℃/min升至210℃,以20℃/min升至240℃,保持2min。进样方式为10∶1分流进样。进样体积:1 μL。电离方式EI,电离能量70 eV;离子源温度230℃;质量扫描范围40~400 amu;选择离子(SIM)时毒死蜱的特征离子质量数:197、258、314;正十八烷的特征离子质量数:57、71、254;溶剂延迟:6min。
1.5 标准溶液配制
1.5.1 内标物溶液的配制 精密称取正十八烷4.16 mg置10mL容量瓶中,加丙酮溶解并稀释至刻度,摇匀。
1.5.2 毒死蜱标准品溶液的配制 精密称取毒死蜱标准品5.39 mg置25mL容量瓶中,加丙酮溶解并稀释至刻度,摇匀。制成0.215 6 mg/mL的标准品贮备液。分别精密吸取标准品贮备液0.05mL、0.1mL、0.5mL、1mL、5mL和 10mL 于100mL容量瓶中,加丙酮溶解并稀释至刻度,摇匀。精密吸取不同浓度的标准品溶液4.80mL,再准确加入0.20mL的内标物溶液,混匀,配制成毒死蜱标准品系列溶液。
1.6 正交试验
为确定用于川芎地上部分、根茎及其栽培土壤中的毒死蜱残留检测的最佳提取方法,以提取溶剂、提取时间、提取次数和溶剂量为四因素,设计四因素三水平正交试验(见表1、表2)。分别用毒死蜱处理空白川芎样品和空白土壤样品,按正交试验设计的提取方法分组提取后,GC-MS法检测,分析毒死蜱回收率并得出最佳提取方法。

表1 川芎地上部分和根茎中毒死蜱残留提取正交试验设计因素水平表Table 1 Factors and levels of orthogonal design for chlorpyrifos residue extraction test in aerial parts and rhizome of Ligusticum chuanxiong.

表2 土壤中毒死蜱残留提取正交试验因素水平表Table 2 Factors and levels of orthogonal design for chlorpyrifos residue extraction test in soil.
1.7 正交试验样品制备
1.7.1 川芎样品溶液的制备 分别准确称取10 g捣碎的空白川芎样品的地上部分和根茎,按质量分数1.01 mg/kg加入毒死蜱标准品贮备液。静置0.5 h后,以正交试验设计分组进行提取。将各组提取液用无水硫酸钠去水后,减压浓缩至近干。用5mL正己烷-乙酸乙酯(体积比1∶1)溶解残渣,转入20cm×1cm的Florisil柱(自制:从下至上分别为4 g弗罗里硅土、0.5 g活性炭)中后用40mL正己烷-乙酸乙酯(体1∶1)洗脱,收集流出液。收集的洗脱液经减压浓缩、氮吹至近干,用2mL丙酮溶解残渣,过膜后用于GC-MS进样检测。
1.7.2 土壤样品溶液的制备 将采取的空白土壤样品风干,粉碎过1号筛。准确称取10 g后,按质量分数1.01 mg/kg加入毒死蜱标准品贮备液。静置0.5 h后,以正交试验设计分组进行提取。将各组提取液减压浓缩至近干后,用5mL丙酮溶解残渣,氮吹至近干,用2mL丙酮溶解,过膜后用于GC-MS进样检测。
1.8 最佳提取条件用于实际样品的测定
根据正交试验结果,确定川芎和土壤中毒死蜱残留的最佳提取方法。按最佳提取方法提取1.2中的待测样品。采用1.7中的浓缩净化方法制备供试品溶液,按1.4中的GC-MS条件测定。
1.9 方法学验证
1.9.1 重复性实验 取施药处理2 d后的川芎和土壤样品各6份,按正交试验确定的最佳提取条件提取毒死蜱,制备供试样品,GC-MS测定。
1.9.2 加标回收率实验 准确称取川芎和土壤样品各 10 g,按低(0.1 mg/kg)、中(0.5 mg/kg)、高(1 mg/kg)水平加入毒死蜱农药标准品溶液,按最佳提取条件,制备供试样品,GC-MS测定,计算回收率。
2 结果与分析
2.1 标准曲线的绘制
毒死蜱标准品质量色谱图如图1所示。
以毒死蜱与正十八烷的峰面积之比为纵坐标Y,以毒死蜱与正十八烷的浓度之比为横坐标X进行线性回归分析。回归方程为Y=2.409X-0.001 86,R2=0.999 3,结果显示,在 0.215 6 ~21.56 mg/L浓度范围内呈良好的线性关系(图2)。

图1 毒死蜱标准品质量色谱图Fig.1 The EIC of chlorpyrifos.
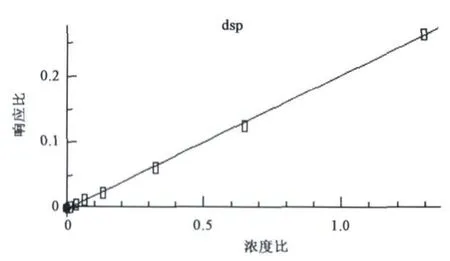
图2 毒死蜱标准曲线图Fig.2 Standard curve of chlorpyrifos.
2.2 川芎地上部分毒死蜱残留提取方法的正交试验
川芎地上部分毒死蜱残留提取与提取溶剂、提取时间、提取次数和溶剂量有关。由表3、表4可知,各因素对毒死蜱回收率均有极显著影响。虽然丙酮提取效果较乙腈好,但采用丙酮提取时,提取杂质多,提取液中水分不易除去导致实验耗时长,方差分析显示两者无显著差异,故确定提取溶剂为乙腈。提取3次较提取2次的毒死蜱回收率高,但二者无显著性差异,为简化提取步骤,故确定提取次数为2次。最佳提取条件为A1B1C2D2,即:提取溶剂为乙腈、提取时间为15min、提取次数为2次、溶剂加入量为30mL。

表3 川芎地上部分毒死蜱残留提取正交试验结果Table 3 Orthogonal test result of the extraction of chlorpyrifos residue in the aerial parts of Ligusticum chuanxiong.

表4 川芎地上部分毒死蜱残留提取正交试验结果方差分析Table 4 Variance analysis of orthogonal test result of the extraction of chlorpyrifos residue in the aerial parts of Ligusticum chuanxiong.
2.3 川芎根茎毒死蜱残留提取方法的正交试验
实验考察提取溶剂、提取时间、提取次数和溶剂量对川芎根茎中毒死蜱残留提取的影响。表5、表6实验结果及方差分析显示,除提取次数对毒死蜱回收率有显著差异外,其余因素均有极显著差异,且D(溶剂量)影响最大。多重比较后确定最佳提取条件同2.2。
2.4 川芎土壤中毒死蜱残留提取方法的正交实验
川芎土壤中毒死蜱残留提取效果与提取溶剂、提取时间、提取次数和溶剂量有关。表7、表8结果说明,除提取溶剂对毒死蜱回收率有极显著差异外,其余各因素均无显著性差异,以提取时间的影响作用最小。最终确定最佳提取条件为E3F1G2H2,即:提取溶剂为乙酸乙酯、提取时间为30min、提取次数为 2次、溶剂加入量为100mL。

表5 川芎根茎毒死蜱残留提取正交试验结果Table 5 Orthogonal test result of the extraction of chlorpyrifos residue in rhizome of Ligusticum chuanxiong.
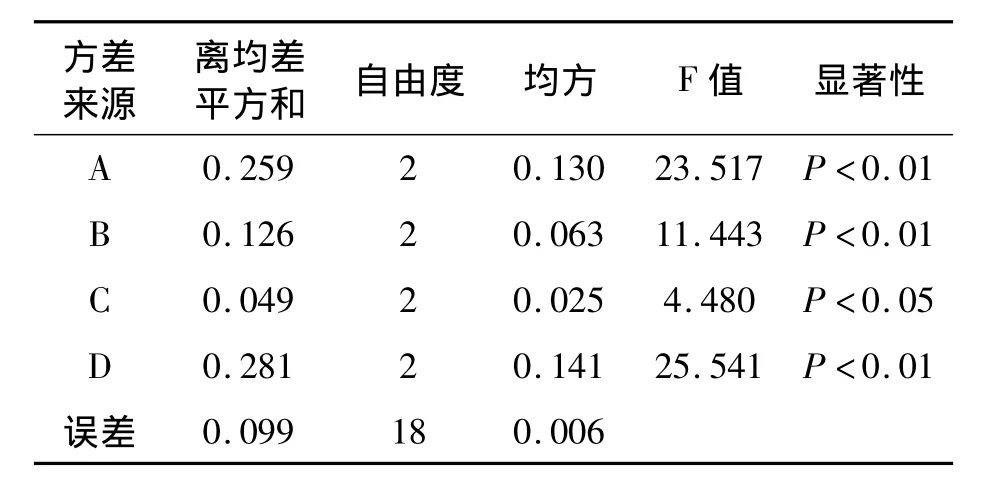
表6 川芎根茎毒死蜱残留提取正交试验结果方差分析Table 6 Variance analysis of orthogonal test result of the extraction of chlorpyrifos residue in rhizome of Ligusticum chuanxiong.
2.5 实际样品测定效果
通过正交实验建立了川芎地上部分、根茎以及栽培土壤样品中的毒死蜱的最佳提取方法,用于GC-MS法检测毒死蜱残留。该提取方法应用于实际采集样品的检测的效果加以测试。GC-MS检测结果如图3、表9所示。
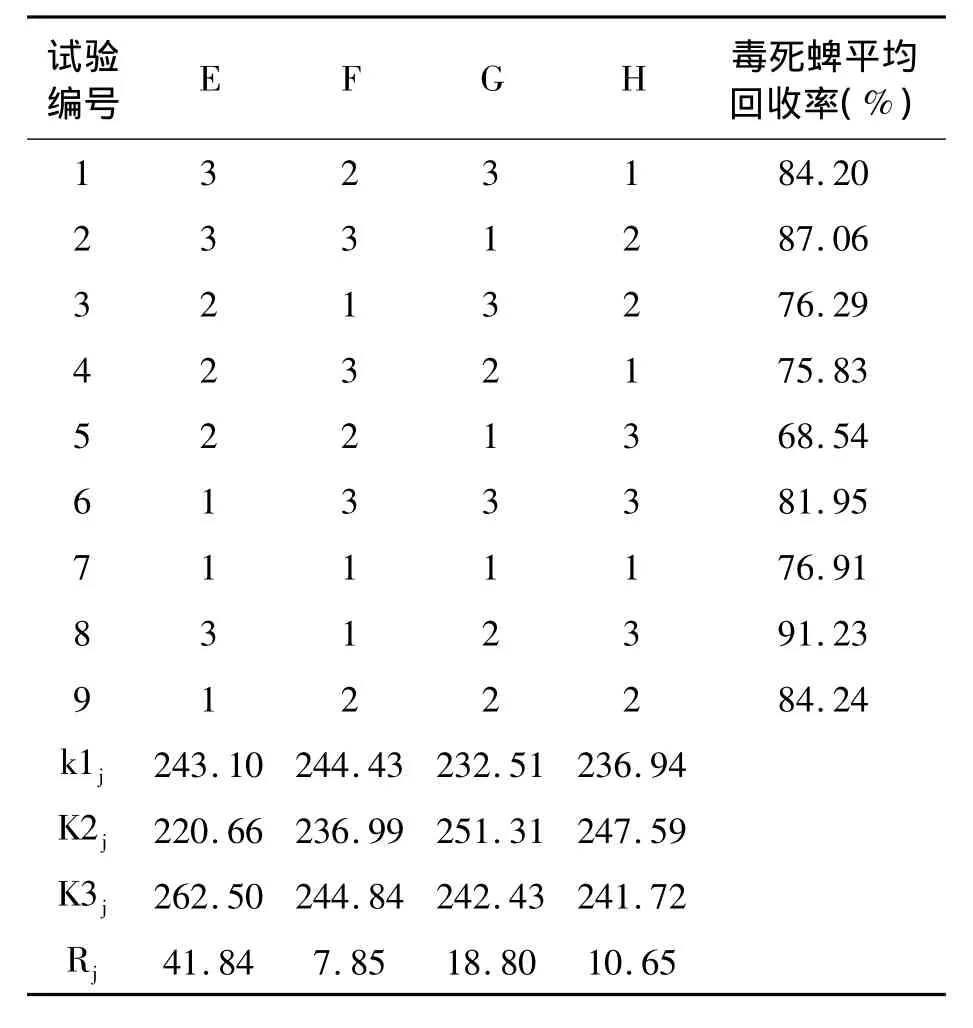
表7 土壤中毒死蜱残留提取正交试验结果Table 7 Orthogonal test result of the extraction of chlorpyrifos residue in soil.

表8 土壤中毒死蜱残留正交试验结果方差分析Table 8 Variance analysis of orthogonal test result of the extraction of chlorpyrifos residue in soil.
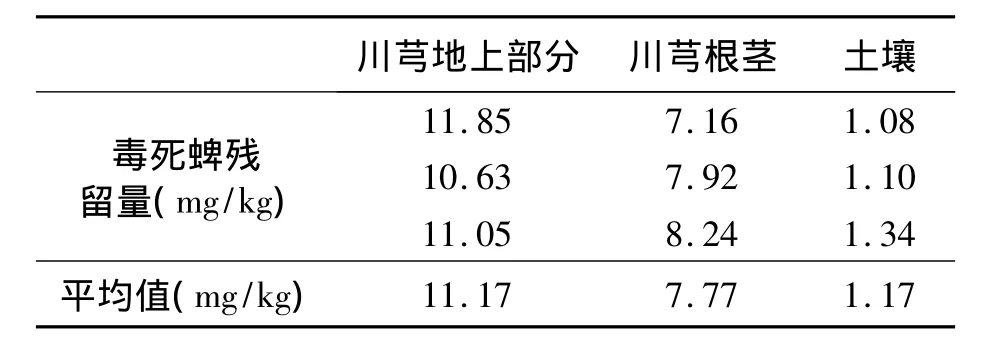
表9 川芎植株和土壤中的毒死蜱残留量Table 9 Residues of chlorpyrifos in Ligusticum chuanxiong plant and soil.
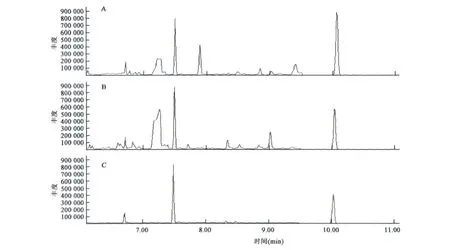
图3 实际样品中毒死蜱残留的质量色谱图Fig.3 The EIC of chlorpyrifos extracted in actual samples.
2.6 方法学验证
2.6.1 重复性 川芎及土壤中毒死蜱残留检测提取方法的重复性结果见表10。川芎地上部分、根茎和土壤中毒死蜱的平均残留量分别为10.73 mg/kg、7.40 mg/kg 和 1.18 mg/kg;相对标准偏差 RSD 分别为 4.08%、5.80% 和 3.45%(n=6),符合实际农药残留分析要求[13]。
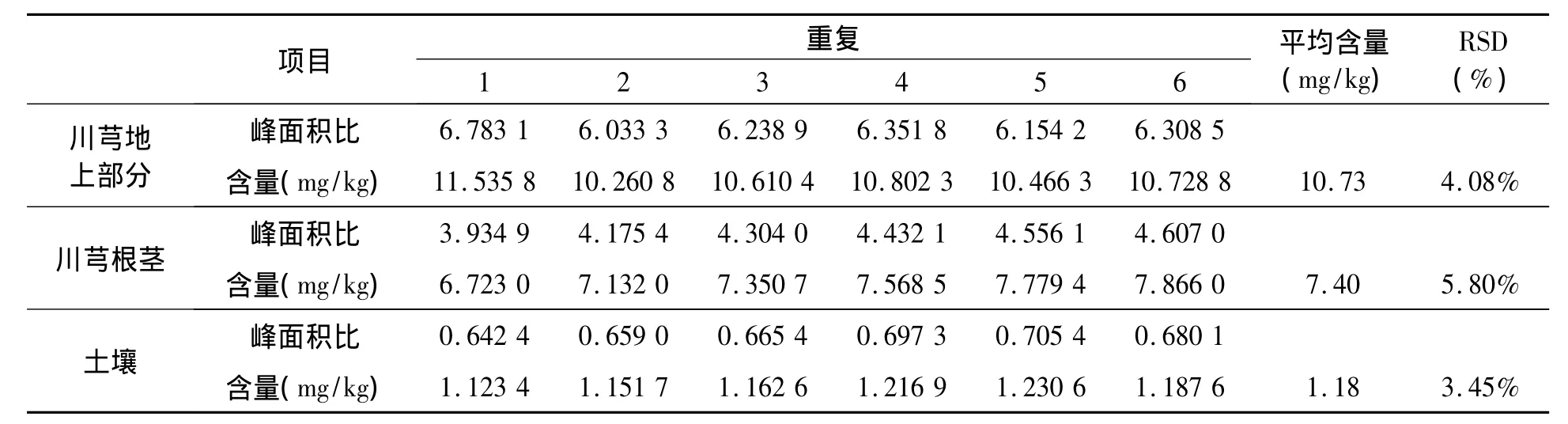
表10 重复性实验结果Table 10 Result of repeatability experiments.
2.6.2 加标回收率 川芎及土壤中毒死蜱残留检测提取方法的回收率结果见表11。川芎地上部分毒死 蜱回收率分 别 为 99.48%、84.03% 和101.99%,RSD 分别为5.43%、3.65%和3.44%;根茎分别为88.25%、86.68%和 102.17%,RSD 分别为5.81%、0.68%和 2.03%;土壤分别为 72.86%、95.89%和104.01%,RSD 分别为4.97%、4.58%和4.69%(n=3)。结果符合农药残留分析要求[13]。

表11 加标回收率实验Table 11 Recovery experiments.
2.7 毒死蜱残留提取方法的确定
2.7.1 川芎地上部分及根茎中毒死蜱残留检测的提取方法 准确称取10 g捣碎的川芎样品的地上部分和根茎于50mL锥形瓶中,加入30mL乙腈,超声提取15min,提取2次。将提取液转入装有无水硫酸钠的分液漏斗中,充分振荡,静置分层,弃去水层。有机相待浓缩后净化。
2.7.2 土壤中毒死蜱残留检测的提取方法 准确称取风干过筛后的土壤10 g于250mL锥形瓶中,加入100mL乙酸乙酯震荡提取30min,重复上述过程一次。将提取液滤过至250mL圆底烧瓶后,减压浓缩后过膜待检测。
3 讨论
川芎植株中的干扰物质复杂多样,合理的提取方法及净化方法等前处理技术是准确测定毒死蜱残留量的重要前提。本实验前期,比较了超声波提取法和振荡提取法提取毒死蜱的效率。超声波提取法耗时短,所需溶剂量小,且对川芎地上部分和根茎中毒死蜱的提取回收率分别为93.61%和89.20%,均达到农药残留分析要求。但采用超声波提取土壤中的毒死蜱时,其回收率(77.03%)远低于振荡法(86.72%)。因此,最终以超声波提取法提取川芎植株中的毒死蜱,以振荡法提取土壤中的毒死蜱。
在实验过程中发现川芎植株中提取杂质较多,为满足毒死蜱定量分析的需要,考察了丙酮∶正己烷(1∶9)、乙酸乙酯∶正己烷(1∶1)两种淋洗剂的净化回收率。比较结果发现:40mL乙酸乙酯∶正己烷(1∶1)淋洗后,川芎地上部分和根茎中的毒死蜱净化回收率均达到90%以上,表明该净化方法切实可行。
在此基础上,本文通过考察提取溶剂、提取时间、提取次数和溶剂量的不同水平下毒死蜱的回收率,筛选出川芎地上部分、根茎和土壤中毒死蜱残留检测的最佳提取条件,并建立了相应的提取方法,经方法学验证,所确定的提取方法均达到农药残留分析要求,方法简单实用,可用于中药川芎中以及土壤中毒死蜱残留的GC-MS检测,以动态分析毒死蜱在川芎植株和土壤中的残留情况。
[1]国家药典委员会.中国药典-一部[M].北京:中国医药科技出版社,2010.
[2]侯嘉,马逾英.传统中药川芎的开发利用[J].时珍国医国药,2007,18(3):711 -713.
[3]Chen C,Qian Y Z,Liu X J et al..Risk assessment of chlorpyrifos on rice and cabbage in China[J].Regul.Toxicol.Phamacol.,2012,62(1):125 -130.
[4]Zhao Q,Dourson M,Gadagbui B.A review of the reference dose for chlorpyrifos[J].Regul.Toxicol.Pharmacol.,2006,44(2):111–124.
[5]秦钰慧,王以燕.美国关于毒死蜱的最新决定[J].农药,2000,39(8):45 -45.
[6]杜海云,张倩,马林.毒死蜱在4种大棚蔬菜上的残留动态研究[J].山东农业科学,2009,(10):58.
[7]张心明.固相萃取—气相色谱法测定韭菜中毒死蜱的残留量[J].现代农业科技,2008,(3):61 -62.
[8]汪军.GC-MS定性定量分析出口西兰花样品中毒死蜱的农药残留量[J].现代农药,2002,(1):23 -24.
[9]梁 俊,李海飞,赵政阳,等.苹果中毒死蜱农药残留的GCNPD测定方法[J].西北农林科技大学学报:自然科学版,2006,34(7):61 -64.
[10]何岸飞,周尊隆.设施番茄植株中百菌清和毒死蜱残留分析方法研究[J].环境科学与技术,2011,34(7):148-151.
[11]王树娟,李 娇,张 晖,等.气相色谱法检测毒死蜱在桃上的残留[J].青岛科技大学学报:自然科学版,2011,32(4):365-368.
[12]中华人民共和国国家质量监督检验检疫总局.SN/T 2158-2008,进出口食品中毒死蜱残留量检测方法[S].北京:中国标准出版社,2008.
[13]钱传范.农药残留分析原理与方法[M].北京:化学工业出版社,2011.
