耳蜗局部应用NR2B受体阻滞剂对水杨酸钠致豚鼠螺旋神经节细胞损伤的拮抗作用*
2014-06-12刘渊尹时华黄训健周琦舒竞铖韦顺莲
刘渊 尹时华 黄训健 周琦 舒竞铖 韦顺莲
耳鸣、听力下降和言语认知能力减低是水杨酸钠对听觉系统毒副作用最明显的三大症状[1],其中,耳鸣及听力下降的原因还不明确。早期研究发现,大剂量给予水杨酸钠可引起豚鼠螺旋神经节细胞凋亡以及听力损失,且凋亡率与听力损失程度呈平行关系[2],但其凋亡机制还不甚明了。有研究表明,N-甲基-D-天冬氨酸受体(NMDA受体)过度活化引起大量Ca2+内流是水杨酸钠致耳鸣的重要原因[3,4],细胞内Ca2+超载与细胞凋亡有着密切联系[5],那么,NMDA受体过度激活是否也参与了水杨酸钠致豚鼠螺旋神经节细胞凋亡的过程呢?为此,本研究通过在豚鼠圆窗龛局部给予艾芬地尔(ifenprodil)(NMDA受体NR2B亚型的一种特异性受体阻滞剂[6])联合腹腔注射水杨酸钠,通过检测给药前后各组豚鼠ABR阈值、耳蜗螺旋神经节细胞内caspase-3蛋白的表达及螺旋神经节细胞凋亡率,探讨耳蜗局部特异性阻断NR2B受体是否可以拮抗水杨酸钠致豚鼠螺旋神经节细胞的损伤。报告如下。
1 材料与方法
1.1实验动物及分组处理 实验动物为耳廓反应灵敏、未暴露于噪声及耳毒性药物环境的健康花色豚鼠(广西医科大学动物实验中心提供),实验前,应用美国 TDT(Tucker Davis Technologies) 电生理测试系统进行双侧 ABR 测试,选取反应阈小于40 dB SPL的豚鼠48只,随机分为四组,每组12只。 Ⅰ组为空白对照组;Ⅱ组为人工外淋巴液(artificial perilymph,APL)组,左耳圆窗龛注人APL 60 μl;Ⅲ组为水杨酸钠组,左耳圆窗龛注入APL 60 μl,腹腔注射水杨酸钠;IV组为艾芬地尔组,左耳圆窗龛注入溶于APL的艾芬地尔(10 μmol/l)60 μl后,腹腔注射水杨酸钠。于水杨酸钠给药前12 h圆窗龛给药,水杨酸钠注射量为400 mg·kg-1·d-1,连续注射 7 天。
1.2听性脑干反应检测 于实验前及给药结束后动物处死前用美国TDT系统(Tucker Davis Technologies)对豚鼠双耳分别进行 ABR 测试。1%戊巴比妥钠溶液对豚鼠行腹腔注射麻醉 (35 mg/kg),而后将其置于屏蔽仓内,记录电极扎入额顶正中,参考电极接同侧耳廓,鼻尖接地。插入式耳机给声,短声刺激,刺激率21.1次/秒,带通滤波 300~3 000 Hz ,观察时程20 ms ,叠加次数1 024次。最大输出为110 dB SPL, 以10或5 dB递减或递增,以能引出明确的、可重复波III的最小刺激强度为ABR反应阈。
1.3豚鼠圆窗龛局部给药 用1%戊巴比妥钠35 mg/kg对豚鼠进行腹腔注射麻醉后,固定于自制的动物固定架上。常规消毒,左耳后下方做一弧形切口,钝性分离组织,暴露听泡,乳突尖骨质钻孔,看清圆窗龛,将浸泡于60 μl含有艾芬地尔(Sigma公司,10 μmol/L)的人工外淋巴液(APL,含NaCl 137、KCl 5、CaCl22、NaH2PO41 、Glucose 11、NaHCO312、MgCl21,pH 7.4±0.2)中的明胶海绵置于圆窗龛,用骨蜡封闭听泡,逐层缝合。
1.4标本取材及制备 最后一次ABR检测(于最后一次水杨酸钠给药后的12 h时进行)结束后立即行过量麻醉断头处死豚鼠,迅速取出颞骨,打开听泡,暴露耳蜗,置于4%多聚甲醛0.01 M PBS(pH=7.4)固定液中,在解剖显微镜下挑破圆窗,取出镫骨,于蜗尖处挑开一小孔,用微玻璃吸管由蜗顶灌注固定液1~2 min,可见固定液经前庭阶和鼓阶由前庭窗和圆窗流出,再将标本浸置于该固定液中,置4 ℃冰箱内继续固定6小时。0.1 M PBS浸洗过夜。10%脱钙液脱钙4周。梯度乙醇脱水、二甲苯透明、石蜡定向包埋后平行耳蜗纵轴连续切片,片厚5 μm,分别进行TUNEL阳性细胞检测(每组6只)及caspase-3免疫组织化学染色检测(每组6只)。
1.5Caspase-3免疫组织化学染色 切片置于60 ℃恒温烤箱30 min;常规石蜡切片二甲苯脱蜡和梯度酒精水化;自来水冲洗,0.01M PBS(pH7.4)浸洗3次×3 min;切片置于0.01 M枸橼酸缓冲液(pH=6.0)放入高压锅高压修复2 min,0.01 M PBS浸洗3次×3 min;3%H2O2室温孵育10 min,0.01 M PBS浸洗3次×3 min;每个标本滴加50 μl(1:50)抗caspase-3兔源单克隆抗体(Proteintech公司)4 ℃过夜,0.01 M PBS浸洗3次×5 min;滴加山羊抗兔IgG/辣根过氧化物酶标记(中杉金桥公司),置于37 ℃恒温烤箱中孵育30 min,0.01 M PBS浸洗3次×5 min;DAB(中杉金桥公司)显色,自来水冲洗终止反应;苏木素复染,自来水冲洗终止反应,自来水反蓝10 min;梯度酒精脱水,二甲苯透明,烤干,中性树脂封片。
1.6TUNEL染色方法 切片置于60 ℃恒温烤箱30 min;常规石蜡切片二甲苯脱蜡和梯度酒精水化;自来水冲洗,PBS浸洗3次×3 min;新鲜3% H2O2甲醇溶液室温处理10 min,灭活内源性过氧化物酶,0.01 M PBS(pH7.4)浸洗3次×3 min;蛋白酶K消化,37 ℃孵育30 min,0.01 M PBS浸洗3次×3 min;吸水纸吸干周围液体,加50 μl TUNEL反应混合物(Roche公司),置于湿盒中37 ℃孵育60 min,0.01 M PBS浸洗3次×5 min;加转换剂POD(Roche公司),置于湿盒中37 ℃孵育30 min,0.01 M PBS浸洗3次×5 min;DAB(中杉金桥公司)显色,自来水冲洗终止反应;苏木素复染,自来水冲洗终止反应,自来水反蓝;梯度酒精脱水,二甲苯透明,烤干,中性树脂封片。
TUNEL阳性反应:光镜下正常螺旋神经节细胞核呈蓝色,凋亡螺旋神经节细胞核呈深浅不一的棕黄色,并且出现核固缩,染色质浓集。螺旋神经节细胞凋亡指数(apoptosis index,AI)=TUNEL阳性着色SGN细胞数/总SGN细胞数。
1.7图像分析及统计学方法 caspase-3染色切片在400倍视野下由Image-Pro Plus 6.0 专业图像分析软件测定累积光密度值(integrated optical density , IOD)和面积(area),并计算平均光密度值 (average optical density,AOD) ,平均光密度值越高,表达水平越高,凋亡效应用凋亡率评价。组间进行单因素方差检验,组内进行SNK检验。所有实验数据资料均采用SPSS 16.0专用统计软件包分析。
2 结果
2.1给药后各组动物ABR阈值比较 给药后I、II组动物ABR阈值分别为31.67±5.16和33.33±5.17 dB SPL,I、II组比较差异无统计学意义(P>0.05),III组ABR阈值为64.17±7.36 dB SPL,较I、II组明显升高(P<0.01),IV组为49.17±5.85 dB SPL,较I、II组显著升高(P<0.01),但较III组显著降低(P<0.01)。
2.2各组Caspase-3表达比较 I、II组动物螺旋神经节细胞中无明显着色,其平均光密度值分别为0.105 7±0.008 1和0.106 3±0.007 2,III组SGN细胞着色明显,平均光密度值为0.3251±0.015 8,IV组SGN细胞着色明显减弱,平均光密度值为0.197 3±0.014 5(图1)。
2.3各组TUNEL染色结果 I、II组动物螺旋神经节细胞无明显凋亡,凋亡率分别为4.35%±1.49%和5.25%±1.47%,III组SGN细胞凋亡明显,凋亡率为76.62%±2.55%,IV组SGN细胞凋亡率为35.29%±3.51%,较III组明显降低(图2)。
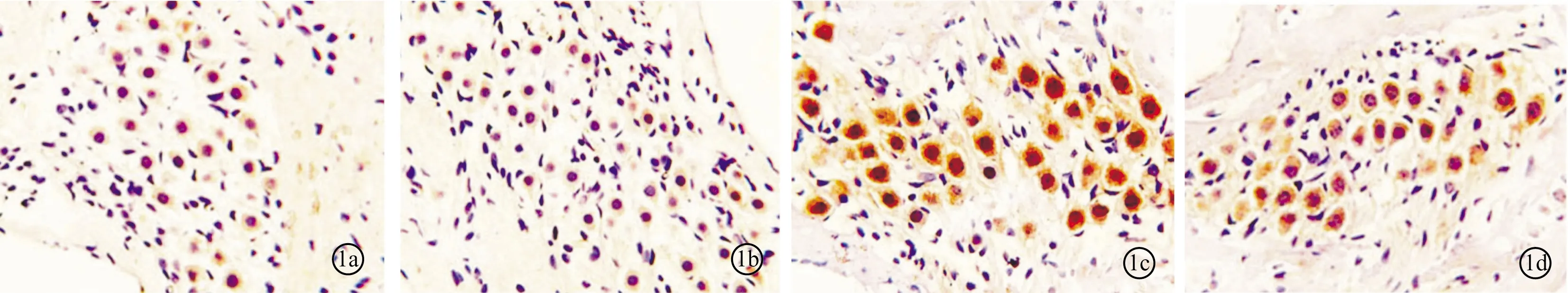
图1 各组动物螺旋神经节细胞中Caspase-3的表达 a~d分别为I~IV组(×400)

图2 各组动物螺旋神经节细胞凋亡染色结果 a~d分别为I~IV组(×400)
3 讨论
螺旋神经节细胞是联系耳蜗与听觉中枢的枢纽,其中95%为Ι型螺旋神经节,它与内毛细胞形成的突触连接以谷氨酸为神经递质将耳蜗编码的听觉信息传入听觉中枢。正常情况下,这种突触间的递质传递是由α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid receptor, AMPAR)介导的[7]。值得注意的是,螺旋神经节细胞表面也有NMDA受体表达,虽然该受体并不参与正常情况下神经递质的传递,但研究显示这些受体在耳蜗兴奋性毒性损伤的突触修复过程中发挥重要作用[8]。NMDA受体在神经系统发育过程中发挥着重要的生理作用,其可调节神经元的存活,调节神经元树突、轴突结构发育及参与突触可塑性的形成等[9]。NMDA受体属于配体门控离子通道,是由不同的亚单位组成的四聚体或五聚体,编码这些亚单位的基因属3个家族:NR1、NR2(包括NR2A~D)、NR3(包括NR3A、B)。NR1是NMDA受体复合物的功能性亚单位,单独的NR2或NR3不能形成功能性受体,但它们可以和NR1聚合形成功能性复合物,由不同的亚单位组成的受体往往表现出不同的生理学和药理学特性,最典型的就是由NR1和NR2B亚单位形成异聚体NR1/NR2B,其对Ca2+有高通透性[10],可被艾芬地尔选择性阻断。
研究发现NMDA受体的激活是细胞死亡的主要原因,这种细胞死亡继发于急性兴奋性的损伤[11]。生理状态下各谷氨酸优先兴奋NMDA受体,在病理状态下,某些不被激活的NR1/NR2B受体亚型被激活,导致细胞凋亡[12]。NR2B受体的高表达可能改变NMDA受体的结构,功能及组成的改变,使离子通道的通透性异常增高,导致Ca2+超载,病理性Ca2+内流会导致Ca2+依赖的一氧化氮合酶(neuronal nitric oxide synthase,nNOS)和磷脂酶A2的激活以及线粒体的功能失调[13~15],从而引起活性氧/氮及自由基的增加,最终导致细胞损伤。另外,线粒体内Ca2+上调可以提高ROS产物及细胞色素C的释放,这些产物是凋亡小体的变构及caspase-3活化所必需的,其结果是导致细胞凋亡[16]。caspase-3是凋亡发生过程中时常被激活的一种蛋白酶,能催化细胞中许多关键蛋白质的水解,caspase-3参与所有细胞凋亡过程中染色质的凝集和DNA碎裂的过程。因此,它是细胞裂解及凋亡小体形成这一特殊过程的重要参与者[17]。
艾芬地尔是一种可与NMDA受体NR2B亚型高度选择性结合的有机化合物,它通过阻断NMDA受体的功能从而在动物大脑缺血模型及损伤模型中发挥着神经保护作用;同时,它也在由谷氨酸及低氧损伤所致的细胞毒性过程中发挥着重要的保护作用[18]。有研究显示,艾芬地尔可以阻断由谷氨酸及NMDA引起的海马细胞及视网膜细胞的兴奋性损伤[19]。但艾芬地尔的这种保护作用的机制还存在争议,以Tamura为代表的学者认为亚精胺等内源性多胺可与结合于NMDA受体复合结构的多胺调节位点相互作用,从而促进谷氨酸对NMDA受体的激活过程,而艾芬地尔正是通过阻断多胺对这一激活过程的阳性调节作用从而非竞争性的阻断NMDA受体的功能[20~22]。而另一些学者[23]则认为艾芬地尔并不是与多胺位点相互作用而是通过直接与NMDA受体作用发挥其细胞保护作用的。
本研究通过观察腹腔注射水杨酸钠后豚鼠耳蜗局部应用NR2B受体阻滞剂艾芬地尔后,SGN中caspase-3的表达情况及TUNEL法检测SGN凋亡率,发现艾芬地尔明显阻断了水杨酸钠引起的螺旋神经节细胞的凋亡,其机制可能与艾芬地尔选择性的与NMDA受体的NR2B亚型结合,从而抑制由NMDA受体过度兴奋促发的Ca2+内流有关。有研究显示[24],在离体培养的大鼠海马神经元中加入艾芬地尔可以阻断高电压激活钙通道,这种作用正是通过阻断NMDA受体实现的。
目前,对艾芬地尔的细胞保护作用机制还知之甚少,目前国内外的研究还仅仅停留在其与NMDA受体相互作用的水平,但这一保护过程的具体分子作用机制还有待进一步的研究。
4 参考文献
1 Cazals Y. Auditory sensori-neural alterations induced by salicylate[J]. Prog Neurobiol, 2000,62:583.
2 Feng H, Yin SH, Tang AZ, et al. Salicylate initiates apoptosis in the spiral ganglion neuron of guinea pig cochlea by activating caspase-3[J]. Neurochemical Research, 2011,36:1 108.
3 Ruel J, Chabbert C, Nouvian R, et al.Salicylate enables cochlear arachidonic-acid-sensitive NMDA receptor responses[J]. Journal of Neuroscience, 2008,28:7 313.
4 Guitton M J, Caston J, Ruel J, et al.Salicylate induces tinnitus through activation of cochlear NMDA receptors[J]. J Neurosci, 2003,23:3 944.
5 Hajnoczky G, Davies E, Madesh M. Calcium signaling and apoptosis[J]. Biochem Biophys Res Commun, 2003,304:445.
6 Williams K. Ifenprodil discriminates subtypes of the N-methyl-D-aspartate receptor: selectivity and mechanisms at recombinant heteromeric receptors[J]. Mol Pharmacol, 1993,44:851.
7 Glowatzki E, Fuchs PA. Transmitter release at the hair cell ribbon synapse[J]. Nat Neurosci, 2002,5:147.
8 d'Aldin CG, Ruel J, Assie R, et al.Implication of NMDA type glutamate receptors in neural regeneration and neoformation of synapses after excitotoxic injury in the guinea pig cochlea[J]. Int J Dev Neurosci, 1997,15:619.
9 Nowak L, Bregestovski P, Ascher P, et al. Magnesium gates glutamate-activated channels in mouse central neurones[J]. Nature, 1984,307:462.
10 娄向新,袁崇刚. Nmda受体亚单位nr2b的结构、功能特性及其表达与调控[J]. 生命科学研究, 2004(S2):40.
11 Arundine M,Tymianski M. Molecular mechanisms of glutamate-dependent neurodegeneration in ischemia and traumatic brain injury[J]. Cell Mol Life Sci, 2004,61:657.
12 Liu Y, Wong TP, Aarts M, et al. NMDA receptor subunits have differential roles in mediating excitotoxic neuronal death both In vitro and in vivo[J]. Journal of Neuroscience, 2007,27:2 846.
13 Chan PH. Reactive oxygen radicals in signaling and damage in the ischemic brain[J]. J Cereb Blood Flow Metab, 2001,21:2.
14 Serteser M, Ozben T, Gumuslu S, et al. The effects of NMDA receptor antagonist MK-801 on lipid peroxidation during focal cerebral ischemia in rats[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2002,26:871.
15 Arundine M,Tymianski M.Molecular mechanisms of calcium-dependent neurodegeneration in excitotoxicity[J]. Cell Calcium, 2003,34:325.
16 Nicholls DG. Mitochondrial dysfunction and glutamate excitotoxicity studied in primary neuronal cultures[J]. Curr Mol Med, 2004,4:149.
17 Porter AG, Janicke RU. Emerging roles of caspase-3 in apoptosis[J]. Cell Death Differ, 1999,6:99.
18 Williams K. Ifenprodil, a novel NMDA receptor antagonist: site and mechanism of action[J]. Curr Drug Targets, 2001,2:285.
19 Zhang S, Kashii S, Yasuyoshi H, et al. Protective effects of ifenprodil against glutamate-induced neurotoxicity in cultured retinal neurons[J]. Graefes Arch Clin Exp Ophthalmol, 2000,238:846.
20 Carter CJ, Lloyd KG, Zivkovic B, et al. Ifenprodil and SL 82.0715 as cerebral antiischemic agents. III. Evidence for antagonistic effects at the polyamine modulatory site within the N-methyl-D-aspartate receptor complex[J]. J Pharmacol Exp Ther, 1990,253:475.
21 Sprosen TS,Woodruff GN.Polyamines potentiate NMDA induced whole-cell currents in cultured striatal neurons[J]. Eur J Pharmacol, 1990,179:477.
22 Tamura Y,Sato Y,Yokota T,et al.Ifenprodil prevents glutamate cytotoxicity via polyamine modulatory sites of N-methyl-D-aspartate receptors in cultured cortical neurons[J].J Pharmacol Exp Ther,1993,265:1 017.
23 Shalaby IA,Chenard BL,Prochniak MA,et al.Neuroprotective effects of the N-methyl-D-aspartate receptor antagonists ifenprodil and SL-82,0715 on hippocampal cells in culture[J].J Pharmacol Exp Ther,1992,260:925.
24 Church J, Fletcher EJ, Baxter K, et al. Blockade by ifenprodil of high voltage-activated Ca2+channels in rat and mouse cultured hippocampal pyramidal neurones: comparison with N-methyl-D-aspartate receptor antagonist actions[J]. Br J Pharmacol, 1994,113:499.
