1-氨丙基-3-甲基咪唑溴盐水溶液对CO2的吸收特性
2014-06-09杨翠莲郭开华
杨翠莲,李 松,毕 崟,郭开华
(中山大学 工学院,广东 广州,510006)
环境与化工
1-氨丙基-3-甲基咪唑溴盐水溶液对CO2的吸收特性
杨翠莲,李 松,毕 崟,郭开华
(中山大学 工学院,广东 广州,510006)
以1-氨丙基-3-甲基咪唑溴盐([APMim]Br)为功能型离子液体,考察了其水溶液对CO2的吸收性能。实验结果表明, [APMim]Br水溶液的含水量(w)为65%~85%较适宜,在该含水量下,[APMim]Br水溶液对CO2具有优异的吸收-解吸特性。含水量增大可大幅提高[APMim]Br水溶液对CO2的物理吸收能力。随压力的增大,[APMim]Br水溶液对CO2的物理吸收量基本呈线性增长趋势,遵循亨利定律。温度对[APMim]Br水溶液物理吸收能力的影响显著大于对化学吸收能力的影响。当压力一定时,[APMim]Br水溶液对CO2的吸收-解吸范围随含水量的增大而变宽。[APMim]Br水溶液在同等条件下对CO2的吸收能力优于醇胺溶液。
1-氨丙基-3-甲基咪唑溴盐;功能型离子液体;二氧化碳;吸收
天然气作为一种高热值、低碳环保、储量丰富的洁净能源,是 21世纪能源消费结构的重要组成部分。CO2是天然气中常见的杂质气体,它会导致设备和管道腐蚀、降低天然气热值,并且在天然气液化装置中,CO2会固化析出而堵塞管道,因此必须脱除天然气中的CO2。
离子液体对CO2具有良好的选择性吸收性能[1-2],该性能使离子液体在CO2吸收领域的应用引起广泛的关注。用于吸收CO2的离子液体主要有常规离子液体和功能型离子液体。Blanchard等[1-3]发现超临界CO2极易溶于1-丁基-3-甲基咪唑四氟硼酸盐,他们还获得了CO2在多种烷基咪唑离子液体中的溶解度数据。Jacquemin等[4-5]发现气体在离子液体中的溶解度与气体及离子液体的类型有关。近年来多个课题组研究了常规离子液体对CO2的吸收性能[6-9]。增加烷基取代链的长度[10-12]或在阴(阳)离子上增加氟烷基团[9]均可提高离子液体对CO2的吸收性能,且阴离子的作用大于阳离子[13-15]。
常规离子液体对CO2的吸收主要通过物理吸收,吸收性能提升的空间有限,且受压力影响明显,当CO2分压较低时,常规离子液体不能对CO2进行吸收。为提高离子液体对CO2的吸收能力,可引入功能基团以提高离子液体对CO2的化学吸收能力。Bates等[16]合成并证实了氨基功能型离子液体1-(3-氨基丙基)-3-丁基咪唑氟硼酸盐([NH2pbim][BF4])在常温常压下对CO2的吸收量接近理论值0.5 mol(基于每mol [NH2p-bim][BF4])。当阴离子相同时,阳离子氨基经功能化后吸收CO2的能力有较大提高[17-18],吸收量约为非氨基化离子液体的2倍。
由于功能型离子液体在吸收CO2时黏度会成倍增大,其工业应用受到一定限制。将功能型离子液体配制成水溶液,可有效改善其流动性及其对CO2的吸收性能[19-20]。Zhang等[21]研究证实了加入一定量的水可显著改善胍盐功能型离子液体对CO2的吸收性能。吴永良等[22-23]考察并发现了含水量(w)分别为55%和68.84%时的1-氨丙基-3-甲基咪唑溴盐([APMim]Br) 水溶液对CO2具有优良的吸收性能。阳涛等[23]研究发现,当含水量低于60%(w)时,[APMim]Br水溶液对CO2的吸收性能急剧衰减。
本工作以[APMim]Br为功能型离子液体,考察了其水溶液对CO2的吸收性能,为其工业应用提供基础数据。
1 实验部分
1.1 主要试剂及仪器
[APMim]Br:纯度99%,中国科学科院兰州物理化学研究所;CO2:纯度99.99%,广州气体公司。
利用SFY-3A型微量水分滴定仪(淄博海分仪器厂)测得[APMim]Br离子液体的残留含水量为(4 500±300) mg/kg。
1.2 实验系统
实验系统是在文献[23]报道的测试系统基础上,将上部进水管取消,直接称量一定量的[APMim]Br离子液体和去离子水,倒入反应釜,提高了配液的准确性。实验系统见图1。从图1可看出,空气浴提供稳定的温度环境。反应釜整体置于空气浴内的水浴中,用恒温水槽控制温度,控制温度范围-20~100 ℃。系统中CO2的气量由计量手泵控制和测定。
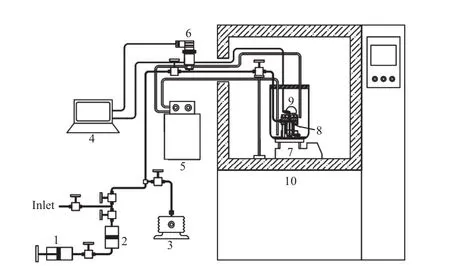
图1 实验系统Fig.1 Schematic diagram of experimental apparatus.
1.3 实验方法
称取一定量的[APMim]Br离子液体(约5 g)和水,倒入密闭反应釜内,抽真空。当系统起始温度稳定在5 ℃时,向釜内缓慢通入CO2气体,并在CO2吸收过程中保持压力不变,完成等压吸收,其间保持温度恒定。当系统压力平衡后,计量通入CO2气体并计算离子液体水溶液对CO2的吸收量。此后在等容条件下升高空气浴和水浴的温度,进行升温实验,待反应釜压力温度平衡后,记录系统温度和压力。根据釜内气相状态计算离子液体水溶液对CO2的吸收量。在5~75 ℃之间,每隔10 ℃测试一个吸收平衡点。完成一个等容升温测试后,将系统再次恒温至5 ℃,注入CO2至较高的压力等级,重复上述等压和等容CO2吸收平衡测试,获得较高压力下离子液体水溶液对CO2的吸收量数据。
2 结果与讨论
2.1 [APMim]Br水溶液对CO2的吸收性能
分别测定含水量不同的[APMim]Br水溶液在不同温度和压力下对CO2的吸收量。实验结果表明,当压力较低时(0.1~0.5 MPa),[APMim]Br水溶液对CO2的吸收量已相当显著,约为0.40~0.70 mol(基于每mol [APMim]Br),这主要来自[APMim]Br水溶液对CO2的化学吸收。随压力的增大,[APMim]Br水溶液对CO2的物理吸收开始显著增强。
当含水量低于55%(w)时,即使在较高温度(75 ℃)下,当压力小于3.2 MPa时,[APMim]Br水溶液对CO2仍以化学吸收为主,CO2吸收量在0.37~0.40 mol之间。当含水量增至65%(w)时,[APMim]Br水溶液对CO2的物理吸收量约为化学吸收量的2倍。当含水量进一步提高至85%(w)时,在较高压力下,[APMim]Br水溶液对CO2的吸收趋于饱和。因此,[APMim]Br水溶液的含水量(w)为65%~85%较适宜,在该含水量下,[APMim]Br水溶液对CO2具有优异的吸收-解吸特性。
2.2 含水量对[APMim]Br水溶液吸收性能的影响
不同温度下[APMim]Br水溶液对CO2的吸收量随含水量变化的特性曲线见图2。由图2可见,[APMim]Br水溶液对CO2的吸收量随含水量增大的趋势受压力的影响较大。当压力较低时,[APMim]Br水溶液对CO2的吸收主要为化学吸收,含水量对其吸收性能的影响较小,随含水量的增大,[APMim]Br水溶液对CO2的吸收量呈缓慢增长的趋势;当压力较高时,[APMim]Br水溶液对CO2的吸收主要为物理吸收,随含水量的增大,[APMim]Br水溶液对CO2的吸收量显著增大,说明含水量增大可大幅提高[APMim]Br水溶液对CO2的物理吸收能力。
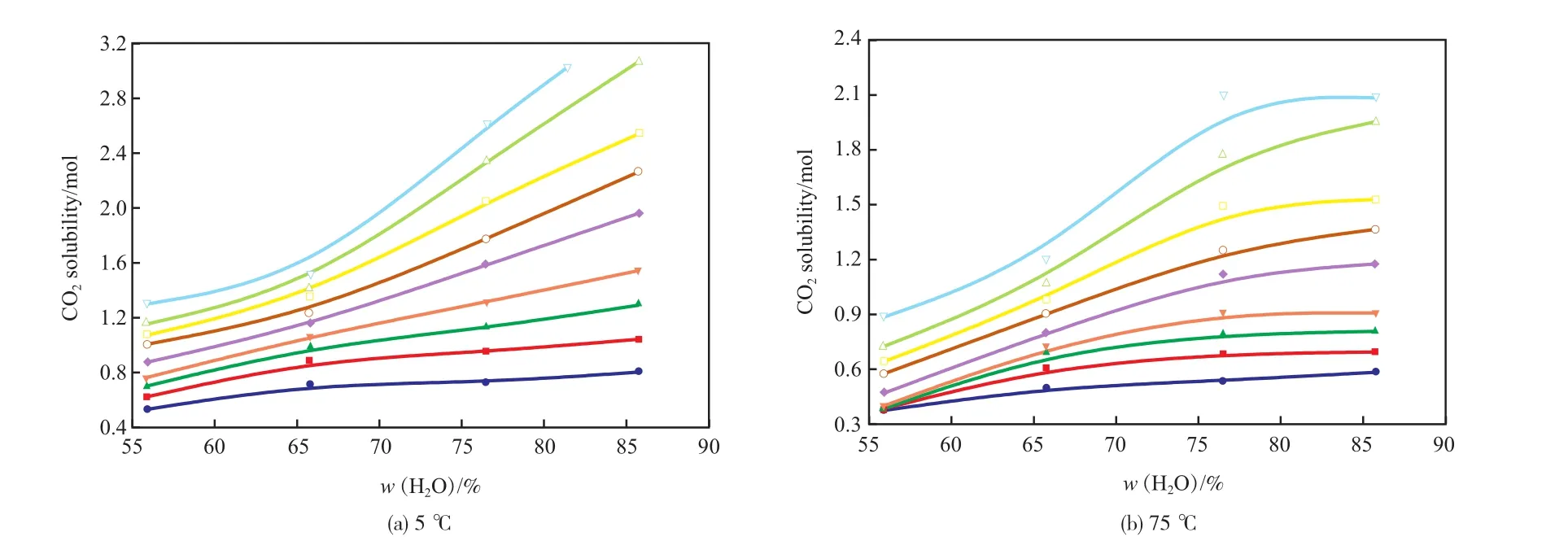
图2 不同温度下[APMim]Br水溶液对CO2的吸收量随含水量变化的特性曲线Fig.2 Absorbability of CO2in the[APMim]Br aqueous solutions vs. the water content at different temperature.
在5 ℃、3.5 MPa的条件下,当含水量(w)从55%增至85%时,[APMim]Br水溶液对CO2的吸收量由1.1 mol增至3.1 mol;在75 ℃、3.5 MPa的条件下,当含水量(w)从55%增至85%时,[APMim]Br水溶液对CO2的吸收量由0.4 mol增至1.1 mol。
[APMim]Br水溶液对CO2的化学吸收量为0.50~0.65 mol。5 ℃时,含水量为85%(w)的[APMim]Br水溶液对CO2的化学吸收量比含水量为55%(w)的[APMim]Br水溶液高33%。压力对[APMim]Br水溶液的化学吸收能力的影响可忽略,但对其物理吸收能力的影响较大。随压力的增大,[APMim]Br水溶液对CO2的物理吸收量基本呈线性增长趋势,遵循亨利定律。温度对[APMim]Br水溶液物理吸收能力的影响显著大于对其化学吸收能力的影响。当温度由5 ℃升至75 ℃时,[APMim]Br水溶液对CO2的化学吸收量降低约45%;[APMim]Br水溶液对CO2的物理吸收量降低71%~73%。含水量对[APMim]Br水溶液的化学和物理吸收能力都有促进作用。
不同压力下[APMim]Br水溶液对CO2的吸收-解吸曲线见图3。从图3可看出,当压力一定时,[APMim]Br水溶液对CO2的吸收-解吸范围随含水量的增大而增大。当压力为1.0 MPa时,含水量为55%(w)的溶液对CO2的吸收-解吸范围仅为0.3 mol;而含水量为85%(w)的溶液的吸收-解吸范围则约为0.6 mol。在压力分别为2.0,3.0,4.0 MPa时,[APMim]Br水溶液对CO2的解吸曲线表现出了同样的特征。对比图3a~d还可看出,含水量相同时,随压力的增大,[APMim]Br水溶液对CO2的吸收-解吸范围变宽。
对比[APMim]Br水溶液与醇胺溶液的CO2吸收量[24]可知,在40 ℃、1.0 MPa条件下,[APMim]Br水溶液对CO2的吸收量较大,吸收性能优于醇胺溶液;在5~75 ℃时,[APMim]Br水溶液的CO2吸收-解吸范围最大约为0.6 mol;而醇胺溶液在40~120 ℃时的CO2吸收-解吸范围不大于0.5 mol。因此,[APMim]Br水溶液在同等条件下对CO2的吸收能力优于醇胺溶液,且再生温度较低。
2.3 [APMim]Br水溶液中CO2的溶解度
通常采用亨利系数的倒数来表征CO2在[APMim]Br水溶液中的溶解度。[APMim]Br水溶液对CO2等温吸收的亨利系数倒数见图4。
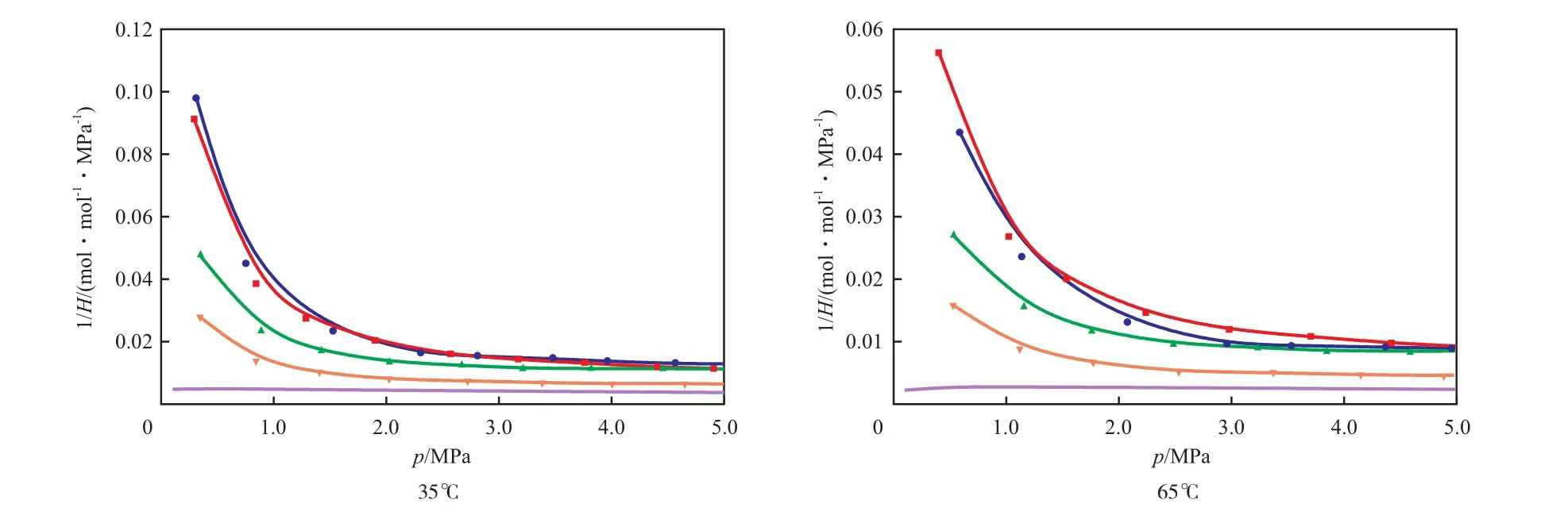
图4 [APMim]Br水溶液对CO2等温吸收的亨利系数倒数Fig.4 Reciprocals of Henry’s constants(H) for the isothermal absorption of CO2in the [APMim]Br aqueous solutions.
由图4可见,CO2在纯水中的溶解度很小,当纯水中加入[APMim]Br后,CO2在水中的溶解度显著增大。当压力较低时,对比纯水[25]中CO2的溶解度,CO2在[APMim]Br水溶液中的溶解度可提升10~20倍。
3 结论
1)[APMim]Br水溶液的含水量对其吸收CO2有显著的影响。[APMim]Br水溶液的含水量(w)为65%~85%较适宜,在该含水量下,[APMim]Br水溶液对CO2具有优异的吸收-解吸特性。
2)[APMim]Br水溶液对CO2的吸收量随含水量增大的趋势受压力的影响较大。含水量增大可大幅提高[APMim]Br水溶液对CO2的物理吸收能力。随压力的增大,[APMim]Br水溶液对CO2的物理吸收量基本呈线性增长趋势,遵循亨利定律。温度对[APMim]Br水溶液物理吸收能力的影响显著大于对其化学吸收能力的影响。
3)当压力一定时,[APMim]Br水溶液对CO2的吸收-解吸范围随含水量的增大而增大。含水量相同时,随压力的增大,[APMim]Br水溶液对CO2的吸收-解吸范围变宽。
4)[APMim]Br水溶液在同等条件下对CO2的吸收能力优于醇胺溶液,且再生温度较低。离子液体的加入极大提高了纯水对CO2的物理吸收性能。
[1] Blanchard L A,Gu Zhiyong,Brennecke J F. High-Pressure Phase Behavior of Ionic Liquid/CO2Systems [J]. J Phys Chem,B,2001,105(12):2437 - 2444.
[2] Huang Junhua,Rüther T. Why are Ionic Liquids Attractive for CO2Absorption? An Overview[J]. Aust J Chem,2009,62(4):298 - 308.
[3] Blanchard L A,Hancu D,Beckman E J,et al. Green Processing Using Ionic Liquids and CO2[J]. Nature,1999,399(6731):28 - 29.
[4] Jacquemin J,Husson P,Majer V. Infuence of the Cation on the Solubility of CO2and H2in Ionic Liquids Based on the Bis(Trifuoromethylsulfonyl)Imide Anion[J]. J Solution Chem,2007,36(8):967 - 979.
[5] Hong G,Jacquemin J,Deetlefs M,et al. Solubility of Carbon Dioxide and Ethane in Three Ionic Liquids Based on the Bis{(Trifuoromethyl)Sulfonyl}iImide Anion[J]. Fluid Phase Equilib,2007,257(1):27 - 34.
[6] Pérez-Salado Kamps Á,Tuma D,Xia Jianzhong,et al. Solubility of CO2in the Ionic Liquid [bmim][PF6][J]. J Chem Eng Data,2003,48(3):746 - 749.
[7] Husson-Borg P,Majer V,Costa Gomes M F. Solubilities of Oxygen and Carbon Dioxide in Butyl Methyl Imidazolium Tetrafluoroborate as a Function of Temperature and at Pressures Close to Atmospheric Pressure[J]. J Chem Eng Data,2003, 48(3):480 - 485.
[8] Baltus R E,Culbertson B H,Dai S,et al. Low-Pressure Solubility of Carbon Dioxide in Room-Temperature Ionic Liquids Measured with a Quartz Crystal Microbalance[J]. J Phys Chem,B,2004,108(2):721 - 727.
[9] Muldoon M J,Aki S N V K,Anderson J L,et al. Improving Carbon Dioxide Solubility in Ionic Liquids[J]. J Phys Chem,B,2007,111(30):9001 - 9009.
[10] Shariati A,Peters C J. High-Pressure Phase Equilibria of Systems with Ionic Liquids[J]. J Supercrit Fluids,2005,34(2):171 - 176.
[11] Gutkowski K I,Shariati A,Peters C J. High-Pressure Phase Behavior of the Binary Ionic Liquid System 1-Octyl-3-Methylimidazolium Tetrafuoroborate + Carbon Dioxide[J]. J Supercrit Fluids,2006,39(2):187 - 191.
[12] Shariati A,Peters C J. High-Pressure Phase Behavior of Systems with Ionic Liquids:Ⅲ. The Binary System Carbon Dioxide + 1-Hexyl-3-Methylimidazolium Hexafuorophosphate[J]. J Supercrit Fluids,2004,30(2):139 - 144.
[13] Anthony J L,Anderson J L,Maginn E J,et al. Anion Effects on Gas Solubility in Ionic Liquids[J]. J Phys Chem,B,2005,109(13):6366 - 6374.
[14] Cadena C,Anthony J L,Shah J K,et al. Why is CO2so Soluble in Imidazolium-Based Ionic Liquids?[J]. J Am Chem Soc,2004,126(16):5300 - 5308.
[15] Aki S N V K,Mellein B R,Saurer E M,et al. High-Pressure Phase Behavior of Carbon Dioxide with Imidazolium-Based Ionic Liquids[J]. J Phys Chem,B,2004,108(52):20355 - 20365.
[16] Bates E D,Mayton R D,Ntai I,et al. CO2Capture by a Task-specific Ionic Liquid[J]. J Am Chem Soc,2002,124(6):926 - 927.
[17] Sanchez L M G,Meindersma G W,de Haan A B. Solvent Properties of Functionalized Ionic Liquids for CO2Absorption[J]. Chem Eng Res Des,2007,85(A1):31 - 39.
[18] Zhang Yi,Wu Zaikun,Chen Shaoli,et al. CO2Capture by Imidazolate-Based Ionic Liquids:Effect of Functionalized Cation and Dication[J]. Ind Eng Chem Res,2013,52(18):6069 - 6075.
[19] Goodrich B F,de la Fuente J C,Gurkan B E,et al. Effect of Water and Temperature on Absorption of CO2by Amine-Functionalized Anion-Tethered Ionic Liquids[J]. J Phys Chem,B,2011,115(29):9140 - 9150.
[20] Romanos G E,Zubeir L F,Likodimos V,et al. Enhanced CO2Capture in Binary Mixtures of 1-Alkyl-3-Methylimidazolium Tricyanomethanide Ionic Liquids with Water[J]. J Phys Chem,B,2013,117(40):12234 - 12251.
[21] Zhang Feng,Fang Chenggang,Wu Youting,et al. Absorption of CO2in the Aqueous Solutions of Functionalized Ionic Liquids and MDEA[J]. Chem Eng J,2010,160(2):691 - 697.
[22] 吴永良,焦真,王冠楠,等. 用于CO2吸收的离子液体的合成,表征及吸收性能[J]. 精细化工,2007,24(4):324 -327.
[23] 阳涛,毕崟,郭开华. 1-氨丙基-3-甲基咪唑溴功能型离子液体对CO2的吸收性能[J]. 化工学报,2012,63(10):3152 - 3157.
[24] 刘延鑫,董立户,密建国,等. 醇胺分子结构及其CO2捕集能力[J]. 中国科学: 化学,2012,42(3):291 - 296.
[25] Duan Zhenhao, Sun Rui. An Improved Model Calculating CO2Solubility in Pure Water and Aqueous NaCl Solutions from 273 to 533 K and from 0 to 2000 Bar[J]. Chem Geol,2003,193(3/4):257 - 271.
(编辑 邓晓音)
Absorption Property of 1-Aminopropyl-3-Methylimidazolium Bromide Aqueous Solutions to Carbon Dioxide
Yang Cuilian,Li Song,Bi Yin,Guo Kaihua
(School of Engineering,Sun Yat-Sen University,Guangzhou Guangdong 510006,China)
The absorption property of the aqueous solutions of a functional ionic liquid,1-aminopropyl-3-methylimidazolium bromide([APMim]Br),to CO2was investigated. The results indicated that when the water mass fraction was in the range of 65%-85%,the aqueous solutions had excellent absorption-desorption capacity to CO2. The physical absorption capacity of the solutions to CO2could increase evidently when the water content increased. In the solution systems,the amount of CO2physically absorbed by the [APMim]Br solutions linearly correlated to the pressure rise, which accorded with the Henry’s law. Temperature had remarkable effect on the physical absorption capacity of the [APMim]Br solutions, much greater than that on their chemical absorption capacity. Under a certain pressure,the range of the CO2absorption-desorption in the [APMim]Br solutions widened with increasing the water content. The absorption capacity of the [APMim]Br solutions to CO2is superior to that of alkanolamine solutions under the same conditions.
1-aminopropyl-3-methylimidazolium bromide;functional ionic liquid;carbon dioxide;absorption
1000 - 8144(2014)12 - 1433 - 06
TQ 028.15
A
2014 - 06 - 18;[修改稿日期] 2014 - 09 - 09。
杨翠莲(1987—),女,山东省菏泽市人,硕士生。联系人:郭开华,电话 020 - 39332893,电邮 guokh120@163.com。
国家自然科学基金资助项目(51076169);广东省自然科学基金重点项目(9251027501000001)。
