猪圆环病毒Ⅱ型河南地方株ORF4的克隆及原核表达
2014-06-07郑鸣王老七边传周王永芬
郑鸣,王老七,边传周,王永芬
(河南牧业经济学院生物工程系,河南郑州450011)
猪圆环病毒Ⅱ型河南地方株ORF4的克隆及原核表达
郑鸣,王老七,边传周,王永芬
(河南牧业经济学院生物工程系,河南郑州450011)
根据GenBank数据库中猪圆环病毒Ⅱ型的基因组序列设计引物,采用PCR技术从病料基因组DNA中扩增出PCVⅡ河南地方株ORF4基因,全长180 bp,编码59个氨基酸.将该基因克隆至载体pGEX-4T-3中形成pGEX-4T-3-ORF4表达载体.经PCR、酶切和测序鉴定后,转化表达菌株BL21(DE3)诱导表达.SDS-PAGE结果显示:ORF4能够在大肠杆菌中表达,产物的分子量约为32 kD,且以包涵体形式存在.Western Blot检测结果显示,纯化后的ORF4蛋白能够与鼠抗6×His标签单克隆抗体发生特异性反应,为进一步研究PCVⅡORF4蛋白的特性与功能奠定了基础.
猪圆环病毒Ⅱ型;ORF4基因;原核表达
猪圆环病毒(Porcinecircovirus,PCV)是一种无囊膜单链环状负链DNA病毒[1],分为2个血清型:PCVⅠ和PCVⅡ,其中PCVⅡ具有致病性,是一种重要的病原微生物,能够引起断奶仔猪多系统衰竭综合征(PMWS)、猪皮炎肾病综合征(PDNS)和增生性坏死性肺炎(PNP)等多种疾病[2-4].由于PCVⅡ在我国猪群普遍存在以及持续感染而引起猪群免疫抑制,PCVⅡ与猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)、猪伪狂犬病毒(PRV)等病原体混合感染的现象严重[5],给我国养猪业造成了巨大危害,影响了养猪业的健康发展.
序列分析表明,PCVⅡ基因组全长约1.7 kb,存在11个潜在开放读框(ORF1~ORF11).其中,ORF1编码参与病毒复制Rep蛋白,与PRRSV共感染中发挥重要作用[6-7];ORF2编码病毒的衣壳蛋白Cap,是PCVⅡ主要致病基因,可诱导免疫保护,是基因工程疫苗研制的主要候选基因[8-10];ORF3编码一种非结构蛋白,具有诱导PK-15细胞凋亡的功能[11-12],可能与病毒致病性有关;其他8个开放读框(ORF4~ORF11)编码的蛋白质功能尚不清楚.虽然PCVⅡ病毒基因组很小,编码框有限,但到目前为止人们对PCVⅡ病毒致病的基因数量以及致病的分子机制仍不太清楚.本试验利用PCR技术从采自河南省周边县市的疑似PMWS病料中扩增全长的ORF4基因,并将ORF4基因构建到原核表达载体,转入大肠杆菌BL21(DE3)以实现ORF4的高效表达,为进一步研究PCVⅡ病毒致病的分子机理和ORF4蛋白的生物学功能奠定基础.
1 材料与方法
1.1 试验材料
1.1.1 病料来源猪病料组织由郑州牧业经济学院大成动物生物技术研究院取自河南省卫辉、商丘等地3个猪场疑似PMWS病死猪.
1.1.2 菌株、质粒和试剂大肠杆菌BL21(DE3)和表达载体pGEX-4T-1由四川大学生命科学学院微生物实验室徐辉博士惠赠;T/A克隆pMD-18-T、Taq DNA聚合酶、DNA分子量标准DL-2000购自Takara公司;大肠杆菌DH5α感受态细胞、胶回收试剂盒及质粒DNA小提试剂盒购自北京天根;其他试剂均为分析纯试剂.
1.2 试验方法
1.2.1 病料基因组DNA的制备取疑似PMWS病料的淋巴结组织0.1 g,用PBS冲洗1~2次,加入600 μL组织匀浆缓冲液,研磨形成匀浆,8 000 r/min离心2 min,弃上清;向沉淀中加入600 μL组织裂解液(含蛋白酶K,终质量浓度50 μg/mL),55℃消化过夜;冷却至室温,用等体积的Tris饱和酚∶氯仿∶异戊醇(25∶24∶1)抽提1次,吸取上层水相;加入1/10体积3 mol/L NaAc和2倍体积的无水乙醇,室温沉淀5 min,12 000 r/min离心5 min,弃上清;用70%乙醇洗涤沉淀,12 000 r/min离心2 min,弃上清;沉淀干燥后溶于30 μL TE缓冲液,-20℃保存.
1.2.2 引物设计及ORF4基因的扩增参照GenBank数据库中PCVⅡ中国株基因组序列(DQ195679.1)设计1对引物,上游引物为:5’-CCCTCGAG TTA GTGGTGGTGGTGGTGGTG AGGACAACGGAGTGACCT GT-3’;下游引物为:5’-CGGGATCCATGACGTGTACATTAGTCTTCC 3’,其中下划线部分为BamH I和Xho I酶切位点的序列,下划线且斜体部分序列为6×His标签序列,以方便重组蛋白纯化,引物的合成由上海生工生物工程有限公司完成.以病料基因组DNA为模板扩增ORF4基因180 bp的编码框.PCR扩增条件如下:PCR循环条件为:95℃预变性5 min;95℃20 s,52℃20 s,72℃20 s,30个循环;72℃再延伸7 min.PCR扩增结束后,进行电泳检测,胶回收纯化PCR产物,并通过T/A克隆连接到载体pMD-18T形成pMD-18T-ORF4质粒,转化DH5α感受态细胞,筛选阳性克隆子送上海生工进行测序鉴定.
1.2.3 表达载体pGEX-4T-3-ORF4的构建及诱导表达将“1.2.2”中经测序鉴定的重组质粒用BamH I和Xho I进行双酶切,回收酶切小片段,与经相同酶双酶切的表达载体pGEX-4T-3连接,构建表达载体pGEX-4T-3-ORF4,转化大肠杆菌BL21(DE3),PCR筛选阳性克隆子进行诱导表达.表达条件:37℃, 180 r/min将重组菌振荡培养至OD600=0.8~1.0时,加入IPTG至终浓度0.5 mmol/L,诱导4 h,取少量表达菌液进行SDS-PAGE电泳分析,检测ORF4蛋白表达情况.
1.2.4 重组蛋白的纯化取诱导培养的菌液,离心收集菌体沉淀,用冰冷的PBS洗涤菌体1次,按1∶10(m/V)的比例用裂解缓冲液(20mmol/LPB,150mmol/LNaCl,pH7.4)重悬菌体,冰浴条件下超声波破碎,8000 r/min, 4℃离心30 min,吸弃上清,沉淀即为融合蛋白包涵体;之后,依次用0.5%Triton X-100和1 mol/L尿素洗涤包涵体;最后,用变性液(20 mmol/L PB,150 mmol/L NaCl,6 mol/L尿素,20 mmol/L咪唑,pH 7.4)溶解包涵体,8 000 r/min,4℃离心30 min,收集上清即为纯化的包涵体溶液.采用Ni+金属螯合层析柱HisTrap HP(GE healthcare)对包涵体溶液做进一步纯化,收集150 mmol/L咪唑的洗脱峰,并进行浓度测定和SDS-PAGE检测.
1.2.5 重组蛋白的Western Blot鉴定将SDS-PAGE电泳分离后的蛋白条带印迹到PVDF膜上,用封闭液(1.5%BSA,TBST)封闭过夜,用TBST漂洗5次;加入鼠anti-6×His(Sigma),37℃孵育1 h,用TBST充分洗膜;再加入HRP标记的抗鼠二抗,37℃孵育1 h,用TBST充分洗膜;DAB避光显色.

图1 ORF4蛋白基因PCR扩增结果Fig.1 PCR product of ORF4
2 结果与分析
2.1 ORF4基因的扩增及序列分析
以病料基因组DNA为模板,以ORF4特异性引物进行PCR扩增,扩增产物经琼脂糖凝胶电泳分析,与Marker相比,在100 bp到250 bp的位置可见清晰的单一条带(见图1),与ORF4基因180 bp的长度相符合.经T/A克隆后,序列分析结果发现,扩增片段的序列与模板序列(DQ195679.1)完全一致;通过NCBI中BLAST序列比对发现,该基因与GenBank中国内外参考毒株核苷酸同源性在98%~100%.
2.2 表达载体pGEX-4T-3-ORF4的构建及诱导表达
用BamH I和Xho I将pMD-18T-ORF4质粒上的ORF4切下,插入到表达载体pGEX-4T-3中形成pGEX-4T-3-ORF4,并转化大肠杆菌BL21(DE3).挑取单克隆进行液体LB培养,取少量菌液进行PCR扩增鉴定,电泳结果显示有大小为200 bp的特异性扩增条带(见图2),进一步测序结果表明克隆至原核表达载体中的ORF4基因没有发生突变,插入方向和位置与预期一致,表明表达载体pGEX-4T-3-ORF4构建成功.筛选阳性克隆子进行诱导表达,SDS-PAGE分析表达情况,结果显示ORF4基因在大肠杆菌中都能高效表达,产物大小约32 ku,与预期相符,而未诱导的对照则没有相应条带(见图3).
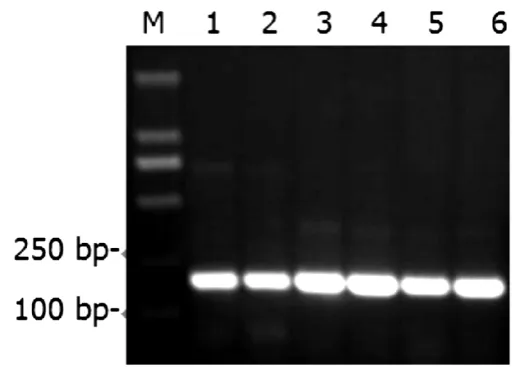
图2 重组菌液的PCR鉴定Fig.2 Identification of ORF4 recombinant E.coli by PCR

图3 SDS-PAGE检测ORF4蛋白表达及纯化结果Fig.3 The detection results of expression and purification of ORF4 protein by SDS-PAGE
2.3 重组蛋白ORF4的纯化
表达产物经超声波破碎、包涵体洗涤和包涵体变性溶解等纯化步骤后获得重组蛋白包涵体溶液,再经Ni+柱纯化,收集洗脱峰进行SDS-PAGE电泳检测,纯度达到90%以上(见图3),采用Bradford法测定蛋白质量分数为1.325 g/L.
2.4 重组蛋白ORF4的Western Blot鉴定

图4 Western Blot结果Fig.4 The result of Western Blot
将纯化的重组蛋白ORF4经SDS-PAGE电泳分离后,印迹至PVDF膜上进行Western Blot分析,结果显示重组蛋白ORF4能与鼠anti-6×His发生反应,形成一阳性条带,而对照pGEX-4T-3则在相应位置不能形成条带(见图4),证实表达产物即为重组ORF4蛋白.
3 结论与讨论
从病毒血清学和病原学研究结果发现,我国规模化猪场普遍存在PCVⅡ感染[13],由于PCVⅡ主要侵害感染猪的免疫系统,造成感染猪群的免疫抑制,进而导致猪群发生各种疾病[14-15],由PCVⅡ感染引起的猪圆环病毒病是正在成为当前规模化猪场的一种新型病毒性疾病,并呈全球化趋势,给我国乃至世界养猪业带来了巨大的经济损失,对其致病机理的研究就显得尤为重要.
早在1998年,Hamel等人就通过软件分析确定了ORF4基因的存在[1],但其功能研究一直比较滞后,随着PCVⅡ的持续感染和不断蔓延以及对PCVⅡ研究的不断深入,ORF3、ORF4等其他编码蛋白成为PCVⅡ致病机理研究的热点蛋白.ORF4基因位于PCVⅡ基因组互补链上ORF1基因的内部,呈逆时针方向排列,全长由180个核苷酸构成,编码59个氨基酸的ORF4蛋白,而该蛋白的结构与功能目前尚不完全清楚.李增魁等[16]研究发现,ORF4基因转染PK-15细胞,能够引起PK-15细胞死亡,提示ORF4蛋白对细胞有一定的毒性作用.基因克隆与表达是获得蛋白并进行蛋白结构与功能研究的前提,本研究以PCVⅡ中国株基因组序列(DQ195679.1)设计1对特异性引物,成功从采自周边县市的疑似PMWS病料中扩增出完整的ORF4基因,序列测定结果显示,该基因序列与模板序列完全一致,与GenBank中国内外参考毒株核苷酸同源性在98%~100%,表明PCVⅡORF4基因高度保守.将ORF4基因构建到原核表达载体pGEX-4T-3后,该基因能够在大肠杆菌BL21(DE3)细胞内进行表达,且表达蛋白以不容包涵体形式存在,这主要是因为表达蛋白发生了错误折叠而引起的.大量表达的ORF4蛋白经超声波破碎和离心后,获得包涵体沉淀,采用表面活性剂洗涤和低浓度尿素洗涤包涵体可以除去较多的杂蛋白.因为在载体构建时于ORF4基因的下游事先添加了6×His标签,表达的ORF4蛋白上游带有GST标签蛋白,下游则带有6×His标签.将变性溶解的ORF4蛋白包涵体溶液于变性条件下进行Ni+柱纯化,可获得纯度达90%以上重组蛋白.经Western Blot检测,该重组蛋白能够与鼠anti-6×His发生特异性反应.ORF4基因在PCVⅡ病毒的致病机理中占有重要的地位,该基因的克隆与表达为深入研究ORF4的结构与功能,进一步揭示ORF4蛋白与PCVⅡ病毒致病的分子机理奠定了基础.
[1]Hamel A L,Lin L L,Nayar G P,et al.Nucleotide sequence of porcine circovirus associated with postweaning multisystemic wasting syndrome in pigs[J].J Virol,1998,72(6):5262-5267.
[2]Borel N,Burgi E,Kiupel M,et al.Three cases of postweaning multisystemic wasting syndrome(PMWS)due to porcine circovirus type 2(PCV2)in Switzerland[J].Schweiz Arch Tierheilkd,2001,143(5):249-255.
[3]Choi C,Kim J,Kang I J,et al.Concurrent outbreak of PMWS and PDNS in a herd of pigs in Korea[J].Vet Rec,2002,151(16):484-485.
[4]Dea S,Bilodeau R,Sauvageau R,et al.Antigenic variant of swine influenza virus causing proliferative and necrotizing pneumonia in pigs[J].J Vet Diagn Invest,1992,4(4):380-392.
[5]Gillespie J,Opriessnig T,Meng X J,et al.Porcine circovirus type 2 and porcine circovirus-associated disease[J].Vet Int Med, 2009,23(6):1151-1163.
[6]Mankertz A,Mankertz J,Wolf K,et al.Identification of a protein essential for replication of porcine circovirus[J].J Gen Virol, 1998,79(2):381-384.
[7]郗鑫,陈焕春,李川,等.猪Ⅱ型圆环病毒ORF1基因克隆及在E.coli中的表达[J].中国生物化学与分子生物学报,2004,20(3):413-417.
[8]郭龙军,陆月华,黄立平,等.猪圆环病毒2型Cap蛋白核定位信号区抗原表位的鉴定[J].中国农业科学,2010,43(7):1480-1486.
[9]Gillespie J,Juhan N M,DiCristina J,et al.A genetically engineered chimeric vaccine against porcine circovirus type 2(PCV-2)is genetically stable in vitro and in vivo[J].Vaccine,2008,26(33):4231-4236.
[10]Lekcharoensuk P,Morozov L,Paul P S,et al.Epitope map-ping of the major eapsid protein of type 2 Porcine circovirus(PCV-2)by using chimeric PCV-1 and PCV-2[J].J Virol,2004,78(15):8135-8145.
[11]Liu J,Chenl,Du Q,et al.The ORF3 protein of poreine circovirus type 2 is involved in viral pathogenesis in vivo[J].J Virol,2006,80(10):5065-5073.
[12]杨晓农,郭万柱,徐志文,等.猪圆环病毒Ⅱ型ORF3基因缺失突变毒株对仔猪的致病性及免疫原性研究[J].畜牧兽医学报,2008,39(8):1094-1099.
[13]王忠田,杨汉春,郭鑫.规模化猪场猪圆环病毒2型感染的流行病学调查[J].中国兽医杂志,2002,38(10):3-6.
[14]司兴奎.猪圆环病毒2型感染对猪免疫功能影响的细胞与分子机制[D].北京:中国农业大学,2005.
[15]Chang H W,Jeng C R,Lin T L,et al.Immunopathological effects of porcine circovirus type 2(PCV-2)on swine alveolar macrophage sbyin vitro inoculation[J].Veterinary Immunology and Immunopathology,2006,110:207-219.
[16]李增魁,陈婷飞,李益飞,等.猪圆环病毒2型ORF4基因编码蛋白的体外表达[J].中国兽医科学,2008,38(10):837-841.
(责任编辑:卢奇)
Cloning and prokaryotic expression of ORF4 gene of Porcine circovirus typeⅡfrom Henan strain
Zheng Ming,Wang Laoqi,Bian Chuanzhou,Wang Yongfen
(Henan University of Animal Husbandry and Economy,Zhengzhou 450011,China)
According to the genomic sequence ofporcine circovirus typeⅡ(PCVⅡ)from GenBank,a pair of specific primers were designed.The full-length PCVⅡORF4 gene of Henan strain was amplified from pathological samples suspected PCVⅡinfection by PCR,which was 180 bp in length and encoded 59 amino acids.The ORF4 gene was cloned into the vector of pGEX-4T-3 to construct recombinant plasmid pGEX-4T-3-ORF4.The recombinant plasmid confirmed by sequencing was transformed into BL21(DE3)and induced by IPTG.SDS-PAGE analysis showed that the ORF4 gene could express in E.coli BL21(DE3)and the expression prudct of ORF4 gene was about 32 kD recombinant protein,mainly in form of inclusion bodies.The results of western blot showed that the purified ORF4 protein could be specifically reacted with 6×His monclonal antibody.Cloning and prokaryotic expression of ORF4 gene were benefit to research for function and characteristics of ORF4 of PCVⅡ.
Porcine circovirus typeⅡ;ORF4 gene;prokaryotic expression
TP386
A
1008-7516(2014)04-0052-04
10.3969/j.issn.1008-7516.2014.04.013
2014-05-14
河南省高等学校青年骨干教师资助计划项目(2011GGJS-192)
郑鸣(1975-),男,河南信阳人,硕士,讲师.主要从事畜禽疾病防治及诊断技术的研究.
王永芬(1973-),女,河南开封人,硕士,教授.主要从事生物化学与分子生物学研究.
