GSK-3β参与神经精神疾病的研究进展
2014-05-18唐倩倩郭小云曹君利
唐倩倩,郭小云,刘 迪,曹君利,3
(1.江苏省麻醉学重点实验室,2.江苏省麻醉与镇痛应用技术重点实验室,江苏徐州 221004;3.徐州医学院附属医院麻醉科,江苏徐州 221002)
GSK-3β是一种丝氨酸/苏氨酸激酶,因使糖原合成酶磷酸化失活而得名[1]。GSK-3β广泛存在于中枢神经系统,主要分布在神经元,胶质细胞也有表达。GSK-3β是多种信号转导途径中的一个关键酶,通过调节底物,如酶、结构蛋白和转录因子等参与神经元的分化与增殖、基因表达等多种神经系统生理过程,因而,GSK-3β的活性或表达异常均可导致多种神经精神疾病。如 GSK-3β的活化参与阿尔采末病(Alzheimer’s disease,AD)的病理生理过程[2],GSK-3β的活化对tau样蛋白的异常聚集是必须的,而后者导致脑内神经元的死亡是AD的病因之一。Emamian等[3]报道:精神分裂症患者的脑部和外周淋巴细胞中AKT1及GSK-3β磷酸化水平都降低,首次发现GSK-3β与精神分裂症相关。近来研究发现,PI3K/GSK-3β信号通路在调节炎症反应中占中心地位,而炎症是多种神经系统疾病的分子基础[4]。此外,研究表明GSK-3β抑制剂可以减轻神经病理性疼痛[5]。总之,GSK-3β已成为临床和基础研究的热点,也逐渐成为众多疾病的治疗靶点。文章旨在论述GSK-3β活性异常参与神经精神系统疾病的机制。
1 GSK-3β的结构
X-衍射发现GSK-3β有3个区域:氨基端区域由一个闭合的β桶状的结构构成;羧基端区域包含一个“激酶折叠”结构;催化结构域处于上述两个结构域之间。GSK-3β的活性中心为T-loop结构,但GSK-3β的T-loop结构缺少磷酸化的苏氨酸,这恰好通过由Arg96、Arg180和Lys205三个带正电的氨基酸组成的口袋结构(底物结合位点)与苏氨酸/丝氨酸相结合发挥作用。由于GSK-3β的Tyr216磷酸化修饰在GSK-3β打开底物结合位点时起到相当重要的作用,但未磷酸化的GSK-3β本身并不形成阻碍底物进入的构象,因此,Tyr216是GSK-3β的 T-loop结构的关键位点[6]。
2 GSK-3β参与的信号通路
2.1 PI3K-AKT-GSK 3β信号通路 PI3K-AKT-GSK3β途径是细胞内信号网络的重要组成部分。PI3K-AKT-GSK3β途径参与并影响包括胰岛素诱导的糖原和蛋白质合成调控、细胞生长分化、抗凋亡等下游事件。磷脂酰肌醇3激酶(phosphoinositide3-kinase,PI3K)家族成员属于原癌基因。正常情况下,PI3K被激活后,在细胞膜上生成第二信使PIP3,PIP3与细胞内含有PH结构域的信号蛋白AKT/PKB和磷酸肌醇依赖性蛋白激酶(PDKl)结合,促使PDKl磷酸化AKT蛋白的Ser308,进而活化AKT。GSK-3β是最早发现的AKT的直接底物之一,活化的AKT与GSK-3β结合后,诱导GSK-3β向细胞膜转位,磷酸化其N端的Ser9活性位点而使GSK-3β失活,进而影响核因子 κB(nuclear factorκB,NF-κB)、tau蛋白、c-Jun转录子和胰岛素受体等GSK-3β下游底物。最终发挥其参与细胞增殖与分化及调节炎症和免疫反应的作用[7]。
2.2 W nt信号通路 Wnt信号通路是广泛存在于真核生物中的一条高度保守的信号通路,其在胚胎的早期发育、器官形成、组织再生等生理过程中发挥重要的作用[8]。Wnt的受体是卷曲蛋白(Frizzled,Frz),为7次跨膜蛋白,结构类似于G蛋白偶联型受体,Frz胞外N端具有富含半胱氨酸的结构域(cysteine rich domain,CRD),能与Wnt结合。经典的Wnt通路可简述为:当Wnt蛋白与细胞表面Frizzled受体家族结合后产生一系列的反应,包括蓬乱蛋白(dishevelled,DSH)的激活,以及最终细胞核内β-catenin水平的变化。其中,DSH是细胞膜相关Wnt受体复合物的关键组成部分,它与Wnt结合后被激活,抑制下游蛋白质如GSK-3β等的活化。而GSK-3β可促进信号分子β-catenin的失活,因而,激活Wnt通路可通过抑制GSK-3β活性使β-catenin稳定存在,后者进入细胞核与TCF/LEF转录因子家族结合,进而调节靶基因的表达。
3 GSK-3β参与疾病调控
3.1 GSK-3β与双极紊乱 双极紊乱是一种反复发作的心境障碍,其特点是反复发作的躁狂状态或者躁狂与抑郁交替发作,因此也被称为躁狂-抑郁症[9]。研究表明,GSK-3β参与神经元构建与生成、基因表达及应激反应等多种神经元活动,并与双极紊乱等疾病有着密切的关联[10]。GSK-3β过多表达的动物表现为多食及活动增多,这些都与双极紊乱患者经典的躁狂阶段相似。Chubb等[11]证实,基因突变导致GSK-3β过度激活及其下游β-catenin表达减少可促进抑郁症及精神疾病的发生,而GSK-3β抑制剂锂通过降低β-catenin的降解,从而增加CREB的表达量及活性,产生抗抑郁效果。
多巴胺和5-HT系统的功能障碍是双极紊乱的重要病因。研究表明,多巴胺与5-HT通过调节AKT/GSK-3β信号通路参与情绪及行为的调控。激活多巴胺受体2通过引起下游AKT失活及GSK-3β活化参与双极紊乱的形成[12]。此外,增加5-HT及激活5-HT受体可以通过PI3K-AKT-GSK 3β信号通路抑制GSK-3β的活性来治疗由5-HT合成降低引起的行为缺失及抑郁症状[13]。改变GSK3β表达含量可以缓解5-HT缺乏导致的攻击及焦虑行为[14]。GSK-3β的抑制剂锂、丙基戊酸钠对治疗双极紊乱有明显的效果,基础研究发现,新型GSK-3β抑制剂AR-A014418及L803-mts有明显的抗抑郁作用[10]。综上所述,AKT/GSK-3β信号通路的紊乱是双极紊乱的重要病因,某些抗精神病药通过改变此通路功能而发挥作用。
3.2 GSK-3β与精神分裂症 精神分裂症是一种严重的精神疾病,表现为思维、情感、行为等多方面障碍。AKT与GSK-3β都参与神经元突触可塑性,在认知和记忆中发挥着重要的作用。AKT和GSK-3β调节多种与精神分裂症有关的转录因子的表达,如:TCE4(影响精神分裂症患者的学习及记忆功能)、RELA等等。精神分裂症的患者AKT1的mRNA、蛋白表达量及其活化水平在前脑皮层、海马及外周血中均降低。一些学者也报道,AKT1下游GSK-3β的活性及含量,在精神分裂症患者的多个组织中发生明显变化[15]。在动物实验中,GSK-3β抑制剂可以逆转服用安非他命小鼠的精神过度亢奋症状[16],GSK-3β基因敲除小鼠也可明显减少由安非他命引起的多动症状。此外,TPH2、DISC1和NRG1等基因突变诱发精神分裂症症状可能与这些基因突变后干扰AKT-GSK3β信号通路,从而影响神经系统的发育有关[17]。
Wnt通路也参与GSK-3β功能障碍引起的精神分裂症。如长期服用抗精神病的药物如氟哌啶醇、氯氮平,不仅可以影响AKT-GSK3β信号通路(AKT1活化增多并且抑制GSK-3β),而且可以作用于Wnt通路中的Dv1,从而增加前脑皮层及纹状体处的β-catenin的含量。由此可见,Wnt信号通路也参与精神分裂症的形成。综上所述,AKT-GSK3β-Wnt信号通路途径参与精神分裂症的发病机制,也为临床治疗精神分裂症等精神疾病提供了一个新的突破口。
3.3 GSK-3β与阿尔采末病 AD是一种中枢神经系统退行性变性疾病,是老年期痴呆最常见的一种类型。主要表现为渐进性记忆障碍、认知功能障碍等神经精神症状,严重影响社交、职业与生活功能。特征性病理改变为β-淀粉样蛋白(amyloidβ-protein,Aβ)沉积形成的老年斑和tau蛋白过度磷酸化形成的神经细胞内神经原纤维缠结[18]。
Aβ被认为是AD的发病机制,Aβ沉积引起神经原纤维缠结和神经元的死亡,导致老年痴呆。Aβ抑制PI3K后,激活GSK-3β,引起tau蛋白过度磷酸化,形成tau蛋白低聚体颗粒,并且激活其下游的kinesin。二者均可引起轴突的传输异常,导致Aβ的沉积,损害神经元。Aβ激活GSK-3β后,磷酸化MEKK1导致JNK活化[19]。活化后的JNK与过度磷酸化的tau蛋白均参与神经原纤维缠结的形成,导致记忆的损害。GSK-3β是tau蛋白正常或异常磷酸化过程中的关键激酶[20]。研究发现,GSK-3β过度表达的小鼠海马内LTP生成减少,tau蛋白过度磷酸化,并且大量神经元凋亡。当抑制tau蛋白过度磷酸化,可以改善记忆的损害[21]。
GSK-3β除了参与Aβ沉积和tau蛋白过度磷酸化引起的AD,还可能通过凋亡机制参与老年痴呆的发病过程。GSK-3β本身就是引起神经元凋亡的关键,在老化的神经细胞中GSK-3β的含量明显增多。小鼠脑内的齿状回区是神经元再生区域,GSK-3β过表达的转基因小鼠中,齿状回的体积变小,且神经元再生受到抑制。
3.4 GSK-3β与疼痛 疼痛是组织损伤或潜在组织损伤所引起的不愉快感觉和情感体验,是一种亟待解决的公众健康问题,影响着全球15%-29%人口的身心健康。2010年,Martins等[22]研究发现,腹腔注射 GSK-3β抑制剂 ARA014418可以明显减轻腹腔注射醋酸引起的伤害性感觉,鞘内注射AR-A014418也可减轻福尔马林引起的疼痛,局部注射同样可以减轻谷氨酸、TNF-α以及IL-1β引起的痛觉过敏。由此可见,GSK-3β抑制剂对急性痛有明显的镇痛作用。
神经病理性疼痛是一种由躯体感觉神经系统的损伤或疾病引起的疼痛。Mazzardo-Martins等[5]研究发现,GSK-3β抑制剂AR-A014418可以减轻啮齿类动物持续的神经病理性疼痛,而停用AR-A014418后,由SNI引起的痛觉过敏恢复,再次鞘内注射AR-A014418 1 d后,又可产生明显的镇痛作用。在神经病理性疼痛中,下行抑制系统(5-HT及儿茶酚胺类为主要递质)在痛觉敏化过程中亦发挥重要作用。GSK-3β抑制剂锂或者AR-A014418可以通过增加5-HT介导的下行抑制系统,产生抑制痛觉过敏的作用[23]。2012年Yuan等[24]证实,抑制脊髓神经元GSK-3β的活性可以明显减轻瑞芬太尼引起的痛觉过敏。2013年,继续研究证实,GSK-3β活性增高参与瑞芬太尼引起的痛觉过敏是通过NMDA受体途径实现的。
此外,GSK-3β还参与阿片类药物耐受的机制,如GSK-3β抑制剂Valproate减轻吗啡耐受性,产生良好的镇痛作用[25]。Parkitna等[26]的研究证实,单次或多次鞘内注射GSK-3β抑制剂SB216763均可以逆转吗啡耐受现象,增加大鼠在热刺激下的甩尾潜伏期,并且对已经产生吗啡耐受的大鼠鞘内注射SB216763可恢复吗啡的镇痛作用。
GSK-3β可能主要通过调节神经元与胶质细胞的活性及炎症反应程度,在痛觉的产生与发展过程中发挥作用。研究表明,无论是在外周还是在中枢神经系统中,磷酸化的GSK-3β在调节促炎因子与抗炎因子平衡中是至关重要的。神经损伤后,因胶质细胞激活产生的大量细胞因子、炎性介质[27]和神经活性物质,使神经元和胶质细胞出现痛觉敏化,使病理性疼痛进一步发展和持续。GSK-3β活化对于活化Toll样受体,产生促炎及抗炎因子是必需的,在人类单核细胞中LPS通过活化TLR,经PIK-AKT通路抑制GSK-3β的活性以及降低NF-κB核内转录活性来参与炎症反应[5]。NF-κB核内转录活性减低,可以大大减少 IL-6、IL-1β、IFNγ、TNF-α等可引起疼痛的促炎因子的生成,从而缓解疼痛。此外,活化的TLR也可通过PIK-AKT-GSK-3β通路增加CREB,使得抗炎因子 IL-10表达增多[23]。
4 结语
作为细胞内一种常见酶,GSK-3β调控多种底物,成为众多信号转导通路的汇聚点,参与胚胎发育、细胞周期的调控、细胞分化与凋亡、细胞的运动与黏附及炎症反应等多种生理过程。见Fig 1。近年来,随着基础及临床研究的不断深入,关于GSK-3β参与各种神经精神疾病机制的认识不断提高。更多随机、对照、前瞻、多中心性的研究有助于进一步揭示GSK-3β相关药物的作用机制,此类药物可能为多种神经精神类疾病提供有效的治疗。
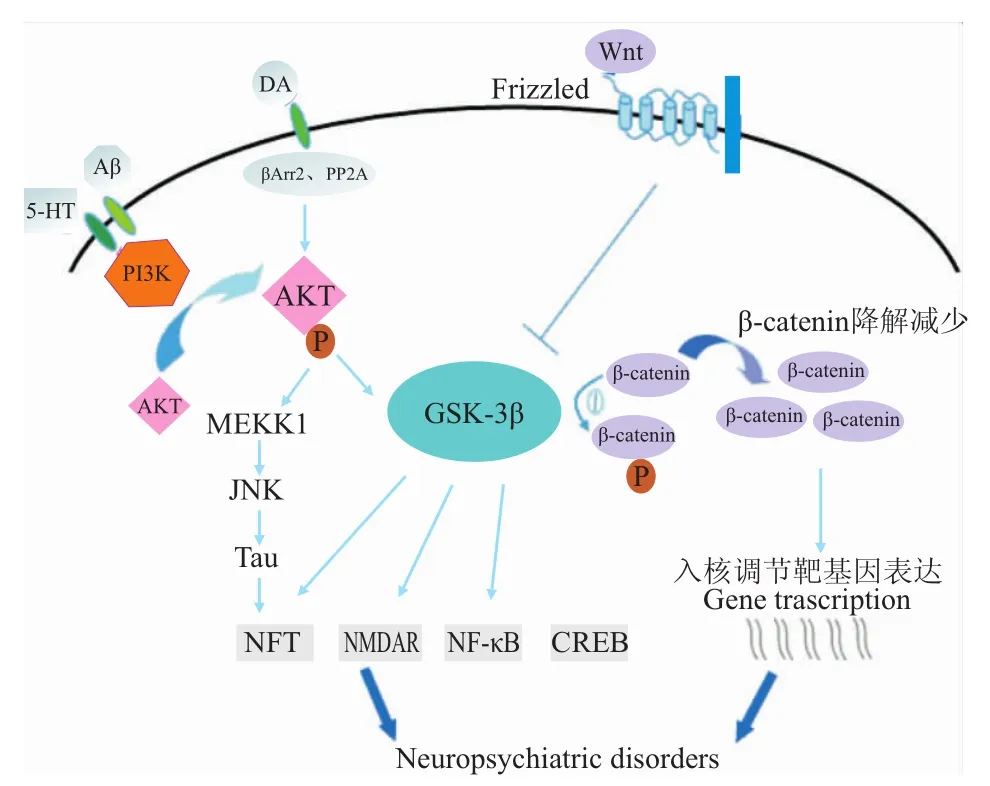
Fig 1 M echanism s of PI3K-AKT-GSK-3βand W nt signaling pathways participating in neuropsychiatric disorders
参考文献:
[1] Embi N,Rylatt D B,Cohen P.Glycogen synthase kinase-3 from rabbit skeletalmuscle separation from cyclic-AMP-dependent protein kinase and phosphorylase kinase[J].Eur J Biochem,1980,107(2):519-27.
[2] Sato S,Tatebayashi Y,Akagi T,et al.Aberrant tau phosphorylation by glycogen synthase kinase-3beta and JNK3 induces oligomeric tau fibrils in COS-7 cells[J].J Biol Chem,2002,277(44):42060-5.
[3] Emamian E S,Hall D,Birnbaum M J,et al.Convergent evidence for impaired AKT1-GSK3beta signaling in schizophrenia[J].Nat Genet,2004,36(2):131-7.
[4] Wang H,Brown J,Martin M.Glycogen synthase kinase 3:a point of convergence for the host inflammatory response[J].Cytokine,2011,53(2):130-40.
[5] Mazzardo-Martins L,Martins D F,Stramosk J,et al.Glycogen synthase kinase 3-specific inhibitor AR-A014418 decreases neuropathic pain in mice:evidence for themechanisms of action[J].Neuroscience,2012,226(13):411-20.
[6] 毛伟峰,李 佳,袁崇刚.多功能的蛋白:糖原合成酶激酶-3[J].生命科学,2005,17(1):45-8.
[6] MaoW F,Li J,Yuan CG.Multi-function kinase:glycogen synthase kinase-3[J].Chin Bull Life Sci,2005,17(1):45-8.
[7] 熊 涛,屈 艺,母得志.AKT-GSK3信号通路与缺血缺氧性脑损伤 [J].医学综述,2010,16(23):3521-4.
[7] Xiong T,Qu Y,Mu D Z.AKT-Glycogen synthase kinase3 pathway and hypoxic-ischemic brain injury[J].Med Recap,2010,16(23),3521-4.
[8] Ciani L,Salinas PC.WNTs in the vertebrate nervous system:from patterning to neuronal connectivity[J].Nat Rev Neurosci,2005,6(5):351-62.
[9] Jope R S,Roh M S.Glycogen synthase kinase-3(GSK3)in psychiatric diseases and therapeutic interventions[J].Curr Drug Targets,2006,7(11):1421-34.
[10]Blankesteijn W M,van de Schans V A,ter Horst P,etal.TheWnt/frizzled/GSK-3 beta pathway:a novel therapeutic target for cardiac hypertrophy[J].Trends Pharmacol Sci,2008,29(4):175-80.
[11]Chubb J E,Bradshaw N J,Soares D C,et al.The DISC locus in psychiatric illness[J].Mol Psychiatry,2008,13(1):36-64.
[12]Beaulieu JM,Sotnikova T D,Yao W D,et al.Lithium antagonizes dopamine-dependent behaviors mediated by an AKT/glycogensynthase kinase3 signaling cascade[J].Proc Natl Acad SciUSA,2004,101(14):5099-104.
[13]Li X,Zhu W,Roh M S,et al.In vivo regulation of glycogen synthase kinase-3beta(GSK3beta)by serotonergic activity in mouse brain[J].Neuropsychopharmacology,2004,29(8):1426-31.
[14]Beaulieu JM.A role for Akt and glycogen synthase kinase-3 as integrators of dopamine and serotonin neurotransmission in mental health[J].JPsychiatry Neurosci,2012,37(1):7-16.
[15]Koros E,Dorner-Ciossek C.The role of glycogen synthase kinase-3beta in schizophrenia[J].Drug News Perspect,2007,20(7):437-45.
[16]Gould TD,Einat H,Bhat R,etal.AR-A014418,a selective GSK-3 inhibitor,produces antidepressant-like effects in the forced swim test[J].Int JNeuropsychopharmacol,2004,7(4):387-90.
[17]Mao Y,Ge X,Frank C L,et al.Disrupted in schizophrenia 1 regulates neuronal progenitor proliferation via modulation of GSK 3beta/beta-catenin signaling[J].Cell,2009,136(6):1017-31.
[18]Selkoe D J.Altered structural proteins in plaques and tangles:what do they tell us about the biology of Alzheimer′s disease[J].Neurobiol Aging,1986,7(6):425-32.
[19]Kim JW,Lee JE,Kim M J,etal.Glycogen synthase kinase3 beta is a natural activator ofmitogen-activated protein kinase/extracellular signal-regulated kinase kinase kinase 1(MEKK1)[J].J Biol Chem,2003,278(16):13995-4001.
[20]孙治坤,杨红旗,陆国强,等.氯化锂抑制β-淀粉样蛋白诱导细胞 Tau蛋白磷酸化 [J].中国药理学通报,2008,24(1):24-8.
[20]Sun Z K,Yang H Q,Lu G Q,et al.The effects of LiCl on Tau phosphorylation induced byβ-amyloid peptide[J].Chin Pharmacol Bull,2008,24(1):24-8.
[21]Zhang X,Heng X,Li T,et al.Long-term treatmentwith lithium alleviatesmemory deficits and reduces amyloid-beta production in an aged Alzheimer’s disease transgenicmousemodel[J].JAlzheimers Dis,2011,24(4):739-49.
[22]Martins D F,Rosa A O,Gadotti V M,et al.The antinociceptive effects of AR-A014418,a selective inhibitor of glycogen synthase kinase-3 beta,in mice[J].JPain,2011,12(3):315-22.
[23]Hofmann C,Dunger N,Schölmerich J,et al.Glycogen synthase kinase3-β:a master regulator of toll-like receptor-mediated chronic intestinal inflammation[J].Inflamm Bowel Dis,2010,16(11):1850-8.
[24]Yuan Y,Wang JY,Yuan F,etal.Changes ofglycogen synthase kinase-3βand its phosphorylation in spinal cord neurons in ratswith incisional pain-remifentanil-induced hyperalgesia[J].Natl Med J China,2012,92(7):435-9.
[25]Dobashi T1,Tanabe S,Jin H,et al.Valproate attenuates the development ofmorphine antinociceptive tolerance[J].Neurosci Lett,2010,485(2):125-8.
[26]Parkitna JR,Obara I,Wawrzczak-Bargiela A,et al.Effects of glycogen synthase kinase3βand cyclin-dependent kinase5 inhibitors on morphine-induced analgesia and tolerance in rats[J].JPharmacol Exp Therapeut,2006,319(2):832-9.
[27]张俊青,吴 芹,龚其海,等.金钗石斛生物总碱对脂多糖激活星形胶质细胞产生炎症因子的影响[J].中国药理学通报,2011,27(6):824-7.
[27]Zhang JQ,Wu Q,Gong Q H,et al.Effects of Dendrobium nobile total alkaloids on lipopolysaccharide-induced astrocyte activation and pro-inflammatory factors production[J].Chin Pharmacol Bull,2011,27(6):824-7.