异丙肾上腺素致小鼠心肌纤维化模型的制备及评价
2014-05-18谢梅林
陈 蓉,谢梅林
(1.苏州大学附属第一医院药学部,江苏苏州 215006;2.苏州大学医学部药理系,江苏苏州 215123)
心肌纤维化是多种心血管系统疾病终末期的共同病理表现,有效地抑制和逆转心肌纤维化、心室重塑是目前临床防止心力衰竭、心律失常及心源性猝死等严重不良事件的主要策略[1],其形成机制复杂,涉及肾素-血管紧张素-醛固酮系统(RAAS)及多种细胞因子,是心血管研究领域的重点、难点课题之一。因此,建立一种简单、经济、可靠的心肌纤维化动物模型对于心肌纤维化的研究有着重要意义。
目前,实验性动物心肌纤维化的造模方法有:①自发性高血压大鼠(SHR)心肌纤维化[2];② 糖尿病大鼠心肌纤维化[3];③ 结扎腹主动脉或单侧肾动脉致心肌纤维化[4];④冠脉结扎法等引起心肌梗死心肌纤维化[5];⑤异丙肾上腺素诱导心肌缺血损伤心肌纤维化[6];⑥病毒感染致病毒性心肌病[7]。其中,异丙肾上腺素皮下注射诱导的心肌纤维化模型优势在于方法简单,无创且接近自然病程。大鼠皮下注射异丙肾上腺素诱导的心肌纤维化文献较多,小鼠相关的文献较少,且异丙肾上腺素的给药剂量、给药间隔报道不一致[8]。本实验对异丙肾上腺素的给药剂量、给药间隔进行了摸索,成功建立了小鼠的心肌纤维化模型。
1 材料与方法
1.1 动物 SPF级昆明种♂小鼠,22~25 g,由苏州大学实验动物中心提供。实验动物生产许可证:SCXK(苏)2007-0007;实验动物使用许可证:SYXK(苏)2007-0035。实验处置符合动物伦理学标准。
1.2 仪器与药物 倒置显微镜XDS-1B型(重庆光学仪器厂);722型分光光度计(上海精密科学仪器有限公司);DS-671电子秤(上海寺冈电子有限公司);80-2型台式低速离心机(上海医疗器械集团有限公司);PK-S22电热恒温水浴锅(上海精宏仪器设备有限公司);MR23i高速冷冻离心机(法国Jouan公司);MyCycler TM型 PCR仪(美国 Bio-rad公司)。异丙肾上腺素购自上海禾丰制药有限公司;Hydro试剂盒购自南京建成生物公司;CollagenⅠ引物购自上海生工科技公司。其余试剂为分析纯。
1.3 模型制备 将昆明种小鼠随机分为心肌纤维化模型组和溶媒对照组,每组10只。模型组小鼠皮下注射5 mg·kg-1异丙肾上腺素1 d后,以2.5 mg·kg-1维持至30 d。溶媒对照组同法皮下注射等量的生理盐水。
1.4 心重指数(cardiac weight index,CW I)测定 末次注射异丙肾上腺素(对照组注射生理盐水)后次日,2组小鼠称重,颈椎脱臼处死小鼠,取小鼠心脏,称重,计算CWI。CWI(mg/g)=全心重/体重。
1.5 小鼠心肌中羟脯氨酸(hydroxyproline,Hydro)含量测定 采用消化法检测小鼠心肌中Hydro含量,组织中的胶原经酶消化产生Hydro,Hydro在氧化剂的作用下所产生的氧化产物,与二甲氨基苯甲醛作用呈现紫红色,在550 nm测定Hydro含量,具体操作按照Hydro测定试剂盒。考马斯亮蓝法测定总蛋白含量,具体操作按照总蛋白测定试剂盒进行。Hydro含量计算公式:

1.6 小鼠心室HE染色和M asson染色 小鼠心脏样本在10%甲醛溶液中固定、石蜡包埋、切片,进行HE和Masson染色,观察心肌纤维化的程度和胶原的含量,采用自动成像分析系统(Visilog 4.1.5,Noesis),计算心肌胶原容积分数(collagen volume fraction,CVF)。CVF为胶原的面积占总面积的比值。
1.7 CollagenⅠ mRNA测定 小鼠左心室匀浆后,用TRIzol提取总RNA,进行逆转录和PCR。CollagenⅠ的引物:上游 5′-ACGTCCTGGTGAAGTTGGTC-3′,下游 5′-CAGGGAAGCCTCTTTCTCCT-3′,扩增片段长度为169 bp,退火温度为55℃。GAPDH的引物:上游 5′-GTATGACGTGGAGTCTACTG-3′,下游 5′-TACTCCTTGGAGGCCATGTA-3′,扩增片段长度为728 bp,退火温度为56℃。PCR产物在2%琼脂糖凝胶上电泳,结果经凝胶扫描图像处理系统分析,以CollagenⅠ基因扩增带灰度与同管扩增的GAPDH基因扩增带灰度之比表示CollagenⅠmRNA表达水平。
1.8 统计学处理 实验数据以±s表示,显著性检验采用one-way ANOVA。
2 结果
2.1 对CW I和小鼠心肌中Hydro含量的影响 皮下注射异丙肾上腺素后,模型组的CWI和Hydro含量均较溶媒对照组明显增加(P<0.01),见Fig 1和Fig 2。
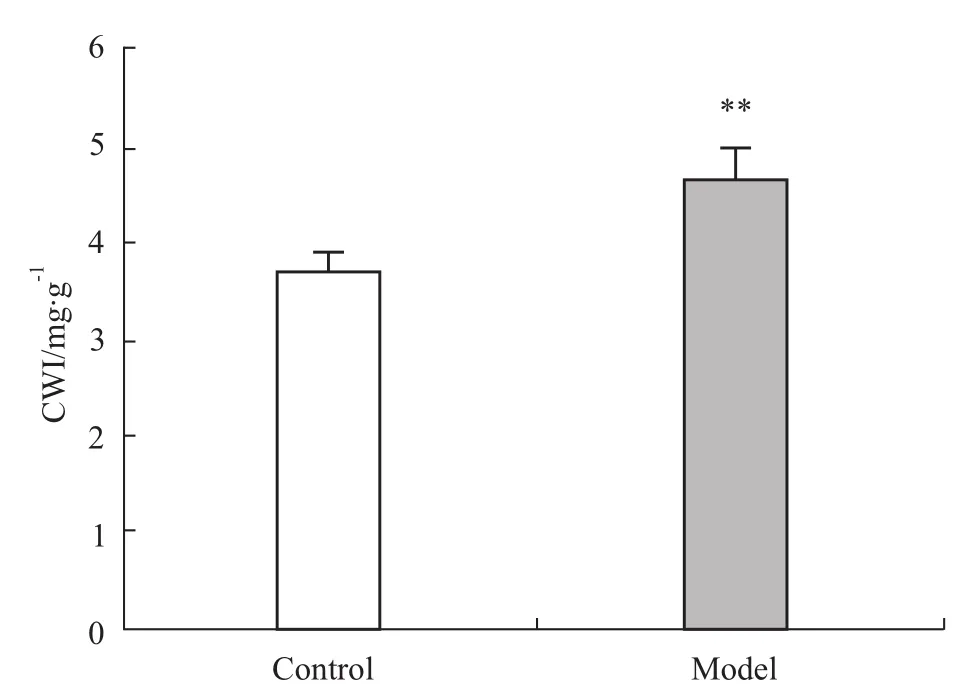
Fig 1 Com parison of CW I from control group and model group(±s,n=10)**P<0.01 vs control group
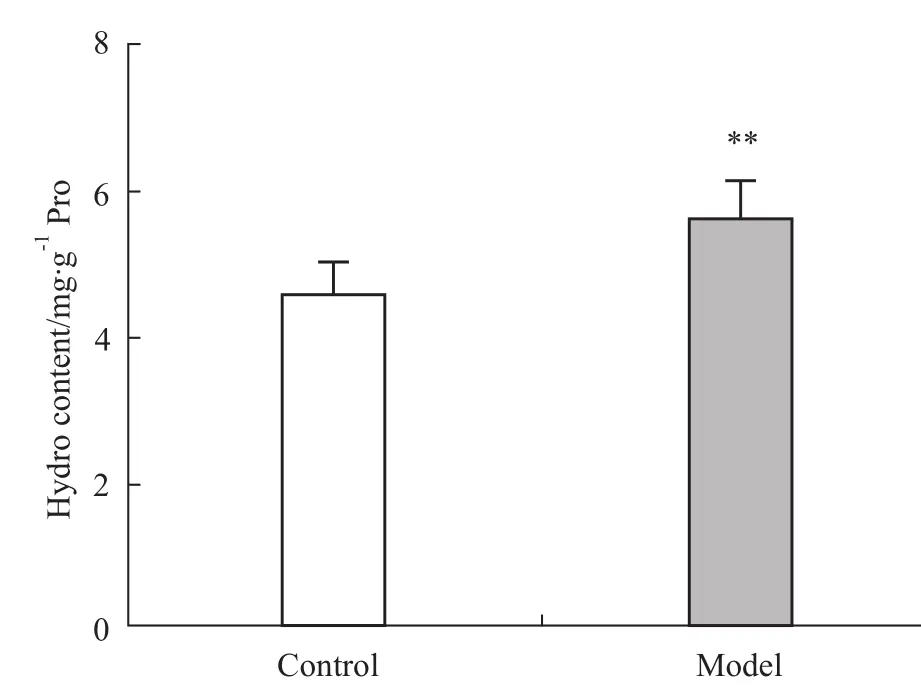
Fig 2 Comparison of Hydro content in m yocardial tissues from control group and model group±s,n=10)**P<0.01 vs control group
2.2 小鼠心室HE和M asson染色结果 HE染色和Masson染色结果如Fig 3和Fig 4A所示,溶媒对照组心肌细胞排列整齐,形状基本一致;模型组心肌细胞间可见有较多的纤维组织。CVF计算结果显示,模型组较溶媒对照组明显增加(P<0.01),见 Fig 4B。
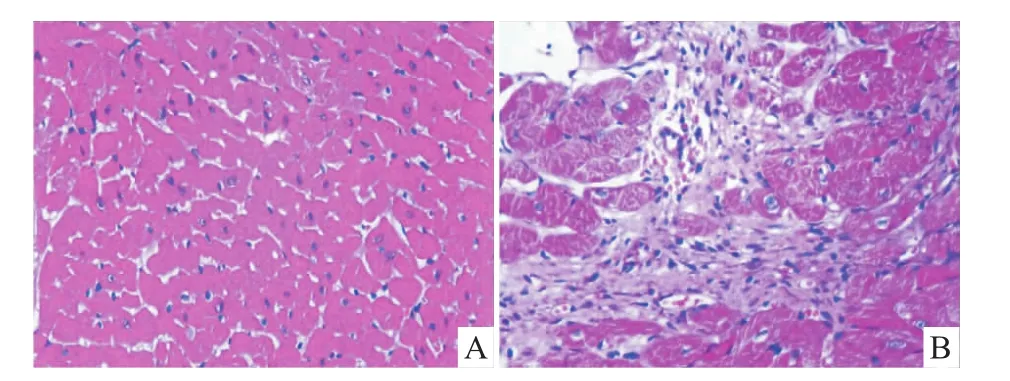
Fig 3 Com parison of histopathological changes ofm yocardial tissues from control group and model group(HE staining,400×)A:Control group;B:Model group
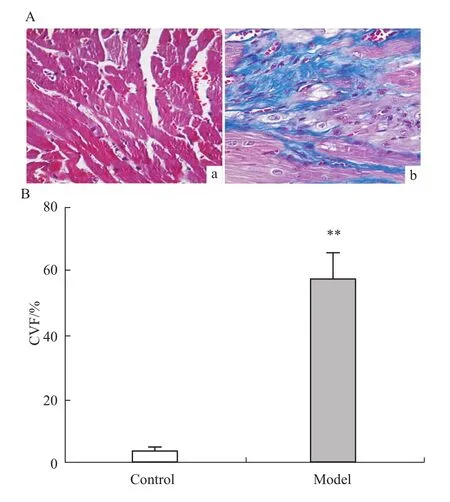
Fig 4 Comparison of histopathological changes ofmyocardial tissues from control group and model group by Masson staining(40×)a:Control group;b:Model group;B:CVF(x¯±s,n=10).**P<0.01 vs control group
2.3 心肌CollagenⅠ mRNA的表达 RT-PCR结果显示,与对照组比较,模型组CollagenⅠmRNA表达明显增加(P<0.01),见 Fig 5。
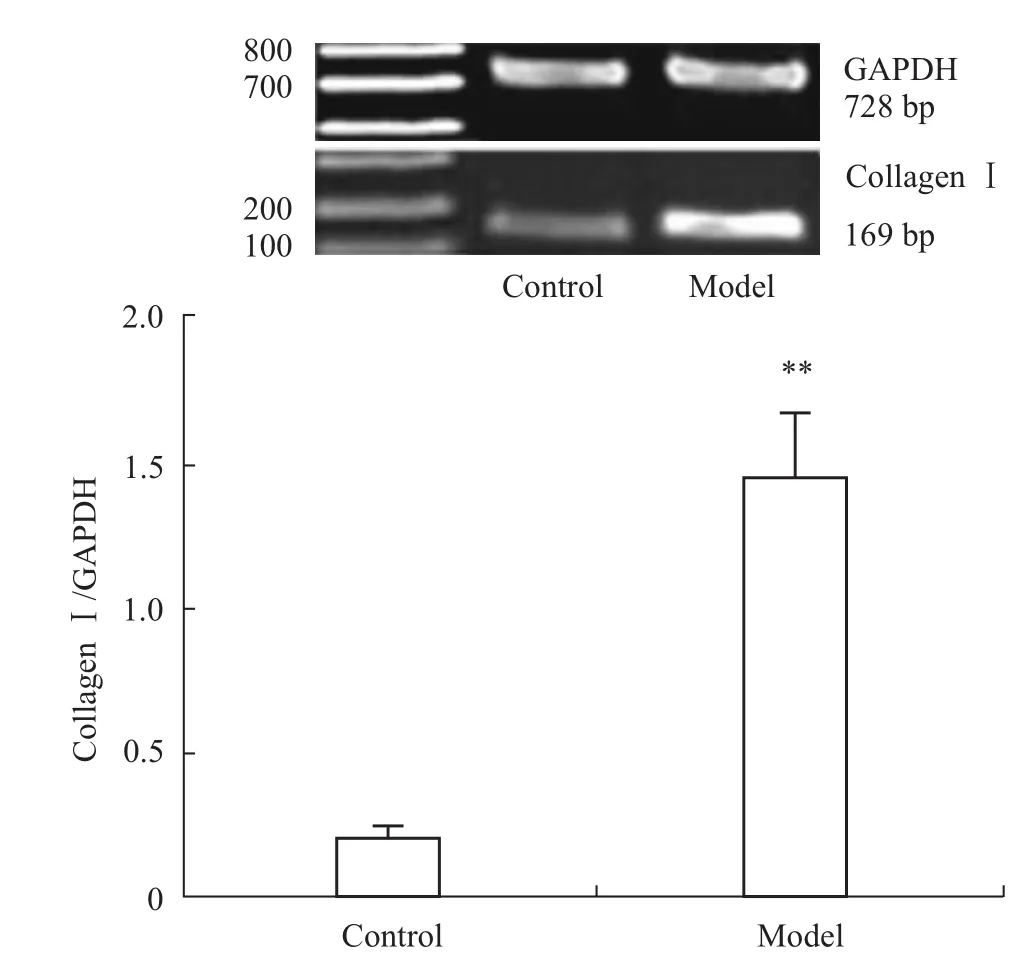
Fig 5 Com parison of CollagenⅠm RNA expression in the left ventricle from control group and model group(x¯±s,n=10)**P<0.01 vs control group
3 讨论
异丙肾上腺素在诱导小鼠心肌纤维化的过程中,通过激活RAAS系统,明显增加血浆中肾素、醛固酮和血管紧张素转化酶(ACE)活性[9],增加血浆中血管紧张素Ⅱ,而醛固酮通过盐皮质受体增加心肌AT l受体水平[10],进而血管紧张素Ⅱ通过激活ATl受体降低心肌成纤维细胞中胶原酶的活性[11],最终增加心肌间质胶原的合成,促进心肌纤维化的发生发展[12-13]。
我们通过前期的预实验和本研究发现,在用异丙肾上腺素制备小鼠心肌纤维化模型的过程中,异丙肾上腺素皮下注射的剂量、间隔时间和环境温度是模型成功与否的3个关键因素。异丙肾上腺素是β受体激动剂,作用于心脏β1受体,使心肌收缩力增强、心率加快、心输出量和心肌耗氧量增加。异丙肾上腺素皮下注射剂量过大,是导致小鼠死亡的直接原因。但是,若是皮下注射异丙肾上腺素剂量过小,小鼠通过自身代偿机制,又不容易形成纤维化。因此,如何选择一种合适的剂量,使小鼠容易形成心肌纤维化,又不致死,是该模型能否成功的关键因素之一。我们在预实验的研究中,异丙肾上腺素首先从40 mg·kg-1初始剂量皮下注射开始摸索,结果发现,每次皮下注射后都会有不同数量的小鼠死亡,随着给药天数的增加,最后存活的小鼠所剩无几。所以,我们逐渐降低异丙肾上腺素的给药剂量,最后发现,首剂给予冲击剂量5 mg·kg-1,后以2.5 mg·kg-1维持 30 d,每天同一时间注射1次,是小鼠不致死又能造成心肌纤维化模型的适当剂量和给药间隔。心肌纤维化时,心肌组织中胶原纤维过量积聚,心肌胶原主要包括CollagenⅠ和CollagenⅢ,其中CollagenⅠ约占胶原总量的80%~85%,通过测定心肌组织Hydro含量来作为心肌纤维化的标志[14](1 g Hydro相当于8.2 g胶原蛋白)[15],肉眼可以观察到心脏体积和重量的增加(用CWI表示)。实验结果显示,在该注射方案下,心肌纤维化模型组小鼠的CWI、Hydro含量以及CollagenⅠmRNA表达明显增加,HE和Masson染色可更加直观地看出模型组小鼠心肌组织中的胶原明显增加,心肌细胞排列不整齐,心肌细胞间可见有较多的纤维组织。另外,环境温度控制也非常关键,环境温度过高,加快异丙肾上腺素的吸收,也容易导致小鼠的死亡,尤其是在天气炎热的季节,更应严格控制动物房内的环境温度。一般将温度控制在18~22℃之间为宜。
本研究通过皮下注射异丙肾上腺素成功制备了小鼠心肌纤维化模型,相比于其他造模的方法,该方法不需要开腹、开胸,损伤小,死亡率很低;用小鼠做实验更加易于操作;同时,该方法制备的模型符合缺血性心肌损伤的病理进程,是制备心肌纤维化理想的动物模型,为心肌纤维化的研究提供了一种简便、经济、可靠的小鼠模型。
参考文献:
[1] 吴远贵,李 谦,马礼坤.瑞舒伐他汀与去氧皮质酮-盐诱导的心肌纤维化[J].安徽医药,2013,34(9):1273-6.
[1] Wu Y G,Li Q,Ma L K.Rosuvastatin and desoxycorticosteronesalt-induced myocardial fibrosis[J].Anhui Med J,2013,34(9):1273-6.
[2] 黄 立,李 林,王泰龄,等.中药降压脉净对心肌组织转化生长因子-β1的影响及干预心肌纤维化的作用 [J].中国心血管病研究,2007,5(9):688-91.
[2] Huang L,Li L,Wang T L,etal.Effectof TCM formula(Jiangya Maijing granules,JMG)onmyocardial TGF-β1 and intervention of myocardial fibrosis in SHR[J].Chin JCardiovasc Rev,2007,5(9):688-91.
[3] 赵田田,王晓梅.中药通心络对糖尿病大鼠心肌纤维化的影响 [J].中国老年学杂志,2011,31(1):95-8.
[3] Zhao T T,Wang X M.Effect of Tongxinluo ultrafine powder on myocardial fibrosis of ratswith diabetesmellitus[J].Chin JGerontol,2011,31(1):95-8.
[4] 刘 杰,吴隐雄,邓金龙.肾动脉狭窄心衰和冠脉结扎心衰大鼠模型的对比研究 [J].微创医学,2011,6(4):301-3.
[4] Liu J,Wu Y X,Deng JL.Comparison of heart failure ratmodels between renal artery stenosis and coronary ligation caused[J].J Minim Invasive Med,2011,6(4):301-3.
[5] 李 娟,丁永芳,葛海燕,等.冠状动脉结扎致心肌纤维化大鼠模型的建立 [J].中国实验动物学报,2012,20(5):1-4.
[5] Li J,Ding Y F,Ge H Y,et al.Establishment of a ratmodel of myocardial fibrosis induced by coronary artery ligation[J].Acta Lab Ani Sci Sinica,2012,20(5):1-4.
[6] 刘诗英,刑卫平,吴志勇,等.葛根素对心肌纤维化模型大鼠左室心肌组织中转化生长因子β-1和结缔组织生长因子表达的影响 [J].临床心血管疾病杂志,2010,26(12):942-6.
[6] Liu SY,XingW P,Wu ZY,etal.Effectsof puerarin on the expression of TGF-β1 and CTGF in left ventriclemyocardial tissue of the rats with myocardial fibrosis[J].J Clin Cardiol,2010,26(12):942-6.
[7] Chen P,Xie Y G,Shen E,etal.Astragaloside IV attenuatesmyocardial fibrosis by inhibiting TGF-β1 signaling in coxsackievirus B3-induced cardiomyopathy[J].Eur JPharmacol,2011,658(2-3):168-74.
[8] 李 明,张 军,陈 燕,等.丹参抑制异丙肾上腺素引起的小鼠心肌肥厚和纤维化及其作用机制[J].中国药科大学学报,2003,34(6):565-8.
[8] Li M,Zhang J,Chen Y,et al.Danshen inhibiting isoproterenol induced cardiac hypertrophy and fibrosis in mice and its mechanisms[J].JChin Pharm Uni,2003,34(6):565-8.
[9] Grimm D,Elsner D,Schunkert H,et al.Development of heart failure following isoproterenol administration in the rat:role of the rennin-angiotensin system[J].Cardiovasc Res,1998,37(1):91-100.
[10]Silvestre JS,Heymes C,Oubénaïssa A,etal.Activation of cardiac aldosterone production in ratmyocardial infarction:effect of angiotensin II receptor blockade and role in cardiac fibrosis[J].Circulation,1999,99(20):2694-701.
[11]Brilla CG,Zhou G,Matsubara L,et al.Collagen metabolism in cultured adult rat cardiac fibroblasts:response to angiotensin II and aldosterone[J].JMol Cell Cardiol,1994,26(7):809-20.
[12]Ruperez M,Lorenzo O,Blanco-Colio LM,et al.Connective tissue growth factor is a mediator of angiotensin II-induced fibrosis[J].Circulation,2003,108(12):1499-505.
[13]Villarreal F J,Kim N N,Ungab GD,etal.Identification of functional angiotensin II receptors on rat cardiac fibroblasts[J].Circulation,1993,88(6):2849-61.
[14]裘益青,吕俊升,胡晓晟.尼群地平预防自发性高血压大鼠心肌纤维化的实验研究[J].中华心血管病杂志,1996,24(2):104-6.
[14]Qiu Y Q,Lv JS,Hu X S.Prevention ofmyocardial fibrosis by using nitrendipine to the spontaneously hypertensive rats[J].Chin J Cardiol,1996,24(2):104-6.
[15]李忠艳,李长育.胰岛素抵抗高血压大鼠心肌纤维化的研究[J].中国心血管杂志,2002,7(3):153-6.
[15]Li Z Y,Li C Y.A study of themyocardial fibrosis in insulin resistant hypertensive rats[J].Chin J Cardiovasc Med,2002,7(3):153-6.