长江沿线城市水源氯(胺)化消毒副产物生成潜能研究
2014-05-11朱文倩马玉英
黄 河,徐 斌*,朱文倩,秦 朗,马玉英
(1.同济大学污染控制与资源化研究国家重点实验室,长江水环境教育部重点实验室,上海 200092;2.上海市自来水市南有限公司闵行自来水厂,上海 200245)
长江沿线城市水源氯(胺)化消毒副产物生成潜能研究
黄 河1,徐 斌1*,朱文倩1,秦 朗1,马玉英2
(1.同济大学污染控制与资源化研究国家重点实验室,长江水环境教育部重点实验室,上海 200092;2.上海市自来水市南有限公司闵行自来水厂,上海 200245)
以长江上游重庆、中游武汉、下游上海等大城市的长江饮用水源为研究对象,在对溶解性有机物分子量和亲疏水性分离的基础上,分别采用氯和氯胺两种方式消毒,对比分析了相同时期沿江这些城市原水中氯(胺)化常规和新兴含氮消毒副产物生成潜能的分子组成规律.研究表明,重庆、武汉、上海三地的溶解性有机物均以小分子前体物为主,主要分布在<1kDa的区间内,且以强疏水性成分和亲水性成分为主,原水经氯(胺)化可产生三卤甲烷、卤乙酸、卤乙腈、三氯硝基甲烷等类型的消毒副产物;三地的氯(胺)化主要的含碳消毒副产物(C-DBPs)和含氮消毒副产物(N-DBPs)生成潜能均在<1kDa的区间内最大,从上游到下游,在<1kDa的区间内的生成潜能占各自总潜能比例逐渐增加.三地的氯(胺)化的C-DBPs和N-DBPs生成潜能均以强疏水性组分或亲水性组分为主,且氯胺化可导致亲水性组分C-DBPs和N-DBPs生成潜能所占总量比例增加.
分子量;亲水性;疏水性;C-DBPs;N-DBPs;生成潜能
近年来,伴随着经济的快速发展,我国城市水源普遍受工农业废水排放影响,水源水质日益下降,其中有机污染是这些微污染水源的重要特征.水源水中溶解性有机物(DOM)组成种类繁多、分子结构复杂,在饮用水常规净水工艺中一般难以得到有效去除,残存的有机污染物部分本身为有毒有害物质,部分可与氧化性较强的消毒剂发生反应产生”三致”特性较强的消毒副产物(DBPs)[1-2],对饮用水安全构成重大威胁.为此,国家在2012年全面实施的《生活饮用水卫生标准》(GB5749-2006)中大幅度提高了饮用水中有毒有害有机物与DBPs的种类和限值[3].
随着20世纪70年代美国科学家首次发现饮用水中致癌性三卤甲烷类 DBPs以来[4],饮用水DBPs相关研究得到快速发展.尤其是近年来,强“三致”特性的二甲基亚硝胺、卤代硝基甲烷、卤代乙酰胺等含氮消毒副产物(N-DBPs)以及碘代新兴消毒副产物(I-DBPs)逐步被发掘[19],DBPs问题已逐步成为饮用水领域重点关注和研究的热点[5,6].鉴于消毒过程产生的大多DBPs都难于通过常规的处理方法有效去除,因此降低其在饮用水处理工艺中的生成量是控制 DBPs最为有效的手段之一,这其中削减DBPs前体物是关键.为此,探究水源水中 DBPs生成潜能的分子组成规律,掌握DBPs前体物的性质,可以为后续工艺针对性去除该类型有机物提供有效的理论支持.
以上海为中心的长江三角洲经济区,武汉为中心的华中经济区和重庆为中心的西南经济区为依托,横贯东西带动南北,是我国重要的经济发展和人口积聚区域.目前三座城市均以长江为主要的饮用水源,然而因依长江流程、支流的汇入、工农业废水排放、面源污染等影响程度不同,水质存在一定的差异性.为此本文以三地水源水中DBPs前体物为研究对象,开展了三地 DOM与DBPs生成潜能分子组成的对比分析工作,以期能为三城市净水工艺的提升提供技术支撑.
1 材料与方法
1.1 水样采集
三地实验水样于2013年5月同时采集于长江重庆段、武汉段、上海段,水样用棕色玻璃瓶采集,采用 0.45µm 的醋酸纤维膜过滤去除水中悬浮物,4℃避光保存,并尽快运回实验室进行各种水质分析.
1.2 主要试剂与分析方法
含碳消毒副产物(C-DBPs)和含氮消毒副产物(N-DBPs)标准品购自 Sigma-Aldrich公司,含碳消毒副产物(C-DBPs)主要包括了 4种三卤甲烷(THMs)、6种卤乙酸(HAAs)和2种卤代丙酮(HKs).含氮消毒副产物(N-DBPs)标准品主要为3种卤乙腈(HANs)和三氯硝基甲烷(CP).氯化反应及氯胺配置用次氯酸钠(4%~5%有效氯)溶液、树脂分离用Amberlite XAD-8和XAD-4树脂均购自 Sigma-Aldrich公司.实验所使用的浓硫酸、氢氧化钠、氯化铵、磷酸二氢钾、无水硫酸钠、硫代硫酸钠等分析纯或优级纯试剂,购自国药集团化学试剂有限公司(上海);DBPs萃取用甲基叔丁基醚(MtBE)购自 J.T.Baker(美国);超纯水由 Milli-Q超纯水机制备,购自美国 Millpore公司.
水样溶解性有机碳(DOC)和 254nm紫外吸光值(UV254)分别采用岛津TOC-L和Unico 4802进行分析;水样中THMs、HKs、HANs和CP的分析依照EPA551.1的方法进行[7];水样中HAAs分析依照EPA552.2的方法进行[8];经MtBE萃取后的分析样品采用 GC-ECD进行分析(岛津GC2010),采用的色谱柱为 HP-5 (30m×0.32mm ID0.25µm).
1.3 有机物分离
水中 DOM的分子量分布试验采用超滤膜法进行分析[9].0.45µm 膜过滤后水样放置于超滤杯中,保持高纯氮气压力条件下,分别单独通过截留分子量为 10kDa(0.1MPa)和 1kDa(0.2MPa)的再生纤维素超滤膜(Millpore,美国),收集膜过滤后出水并进行DOC、UV254等水质指标的直接测定,水样DBPs生成潜能通过过量氯(胺)化反应后测定,分析某一分子量区间的有机物和 DBPs潜能含量时使用差减法获得.
水样有机物亲疏水性组分采用 XAD-4和XAD-8树脂进行分离[10-11].将XAD-8与XAD-4两只填充柱串联,置于固相萃取装置上,通过隔膜泵真空抽吸,水样依次通过两支树脂柱.吸附在XAD-8树脂上的DOM为强疏水性有机物,吸附在 XAD-4树脂上的 DOM是弱疏水性有机物,经过 2个树脂柱的过滤液用容器承接,这部分水样中的 DOM为亲水性有机物.将两个树脂柱上的有机物分别采用 0.1mol/L的 NaOH进行洗脱,XAD-8的洗脱液为强疏水性有机物,XAD-4的洗脱液为弱疏水性有机物.各部分水样分别进行DOC、UV254和消毒副产物生成潜能的分析.
1.4 氯(胺)化DBPs生成潜能试验
试验采集水样、分子量分离水样和树脂分离水样均进行氯(胺)化 DBPs潜能试验[12].其简要步骤为:磷酸盐缓冲体系溶液(10mol/L)控制各水样 pH值为中性(pH=7±0.02),分别加入氯和氯胺进行过量反应(投加量的计算方法见式(1)和式(2)[12]),准备好的样品放置于带聚四氟乙烯垫的安培瓶中,保证瓶内无空气并密闭,放置于黑暗环境的控温培养箱内[(25±1)℃]顶空培养,反应 7d后,取一定样品加入过量氯化氨溶液将余氯淬灭,并依照EPA551.1和EPA552.2进行各类型DBPs的浓度分析.

2 结果与讨论
2.1 水源水中溶解性有机物分子组成对比分析
以DOC和UV254为水中DOM含量的表征指标,对长江重庆段、武汉段、上海段原水进行分子量和亲疏水性分布试验,其结果如表1所示,其中SUVA的值为UV254/DOC乘以100计算.

表1 三地水中DOM分子量与亲疏水性的UV254和DOC分布Table 1 Distribution of UV254and DOC in dissolved organic matter from three cities in different molecular weight and hydrophobicity

表2 三地原水中各种离子分布(mg/L)Table 2 Distribution of anions in raw water from three cities (mg/L)
从表1可以看出,长江重庆段DOC和UV254明显高于其他两座城市原水,而武汉段、上海段原水中DOC含量相当.随着长江的流程SUVA值基本呈现逐步下降的趋势,分析其原因认为长江上游受人工污染较少,DOM 主要由天然腐殖质类物质构成,因此重庆段原水SUVA值相对较高;随着自净作用长江干流天然腐殖质类有机物浓度呈现下降趋势,而同时受沿江中下游经济发达地区工农业和生活污水排放增加影响,中游武汉段和下游上海段原水 SUVA值呈现明显低于上游的规律.从分子量分布规律上分析,重庆、武汉、上海三地水源DOM分布均以<1kDa和>10kDa的有机物为主,以UV254变化为例,重庆、武汉、上海三地水源<1kDa的 DOM所占比例分别是35.3%,37.9%,50.9%,>10kDa的DOM所占比例分别是30.5%,43.1%,30.9%;以DOC变化为例,各地<1kDa的 DOM所占比例分别是 37.8%,44.2%, 49.8%,各地>10kDa的 DOM所占比例分别是30.2%,32.4%,29.5%,这与前人研究的试验结果[13]基本一致.然而从长江上游到下游,水中小分子的DOM 含量所占比例呈逐渐增高的趋势,这有可能是由于沿江工农业排放小分子人工污染物所导致[14-15].
从表 1可以看出,重庆、武汉、上海水源原水 DOM均以亲水性组分或强疏水性组分为主,以 UV254变化为例,重庆、武汉、上海水源强疏水性组分和亲水性组分分别占其总比例的43.8%和 20.6%,46.7%和 24.4%,46.7%和33.3%;以DOC变化为例,重庆、武汉、上海水源强疏水性组分和亲水性组分分别占其总比例的 44.2%和27.4%,49.8%和24.9%,40.4%和28.1%.可以看出,从长江上游到下游,总体上强疏水性组分所占比例较高,但水中以亲水性 DOM的含量所占比例逐渐升高,这可能是由于沿江工农业废水排放,导致水中亲水性有机物增加导致的[14-15].
2.2 氯(胺)化消毒过程 DBPs生成潜能的分子量分布规律的对比
2.2.1 氯化消毒过程 DBPs生成潜能的分子量分布规律对比 将长江重庆段、武汉段和上海段原水,分别单独使用不同截留分子量的超滤膜进行过滤试验,分离后水样进行氯化生成潜能培养实验,得到 C-DBPs(主要包括 THMs、HKs和HAAs)和N-DBPs(HANs和CP)生成潜能随分子量分布规律,结果见图1.
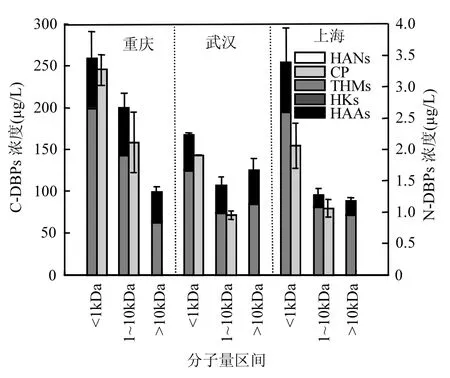
图1 氯化消毒DBPs生成潜能的分子量分布规律Fig.1 DBPs from DOM molecular weight distribution during chlorination
从图 1可见,三地原水经氯化后可以产生一定含量的THMs、HKs、HAAs和CP,但均不产生HANs,其中均是以THMs和HAAs所占比例最高为主.N-DBPs可能是由水中的含氮有机物氯化所产生[16].从C-DBPs生成量来看,三地原水分子量<1kDa有机物的C-DBPs生成量最高,重庆、武汉和上海分别为255.8,167.5,253.7µg/L,占C-DBPs的总量比例分别为 46.4%,41.9%和58.0%,且其分布规律为 C-DBPs的生成量均随着DOM分子量的增大而减小,基本与DOM分子量的分布规律相一致.重庆的C-DBPs生成量要高于武汉和上海,且重庆在 1~10kDa区间内C-DBPs生成量较高,为199.6µg/L,这可能是由于重庆在各区间DOM的SUVA254较高,腐植酸类的前体物较多导致的[15].上海地区<1kDa区间产生的C-DBPs与重庆相当,这主要是由于上海处于长江入海口,受海水上溯影响,原水中溴离子明显高于重庆与武汉,因此水中溴代 THMs和HAAs浓度较高时导致DBPs总量较多[18].
从N-DBPs生成量来看,重庆、武汉、上海三地均在<1kDa区间内N-DBPs的生成量最高,分别为3.3,1.9,2.1µg/L,N-DBPs生成量均随着分子量的增加而减少,三地 CP生成仅发生在<10kDa的分子区间,这说明CP前体物主要来源于小分子有机物;N-DBPs潜能随地域性变化与C-DBPs潜能变化结果相似,重庆的不同分子区间的N-DBPs生成量明显高于武汉和上海,尤其在1~10kDa区间N-DBPs产生量最高.
总体上,三地的C-DBPs和N-DBPs生成量均以<1kDa区间为主,重庆、武汉和上海<1kDa区间的C-DBPs和N-DBPs生成量占总各自总生成量比例分别46.4%和60.7%,41.9%和66.8%, 58.0%和 66.0%,可以看出从长江上游到下游<1kDa的区间C-DBPs和N-DBPs潜能所占比例逐渐增加,这也是和有机物组成的规律相一致的. 2.2.2 氯胺化消毒过程 DBPs生成潜能的分子量分布规律对比 将长江重庆段、武汉段和上海段原水,分别使用不同截留分子量的超滤膜进行过滤试验,分离后水样加入过量一氯胺并控制水样 pH值为中性,进行氯胺化生成潜能测试实验,反应后溶液经淬灭和液液萃取等,得到不同种类 C-DBPs和N-DBPs生成潜能随分子量分布规律,结果见图2.

图2 氯胺化消毒DBPs生成潜能的分子量分布规律Fig.2 DBPs from NOM molecular weight distribution during chloramination
从图2可见,与氯化潜能结果相似,三地原水经氯胺化后各分子区间均可以产生一定含量的C-DBPs和 N-DBPs,在氯胺化潜能中可发现N-DBPs种类中多出了HANs种类.其主要原因是过量自由氯条件下产生的 HANs易与 HOCl进一步发生分解反应生成THMs和HAAs,而氯胺化过程该反应发生程度较低[19].
与氯化潜能基本相似,氯胺化 C-DBPs和N-DBPs生成潜能也是主要分布于<1k Da的小分子区间;重庆、武汉、上海在<1kDa区间 CDBPs生成量分别为 66.5µg/L,72.1µg/L 和64.1µg/L,占总 C-DBPs的比例分别为 82.2%, 83.6%和84.2%.随着DOM分子量的增加,氯胺化过程1~10kDa与>10kDa分子区间C-DBPs的生成量明显呈现大幅减少的趋势.与氯化潜能的浓度相比,氯胺化反应C-DBPs的产生量仅为氯化潜能的1/2~1/3,这主要是因为氯胺的氧化能力明显弱于 HOCl所导致的.将不同分子区间 NDBPs生成潜能分布规律进行分析,三地水源<1kDa区间 N-DBPs生成潜能最大,分别为6.4µg/L、5.8µg/L和4.8µg/L,分别占总量的52.4%, 85.6%和69.3%,而随着分子量的增加三地均呈现N-DBPs逐步减少的趋势,武汉和上海原水在>10kDa的分子区间基本不产生HANs.

图3 重庆段亲疏水性组分氯化和氯胺化C-DBPs和N-DBPs生成潜能分布Fig.3 C-DBP and N-DBP formation potential of DOM fractions with different hydrophobicity from Chongqing during chlorination and chloraminatio
2.3 氯(胺)化消毒过程 DBPs生成潜能的亲疏水性分布规律对比
2.3.1 氯化消毒过程 DBPs的亲疏水性分布规律对比 将长江重庆段、武汉段和上海段原水,分别采用Amberlite XAD-8、XAD-4树脂进行亲疏水性分离,分离后水样分别进行氯化生成潜能培养实验,得到水样不同组分的 C-DBPs和N-DBPs生成潜能随亲疏水性分布规律,3个城市原水试验结果分别如图3~图5所示,图中(a)和(b)为氯化潜能,(c)和(d)为氯胺化潜能.从图 3~图 5清楚地看出,三地原水氯化后强疏水性组分、弱疏水性组分和亲水性组分均可以产生一定量的C-DBPs和N-DBPs,各组分C-DBPs生成量均是THMs和HAAs所占比例最高,而HKs产量较少,各组分N-DBPs均只产生CP.
从C-DBPs生成量所占比例分析,可以发现三地原水均是强疏水性组分的 C-DBPs所占比例最高,亲水性组分次之,弱疏水性组分最低;三地的强疏水性组分的 C-DBPs分别占总量的50%、62%和58%,这主要是因为强疏水性含有更多的腐殖质含量[20],更容易形成THMs和HAAs;重庆的弱疏水性组分的 C-DBPs生成量所占比例为26%,高于武汉和的上海的比例;而上海的亲水性组分的C-DBPs生成量所占比例为27%,略高于重庆和武汉的比例.
从N-DBPs生成量所占比例来分析,三地原水N-DBPs与C-DBPs生成潜能的分布相似,均是强疏水性组分产生比例最高,弱疏水性组分次之,亲水性组分最低;三地强疏水性组分N-DBPs分别为62%,56%和69%,这也同DOM的组成规律一致.
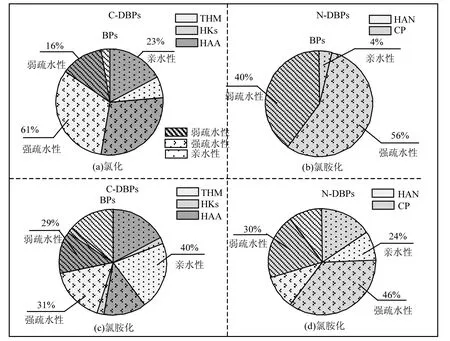
图4 武汉段亲疏水性组分氯化和氯胺化C-DBPs和N-DBPs生成潜能分布Fig.4 C-DBP and N-DBP formation potential of DOM fractions with different hydrophobicity from Wuhan during chlorination and chloramination
2.3.2 氯胺化消毒过程 DBPs生成潜能的亲疏水性分布规律对比 将长江重庆段、武汉段和上海段原水亲疏水性分离后水样进行氯胺化生成潜能培养实验,得到C-DBPs和N-DBPs生成潜能随亲疏水性分布规律,其结果如 3~5图所示.
从3~5图与氯化潜能结果相似,三地原水氯胺化后强疏水性组分、弱疏水性组分和亲水性组分均可以产生一定量的C-DBPs和N-DBPs,且在氯胺化潜能中可检出 HANs.C-DBPs中均以THMs和HAAs所占比例最高,N-DBPs中均以CP所占比例最高.三地原水氯胺化后,C-DBPs和N-DBPs生成量均以强疏水组分或者亲水性组分所占比例最高,三地的C-DBPs生成量强疏水组分和亲水性组分所占比例分别为34%和36%, 31%和40%,39%和36%;三地N-DBPs生成量强疏水组分和亲水性组分所占比例分别为 50%和23%,46%和 24%,54%和 25%.与氯化相比,三地C-DBPs和N-DBPs强疏水性组分所占比例有所下降,而亲水性组分所占比例有所升高.

图5 上海段亲疏水性组分氯化和氯胺化C-DBPs和N-DBPs生成潜能分布Fig.5 C-DBP and N-DBP formation potential of DOM fractions with different hydrophobicity from Shanghai during chlorination and chloramination
3 结论
3.1 重庆、武汉、上海三地的DOM均以小分子前体物为主,主要分布在<1kDa的区间内,且以强疏水性成分和亲水性成分为主,强疏水性成分所占比例最高.从长江上游到下游,DBPs前体物呈现分子量减小而亲水性增加的趋势.因此可以通过吸附、生物氧化等方法去除水中小分子量的有机物,有效降低水中消毒副产物的产生风险.
3.2 重庆、武汉、上海三地的氯化和氯胺化C-DBPs和N-DBPs生成潜能均在<1kDa的区间内最大,从长江上游到下游,C-DBPs和 N-DBPs生成潜能呈现分子量越小生成潜能越大的趋势.
3.3 重庆、武汉、上海三地氯化、氯胺化C-DBPs和N-DBPs生成潜能,均以强疏水性组分或亲水性组分为主,在氯化C-DBPs和N-DBPs中,均是强疏水性组分所占比例最高,在60%左右,在氯胺化C-DBPs和N-DBPs中,亲水性组分所占比例均有增加.
[1] Hrudey S E. Chlorination disinfection by-products, public healthrisk tradeoffs and me [J]. Water Res., 2009,43(8):2057-2092.
[2] Richardson S D, Plew a M J, Wagner E D, et al Occurrence, genotoxicity, and carcinogenicity of regulated and emerging disinfect ion byproducts in drinking water: A review and roadmap for research [J]. Mu tat ion Research, 2007,636(1/3):178-242.
[3] 国家标准化管理委员会,生活饮用水卫生标准 [S].
[4] Rook J J. Formation of haloforms during chlorination of natural waters [J]. Water Treat Exam, 1974,23:234.
[5] Richardson S D,Thruston A D Jr,Caughran T V, et al.Identification of new ozone disinfection by-products in drinking water [J]. Environ. Sci. Technol., 1999,33(19):3368-3377.
[6] Stuart W K, Howard S W, Susan D R, et al . Occurrence of a new generation of disinfection byproducts [J]. Environ. Sci. Technol., 2006,40(23):7175-7185.
[7] EPA method 551.1 Determination of chlorination disinfection byproducts, chlorinated solvents, and halogenated pesticides/ herbicides in drinking water by liquid-liquid extraction and gaschromatography with electron-capture detection [S].
[8] EPA method 551.2 Determination of haloacetic acids and dalapon in drinking water by liquid-liquid extraction, derivatization and gaschromatography with electron capture detection [S].
[9] Alex T C,Suduan G, Randy A D. Physical and chemical fractionation of dissolved organic matter and trihalomethane precursors: A review [J]. Joumal of Water Supply: Research and Technology-AQUA, 2005,54(8):475-507
[10] Thurman E M, Malclom R L. Preparative isolation of aquatic humic substances [J]. Environ. Sci. Technol., 1981,15(4):463-466.
[11] Aiken G R, McKnight D M, Thorn K A, et al. Isolation of hydrophilic organic acids from water using nonionic macroporous resins [J]. Organic Geochemistry, 1992,18(4):567-573.
[12] Huang H, Wu, Q Y, Hu H Y, et al. 2012. Dichloroacetonitrile and dichloroacetamide can form independently during chlorination and chloramination of drinking waters, model organic matters, and wastewater effluents [J]. Environ. Sci. Technol., 46, 10624−10631.
[13] APHA.Standard methods for the examination of water and wastewater,twentieth ed [M]. Washington, DC, USA American Public Health Association, 1998:355-378.
[14] Xu Bin, Gao Nai-Yun, Sun Xiao-Feng, et al. Characteristics of organic material in Huangpu River and treatability with the O3-BAC process [J]. Separation and Purification Technology, 2007,57:348—355.
[15] ImaiA, Fukushim a T, Matsushige K, et a l. Characterization of dissolved organic matter in effluents from wastewater treatment plants [J]. Water Research, 2002.36:859)870.
[16] 徐 倩.水中典型含氮有机物氯化生成消毒副产物的潜能研究[J]. 环境科学, 2011,32 (7) 1967-1974.
[17] Georg Becher, Nina M. Ovrum, Russel F Christman. Novel chlorination by-products of aquatic humic substances [J]. Science of the Total Environment, 1992, 117/118:509-520.
[18] Hua G H; David A R; Kim J S. Effect of bromide and iodide ions on the formation and speciation of disinfection byproducts during chlorination [J]. Environment Science and Technology, 2006,(9): 3050-3056.
[19] Wells W Wu, Paul a. Chadik, and Joseph J. Delfino. The relationship between disinfection by-products formation and structural characteristics of humic substances in chloramination [J]. Environmental Toxicology and Chemistry, 2003,22(12): 2845-2852.
[20] Kitis M, Karanfil T, Wigton A, Kilduff J E. Probing reactivity of dissolved organic matter for disinfection by-product formation using XAD-8 resin adsorption and ultrafiltration fractionation [J]. Water Res., 2002,36:3834-3848.
[21] Ding G Y, Zhang X R. A picture of polar iodinated disinfection byproducts in drinking water by (UPLC/) ESI-tq MS. Environ [J]. Sci. Technol., 2009,43(24):9287-9293.
Distribution of disinfection by-product formation potential by chlor(am)ination in three megalopolis along Yangtze river.
HUANG He1, XU Bin1*, ZHU Wen-qian1, QIN Lang1, MA Yu-ying2
(1.Key Laboratory of Yangtze Aquatic Environment, Ministry of Education, State Key Laboratory of Pollution Control and Resource Reuse, Tongji University, Shanghai 200092, China;2.Minhang Water Treatment Plant of Shanghai Shi Nan Water Supply Company, Shanghai 200245, China). China Environmental Science, 2014,34(10):2497~2504
Dissolved organic matter (DOM) in raw water from upper Yangtze River in Chongqing, middle Yangtze River in Wuhan, lower Yangtze River in Shanghai was isolated into fractions with different hydrophobicity and molecular weight (MW) by resin adsorption and ultra-filtration, respectively, to investigate and regulate emerging disinfection byproducts formation potential during chlorination and chloramination for each fraction. Research showted that DOM from Chongqing, Wuhan and Shanghai was mainly constituted of MW<1kDa organic compounds, hydrophilic and hydrophobic fractions. Trihalometheanes, haloketones, haloacetic acids, haloacetonitriles and chloropicrin were formed after chlorination and chloramination. Among three cities, MW<1kDa fractions gave the highest yield of carbonaceous disinfection byproducts (C-DBPs) and nitrogenous disinfection byproducts (N-DBPs), and the proportion of MW<1kDa formation potential tended to ascend from the upper Yangtze River to lower Yangtze River; Among all three megalopolis, hydrophobic fraction and hydrophilic fraction produced more C-DBPs and N-DBPs, the proportion of hydrophilic fraction C-DBPs and N-DBPs formation potential tended to ascend during chloramination.
t:molecular weight;hydrophilic;hydrophobic;C-DBPs;N-DBPs;formation potential
TU99
:A
:1000-6923(2014)10-2497-08
黄 河(1989-),男,湖北黄岗人,同济大学硕士研究生,研究方向为水中消毒副产物控制.
2013-12-06
国家自然科学基金资助项目(51078280,51278352);水体污染控制与治理专项(2012ZX07404-004,2012ZX07408001)
* 责任作者, 教授, tjwenwu@tongji.edu.cn
