甲强龙预处理对大鼠脊髓损伤后claudin-5表达的影响☆
2014-04-28崔敏周昌龙贺学农夏小辉张光伟
崔敏 周昌龙 贺学农 夏小辉 张光伟
甲强龙预处理对大鼠脊髓损伤后claudin-5表达的影响☆
崔敏*周昌龙*贺学农*夏小辉*张光伟*
目的 探讨甲强龙(11β,17α,21-三羟基-6α-甲基孕甾-1,4-二烯-3,20二酮-21-琥珀酸钠)对大鼠脊髓损伤(spinal cord injury,SCI)后血-脊髓屏障(blood spinal cord barrier,BSCB)通透性及紧密连接蛋白claudin-5表达的影响。方法参照改良Allen’s法建立大鼠脊髓损伤模型。分为假手术组(n=50)、脊髓损伤组(n=50)、甲强龙预处理组(n=50)。建模后不同时间点(12h、1d、3d、5d、7d)各组随机取5只大鼠检测BSCB通透性,取胸段脊髓损伤区组织经RT-PCR、Western blot方法检测claudin-5表达。结果本实验制模成功率84.0%;脊髓损伤组各时间点EB含量较假手术组显著增高(F=27.732,P均<0.05)。甲强龙预处理组各时间点EB含量较脊髓损伤组显著降低(F=48.149,P均<0.05);脊髓损伤组各时间点claudin-5mRNA表达较假手术组显著降低(F= 12.248,P均<0.05)。甲强龙预处理组各时间点claudin-5mRNA表达较脊髓损伤组显著升高(F=15.316,P均<0.05);脊髓损伤组各时间点claudin-5表达较假手术组显著降低(F=18.108,P均<0.05)。甲强龙预处理组各时间点claudin-5表达较脊髓损伤组显著升高(F=20.247,P均<0.05)。结论上调claudin-5表达可能是甲强龙改善大鼠脊髓损伤后血-脊髓屏障通透性的途径之一。
甲强龙 脊髓损伤 紧密连接 claudin-5 血-脊髓屏障
脊髓损伤是多因素参与的复杂过程,血-脊髓屏障对维持脊髓神经细胞内环境相对稳定起重要作用。紧密连接是血-脊髓屏障的组成结构之一,主要参与分子的细胞旁途径转运。Claudin-5是血-脊髓屏障紧密连接的主要结构蛋白[1]。文献[2]显示,claudins蛋白表达变化与血-脑屏障、血-视网膜屏障、肠粘膜紧密连接等的通透性密切相关。临床上在脊髓损伤后应用糖皮质激素,能减轻脊髓水肿,降低脊髓的继发损害,从而改善预后[3],但其具体作用机制不清楚。本研究通过甲强龙对大鼠脊髓损伤模型预处理,检测大鼠脊髓损伤后血-脊髓屏障通透性的改变及claudin-5表达变化,拟揭示甲强龙改善大鼠脊髓损伤的机制。
1 材料与方法
1.1 研究对象成年雄性SD大鼠169只,体质量220~270g,购自本校实验动物中心。甲强龙(11β, 17α,21-三羟基-6α-甲基孕甾-1,4-二烯-3,20二酮-21-琥珀酸钠)购自辉瑞制药有限公司,伊文思蓝(Evans blue,EB)购自上海跃腾生物技术有限公司,Claudin-5抗体、β-actin抗体购自美国Santa Cruz公司,PV超敏试剂盒、浓缩型DAB显色试剂盒购自上海研拓生物科技有限公司,TaKaRa RNA PCR Kit Ver.3.0试剂盒、100 bp laddermarker购自宝生物工程有限公司,claudin-5及β-actin引物由生工生物工程有限公司设计合成。
1.2 实验分组及标本采集按随机数字表将SD大鼠随机分为假手术组(a组)、脊髓损伤组(b组)、甲强龙预处理组(c组),各组50只。分别于造模后12h、1d、3d、5d、7d 5个时间点每组随机取大鼠10只,经断头法处死:5只手术切取损伤段胸髓标本,以DEPC水(1:1000)冲洗3次,置入-80°冰箱内保存,用于RT-PCR及western blot检测;另5只行伊文思蓝含量检测。
1.3 SD大鼠脊髓损伤模型制作大鼠脊髓损伤参照改良Allen’s法[4],经10%水合氯醛3mL/kg腹腔注射后固定,切除T9~T10椎板,显露T9~T10胸髓,allen’s打击器(质量20g,高度25mm)自由落体造成胸髓损伤。假手术组仅行T9-T10椎板切除。甲强龙预处理组在制模前2h予以甲强龙(50mg/kg)经尾静脉注射,此后50mg/(kg.d)间隔6h注射[5],直至处死。脊髓损伤组注射等量生理盐水作对照。术后保持创口清洁,辅助排尿。对制模失败大鼠通过随机抽样原则作及时补充,脊髓损伤组及甲强龙预处理组共纳入SD大鼠119只,其中100只制模成功,成功率84.0%。
1.4 血-脊髓屏障通透性测定大鼠处死前2h自股静脉注入2%EB溶液(20mg/kg),见大鼠眼睛、足趾变蓝,提示染料分布均匀。断头法处死大鼠后以损伤段脊髓为中心取2cm长胸髓,滤纸吸干表面水分后称重,加入10%三氯乙酸沉淀蛋白质,无水乙醇匀浆,反复离心、洗涤3次,置入3mL甲酰胺中,54℃水浴24h后取上清液,用紫外分光光度计测量波长632nm处的吸光度(A)值,绘制EB标准曲线,根据标准曲线计算EB含量(μg/g)。
1.5 RT-PCR测定claudin-5mRNA表达取大鼠胸髓损伤区标本,按照Trizol说明书提取标本微血管段上的总RNA。在10μL逆转录反应体系中,将1.0μg总RNA逆转录为cDNA。Claudin-5上游引物:5’-TTGGAAGGGGCTGTGGAT-3’,下游引物:5’-GGAAAACTGAACTCTGGACGC-3’,反应产物453bp。β-actin上游引物为5’-TCAGGTCATCACTATCGGCAAT-3’,下游引物为5’-AAAGAAAGGGTGTAAACGCA-3’,反应产物493 bp。PCR反应体系为25μL,反应条件:95℃变性30s,58℃退火30s,72℃延伸1min,30个循环。PCR结果采用Ct值比较相对定量法,β-actin为内参照。
1.6 Western-blot法检测claudin-5表达取大鼠胸髓损伤区标本,加入IP裂解液,匀浆离心、测定蛋白浓度并定量。行12%SDS-聚丙烯酰胺凝胶电泳并转膜。5%脱脂奶粉封闭2h,将膜与1∶500稀释的Claudin-5、β-actin抗体4℃孵育过夜,室温下与相应二抗孵育2h,ECL显色。计算各条带光密度值(IDV),以β-actin为内参对照,结果以claudin-5/β-actin的IDV比值表示。
1.7 统计学方法各组实验值以±s表示。采用SPSS 19.0进行统计处理,两组间均数比较采用两独立样本t检验。多组间均数比较采用单因素方差分析,LSD-t比较两两间差异。检测水准α= 0.05。
2 结果
2.1 血-脊髓屏障通透性测定结果伊文思蓝(Evens blue,EB)检测血-脊髓屏障通透性发现脊髓损伤组、甲强龙预处理组出现蓝染,假手术组蓝染不明显。脊髓损伤组各时间点EB含量较假手术组显著增高(F=27.732,P均<0.05)。甲强龙预处理组各时间点EB含量较脊髓损伤组显著降低(F=48.149,P均<0.05)。见表1。
2.2 claudin-5m RNA表达结果脊髓损伤组各时间点claudin-5 mRNA表达较假手术组显著降低(F值为12.248,P均<0.05)。甲强龙预处理组各时间点claudin-5mRNA表达较脊髓损伤组显著升高(F值为15.316,P均<0.05)。见表2。
2.3 claudin-5表达结果脊髓损伤组各时间点claudin-5表达较假手术组显著降低(F值为18.108,P均<0.05)。甲强龙预处理组各时间点claudin-5表达较脊髓损伤组显著升高(F值为20.247,P均<0.05)。如表3、图1。
3 讨论
表1 大鼠胸髓损伤区EB含量测定结果(μg/g,±s)

表1 大鼠胸髓损伤区EB含量测定结果(μg/g,±s)
1)经LSD-t检验,与a组对应时间点比较,P<0.05;2)经LSD-t检验,与b组对应时间点比较,P<0.05
组别a组b组c组n 5 5 512h0.3175±0.0124 0.5536±0.03421)0.4142±0.02752)1d 0.2986±0.0217 0.6876±0.02611)0.4281±0.03172)3d 0.3079±0.0453 0.8326±0.06521)0.5362±0.03622)5d 0.3134±0.0311 0.8072±0.05441)0.6253±0.02612)7d 0.2944±0.0314 0.7417±0.03621)0.5922±0.04462)
表2 大鼠胸髓损伤区claudin-5m RNA表达水平(Ct值±s)

表2 大鼠胸髓损伤区claudin-5m RNA表达水平(Ct值±s)
1)经LSD-t检验,与a组对应时间点比较,P<0.05;2)经LSD-t检验,与b组对应时间点比较,P<0.05
组别a组b组c组n 5 5 512h9.265±0.582 5.099±0.4541)7.312±0.4142)1d 9.360±0.613 4.930±0.2651)6.671±0.3612)3d 8.765±0.522 3.217±0.6121)5.724±0.2262)5d 9.053±0.319 5.152±0.3261)7.116±0.5622)7d 8.864±0.721 4.786±0.3171)7.309±0.4702)
表3 大鼠胸髓损伤区claudin-5表达水平(IDV比值±s)
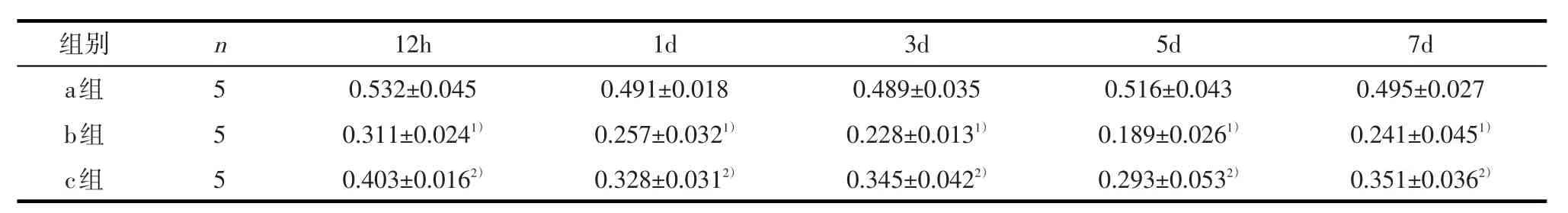
表3 大鼠胸髓损伤区claudin-5表达水平(IDV比值±s)
1)经LSD-t检验,与a组对应时间点比较,P<0.05;2)经LSD-t检验,与b组对应时间点比较,P<0.05
组别a组b组c组n 5 5 512h0.532±0.045 0.311±0.0241)0.403±0.0162)1d 0.491±0.018 0.257±0.0321)0.328±0.0312)3d 0.489±0.035 0.228±0.0131)0.345±0.0422)5d 0.516±0.043 0.189±0.0261)0.293±0.0532)7d 0.495±0.027 0.241±0.0451)0.351±0.0362)
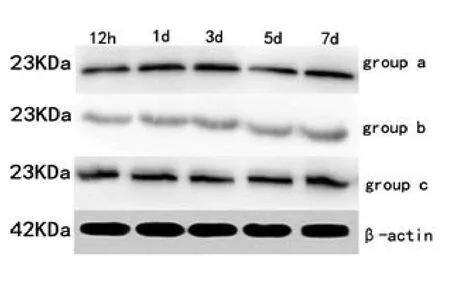
图1 Western-blot法测claudin-5表达
血-脊髓屏障由星形胶质细胞足突、血管基膜、血管内皮细胞以及内皮细胞之间的紧密连接构成。紧密连接主要参与细胞旁路的物质交换,对维持脊髓神经细胞内环境的相对稳定起重要作用。Claudins蛋白是紧密连接的主要结构蛋白[6],目前发现claudins家族约20余成员,分布于多种组织细胞紧密连接中。Claudin-5是血-脑屏障及血-脊髓屏障的主要结构蛋白[1],在创伤性脑损伤、脑缺血、多发性硬化等诸多实验动物模型的血-脑屏障研究中发现,血-脑屏障的通透性增加与claudin-5表达下调相关[7]。在自身免疫性脑脊髓炎模型研究[8]中发现血-脊髓屏障通透性增加与claudin-5表达相关。本研究通过伊文思蓝检测,发现大鼠脊髓损伤组较假手术组血-脊髓屏障通透性显著增高,脊髓损伤组claudin-5表达较假手术组显著降低,结合既往研究[4],提示大鼠脊髓损伤后,血-脊髓屏障通透性增加与claudin-5表达下调相关。
在研究小鼠、猪、人类内皮细胞时发现[2],糖皮质激素可影响微血管内皮细胞紧密连接的通透性。在对羊胎紧密连接蛋白研究[9]中发现,糖皮质激素通过上调claudin-5等紧密连接蛋白的表达,可以降低血-脑屏障的通透性。糖皮质激素影响血-脊髓屏障相关模型的研究较少,而临床上如脊髓创伤、中枢神经系统肿瘤等导致的神经组织水肿可通过糖皮质激素有效改善[3],因此,本实验通过甲强龙干预,发现甲强龙预处理组血-脊髓屏障通透性较损伤组明显降低,提示甲强龙能改善大鼠脊髓损伤后血-脊髓屏障的通透性。进一步检测大鼠脊髓损伤区claudin-5表达,发现甲强龙预处理组claudin-5表达较损伤组明显增加,提示甲强龙可能上调大鼠脊髓claudin-5表达。
糖皮质激素对脊髓紧密连接蛋白claudin-5表达的调控及其机制尚不明确。在对血-脑屏障、血-视网膜屏障及肠道的微血管内皮细胞研究中[2]发现:糖皮质激素穿过血管内皮细胞膜后与糖皮质激素受体相结合形成糖皮质激素受体复合物。糖皮质激素受体复合物转运至细胞核与claudins的启动子相结合,从而激活claudins转录,claudins表达增加。Edward A[10]报道,给予糖皮质激素后,视网膜内皮细胞的糖皮质激素受体复合物与启动子结合后可形成增强子,进一步促进claudins蛋白转录和表达。由上推测:大鼠脊髓损伤后,甲强龙通过与糖皮质激素受体结合,激活claudin-5转录,增强claudin-5表达,从而维持血-脊髓屏障结构相对完整,降低血-脊髓屏障通透性。在大鼠脑缺血模型中[7],抑制炎症相关因子如Caspase-1等可上调claudin-5表达,降低血-脑屏障通透。Ken K[11]研究发现IL-1β、IL-6可下调羊膜内皮细胞的紧密连接蛋白claudin-3和claudin-4,致羊膜屏障功能障碍。大鼠脊髓损伤后局部炎症介质会聚集增多[12],推测甲强龙也可能通过其抗炎抗免疫作用,抑制炎症反应,上调claudin-5表达,维持血-脊髓屏障稳定,但具体机制不清楚。
综上我们推测:甲强龙改善大鼠脊髓损伤后血-脊髓屏障的通透性,通过上调claudin-5表达可能是甲强龙改善这一过程的途径之一。
[1] Viktor B,Daniela J,PharmD,etal.The blood–spinal sord barrier:morphology and clinical implications[J].Ann eurol,2011,70 (2):194-206.
[2] Ellaine S,Sergey S,Carola F.Glucocorticoids and endothelial cell barrier function[J].Cell Tissue Res,2014,355(3):597–605.
[3] 罗家明,秦新月,陈黎燕,等.甲基强的松龙抑制实验性自身免疫性脑脊髓炎IL-23/IL-17轴机制研究[J].中国神经精神疾病杂志,2008,34(6):345-348.
[4] 崔敏,贺学农,周昌龙,等.大鼠脊髓损伤后紧密连接蛋白claudin-5的表达[J].中国神经精神疾病杂志,2014,40(2): 79-82.
[5] Željka M,Miljana M,Djordje M,et al.Methylprednisolone inhibits IFN-γand IL-17 expression and production by cells infiltrating central nervous system in experimental autoimmune encephalomyelitis[J].J Neuroinflammation,2009,11(6):37.
[6] Elkouby L,Ben Y.Functions of claudin tight junction proteins and their complex interactions in various physiological systems [J].Int Rev CellMol Biol,2010,27(9):1-32.
[7] Dong Lipeng,Qiao Huimin,Zhang Xiangjian,et al.Parthenolide Is neurop rotective in rat experimental stroke model: Downregulating NF-κB,Phospho-p38MAPK,and Caspase-1 and ameliorating BBB permeability[J].Mediators Inflamm,2013, 2013:370804.
[8] Tobias V,Simon B,Matthias O,etal.Protein kinase Cβas a therapeutic target stabilizing blood–brain barrier disruption in experimental autoimmune encephalomyelitis[J].Proc Natl Acad Sci USA,2013,110(36):14735-14740.
[9] Grazyna B,Shadi N.Maternal glucocorticoid exposure alters tight junction protein expression in the brain of fetal sheep[J]. Am J Physiol Heart Circ Physiol,2010,298(1):H179-H188.
[10] Edward A,Felinski,Amy E,etal.Glucocorticoids induce transactivation of tight junction genes occludin and claudin-5 in retinal endothelial cells viaa novel cis-element[J].Exp Eye Res,2008,86 (6):867-878.
[11] Ken K,Hideki M,Masato Y.Inflammatorymediators weaken the amniotic membrane barrier through disruption of tight junctions [J].J Physiol,2010,588(24):4859-4869.
[12] Ali Reza K,Hassan A.Anti-Inflammatory effect of the epigallocatechin gallate following spinal cord Trauma in rat[J].Biomed, 2011,15(1-2):31-37.
The effects of methylprednisolone pretreatment on the claudin-5 expression after spinal cord injury in rats.
CUI Min,ZHOU Changlong,HE Xuenong,XIA Xiaohui,ZHANG Guangwei.
Department of neurosurgery,the yongchuan affiliated hospital,Chongqing medical university,439 xuan hua road,yong chuan District,Chongqing 402160.Tel: 023-85382926.
ObjectiveTo study the effects of methylprednisolone on the permeability of blood-spinal cord barrier (BSCB)and claudin-5 expression after spinal cord injury in rats.MethodsThe ratmodel of spinal cord injurywas established usingmodified Allenmethod.SD ratswere randomly divided into sham-operated group,spinal cord injury group and methylprednisolone pretreatment group.The permeability of BSCB and expression of claudin–5 were assessed at 12 h,1,3,5,and 7 d after the onset of spinal cord injury(five animals per each time point).RT-PCR and Western blot were used to detect the expression of claudin-5.ResultsThe success rate of themodelwas 84.0%.EB contentwas significantly higher in spinal cord injury group than in sham-operated group at each time point(F value 27.732,P<0.05). EB contentwas lower in methylprednisolone pretreatment group than in spinal cord injury group(F value 48.149,P<0.05).ThemRNA expression of claudin-5 was lower in spinal cord injury group than sham-operated group at each time point(F value 12.248,P<0.05).ThemRNA expression of claudin–5 was higher in methylprednisolone pretreatment group than in spinal cord injury group ateach time point(F value 15.316,P<0.05).The protein expression of claudin-5was lower in spinal cord injury group than in sham operated group ateach time point(F value 18.108,P<0.05).The protein expression of Claudin-5 was higher inmethylprednisolone pretreatment group than spinal cord injury group at each time point(F value 20.247,P<0.05).ConclusionsMethylprednisolone improves permeability of BSCB after spinal cord injury probably through enhancing claudin-5 expression in rats.
Methylprednisolone Spinal cord injury Tight junction Claudin-5 Blood-spinal cord barrier
R641
A
2014-09-03)
(责任编辑:甘章平)
10.3936/j.issn.1002-0152.2014.12.008
☆重庆市教委自然科学基金资助(编号:KJ1400232)重庆医科大学附属永川医院青年课题(编号:YJQN201419)
*重庆医科大学附属永川医院神经外科(重庆 402160)
