口腔黏膜促透剂研究进展
2014-04-27柳国霞房桂青谷大建
柳国霞,房桂青,郭 洪,谷大建
(1.山东省济南市口腔医院,山东 济南 250001; 2.山东省千佛山医院药学部,山东 济南 250014)
与传统口服给药方式相比,口腔黏膜给药方式具有起效快、酶活性低、给药方便等优点。口腔黏膜黏附制剂是以生物黏附材料作为药物载体,通过生物黏附作用长时间黏附于口腔黏膜而发挥疗效[1]。通过将剂型特定黏附于口腔黏膜的某一部位,可以增加制剂在黏膜上滞留的时间,提高吸收部位表面药物浓度,延长药物作用时间,减少口腔环境对释放药物的影响,并且具有一定的缓释作用。1847年,Sobrero等[2]首次报道了硝酸甘油经口腔黏膜吸收进入人体血液循环系统;1879年,硝酸甘油舌下给药成功地用于临床治疗严重心绞痛患者[3]。近年来,口腔黏膜黏附给药剂型在止痛剂、镇静剂、心血管药物、糖尿病药物等方面开始得到广泛的研究。口腔给药的主要问题是口腔黏膜的屏障作用和有限的吸收面积。口腔黏膜作为口腔内第一道天然屏障,其首要作用就是保护口腔内组织不受外源性物质的侵害,因此也会阻碍药物的透过。为了使药物能够透过口腔黏膜进入毛细血管,增加药物的透皮量以达到药物的治疗浓度,透皮吸收促进剂目前被广泛应用于口腔黏膜黏附制剂中。口腔黏膜吸收促进剂(简称促透剂),是一种能可逆地改变口腔黏膜角质层屏障作用以促进药物的透黏膜吸收,而不对口腔黏膜形成严重刺激和损害的化学物质。目前,关于鼻黏膜、皮肤和肠黏膜等的促透剂已有大量文献报道,关于药物透过口腔黏膜吸收的评价方法和模型却还不完善。笔者综述了近年来口腔黏膜促透剂的应用研究进展,以期能够为合理应用促透剂提高药物生物利用度提供参考。
1 给药机制
1.1 口腔黏膜的生理结构
口腔黏膜厚度约为500~600 μm,被覆于口腔表面,由上皮层、基底膜和黏膜固有层构成,如图1所示。其中基底膜厚1~2 μm,具有选择通透性,能滤过大分子物质,起连接和支持作用;固有层为致密结缔组织,含丰富的毛细血管和神经末梢[4]。不同部位、结构和面积的黏膜对药物的透过性不同。口腔黏膜分为角化上皮和非角化上皮[6-7]:齿龈和硬腭表面由角化上皮组成,颊、舌下及软腭上皮未角化,舌背部的黏膜兼具角化与非角化两种性质。角化上皮构成口腔保护屏障,而颊黏膜和舌下黏膜上皮均未角化,利于药物吸收[8],是口腔黏膜给药的常用部位。舌下黏膜上皮层厚度低于颊黏膜,且通透性较高,对于合适的药物有较好透过性,但因唾液的冲洗作用,该处不适用于缓释剂型的给药;颊黏膜面积大,受唾液影响小,更适合口腔给药。颊黏膜和舌下黏膜的生理特征比较见表1[9]。舌下给药对小分子量药物具有较好的吸收率和生物利用率,但是不适合持续给药;而颊粘膜渗透性较舌下黏膜稍弱,但更适合持续给药。
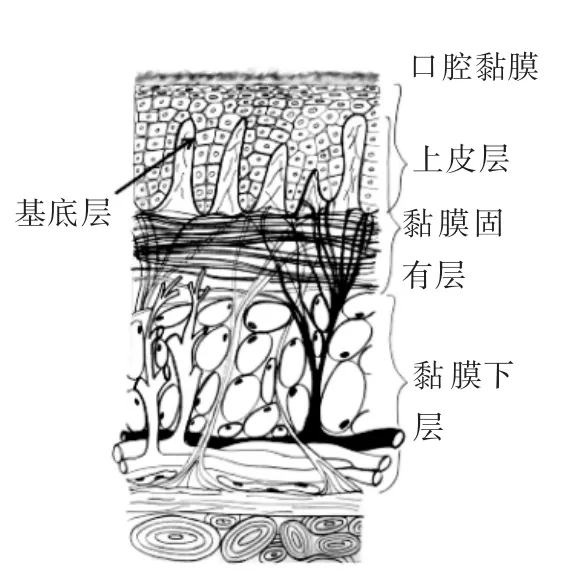
图1 口腔黏膜结构

表1 颊黏膜和舌下黏膜的生理特征比较
1.2 药物透过口腔黏膜的途径
大量研究结果表明,口腔上皮在其表层约1/3处颗粒层细胞中,由膜被颗粒排出的脂质构成屏障层,如图2 A所示。该屏障层阻碍能力弱于角质层,是药物透过非角化口腔黏膜的主要障碍[10]。药物穿过口腔黏膜主要存在两条途径[11],即跨细胞膜途径和细胞旁路途径,如图2B所示。口腔黏膜上皮为典型的复层鳞状上皮,细胞膜亲脂,上皮细胞内部为亲水的细胞质,外部分布着由膜被颗粒排出的偏极性脂质[12]。这些脂质通常为无定形态,偶尔也会出现短棒状的脂质板,脂质外部包围着亲水性的细胞间基质。脂溶性较强的药物易于穿过脂质,通常为跨细胞膜途径,而水溶性药物偏向于细胞旁路途径。

图2 口腔颊黏膜上皮细胞的超微结构及药物转运途径
2 口腔黏膜促透剂
在上皮屏障、上皮内屏障、基底膜屏障等作用下,口腔黏膜阻碍药物进入人体血液循环,其低通透性可通过加入促透剂、采用物理促透或提高药物稳定性等方法来改善,其中加入促透剂是目前解决口腔给药吸收问题的最主要方法。口腔黏膜与皮肤的结构较为相近,因此口腔黏膜促透剂大多选用已经在透皮或其他黏膜给药系统中考察过的促透剂。目前常用种类包括天然促透剂、化学促透剂和复合促透剂等。许多学者进行了化学促透剂作用机制研究,其机制可能是[13]:与角质层细胞间脂质相互作用,破坏其结构高度有序性,以增强跨角质层细胞膜扩散性;与角质细胞的胞内蛋白相互作用以增强跨细胞渗透性;增加药物进入角质层的分配系数;亲水性促透剂与脂质极性基团相互作用,扰乱脂质的高度有序结构,易化亲水性药物扩散,同时影响脂质疏水部分,在这些双分子层区域引起重排,也能促进亲脂性药物的渗透作用;亲脂性促透剂与脂质双分子层中的烃链相互作用。增加烃链流动性,打乱脂质双分子层结构,促进亲脂性药物的渗透性。这些改变同时影响极性基团的排序,使得亲水性药物的渗透性增强。如图3所示。

图3 促透剂作用机制
3 常用促透剂[14]
3.1 表面活性剂类[15]
主要有十二烷基硫酸钠、聚乙二醇-9-十二烷基醚[16]、山梨醇月桂酸酯[17]、月桂酸甘油酯、吐温 20、吐温 80[18]等。Shidhaye Supriya S等[19]研究不同的透皮促进剂(月桂基硫酸钠、苹果酸、水杨酸钠和胆汁盐)对普伐他汀钠透过颊黏膜的影响。结果表明,月桂基硫酸钠能够扰乱细胞间流路,显著增强亲水性药物的细胞旁路运转。表面活性剂具有维持药物释放和促进渗透的作用,通常的作用是增加药物的溶解性及赋予胶黏剂水可洗去性。离子型的表面活性剂的促透作用优于非离子型表面活性剂,但对皮肤刺激性和损伤较大,不易被人接受。其机制可能是扰乱磷脂酰基链;抽提细胞膜蛋白质和脂类;增强多肽类药物溶解性。
3.2 胆盐类[20]
主要有脱氧胆酸钠、甘胆酸钠、牛黄胆酸钠等。甘氨脱氧胆酸钠(GDC)在100 mmol/L浓度下能促进硫酸吗啡透过牛颊黏膜,通过光学和电子显微镜研究,证实其作用机制是GDC溶解上皮细胞间脂质,增强细胞间通路[21]。
3.3 醇类
主要有乙醇、丙二醇等。醇类促透剂[22]能增强药物经磷脂途径的渗透。其一方面可作为药物的溶剂,增加药物的溶解性,常用于复合促透剂[23];另一方面能够萃取部分磷脂。丙二醇对亲脂性药物的促透作用较好。
3.4 脂肪酸
主要有油酸、亚油酸、月桂酸等短链脂肪酸等。褚爱武等[24]对油酸经皮促透作用的微观机理进行研究,研究结果表明透皮促进剂油酸的主要作用机理是破坏角质层类脂形成的膜结构,在角质层细胞间产生腔隙,以此增加药物在表皮的通透性。此类促透剂主要通过干扰磷脂酰基链来实现促透作用。
3.5 萜烯类
主要有薄荷醇、冰片、当归挥发油、樟脑、龙脑、α-蒎烯等。萜烯类促透剂具有促透能力强、毒性低的特点,可改善皮肤通透性,基于类似“相似相溶”原理,对亲水、亲脂药物均有促渗作用[25]。
3.6 环糊精
主要有α-环糊精,β-环糊精和γ-环糊精、甲基化β-环糊精等。通常环糊精通过提高药物稳定性[26]、增加药物溶解度及黏膜透过性,促进药物吸收[27]。
3.7 螯合剂
主要有乙二胺四乙酸(EDTA)、枸橼酸、水杨酸盐等。EDTA与钙离子螯合,能特异性促进药物通过细胞旁路途径吸收[28]。
3.8 壳聚糖
包括壳聚糖盐、三甲基壳聚糖等。He等[29]的研究结果表明,壳聚糖及其衍生物通过改变角质层中的水含量,角蛋白的二级结构,细胞的膜电位和流动性促进药物的透皮吸收。并且由于其分子量大,除角质层以外几乎不能渗透到其他的皮肤组织中,可避免带来一些不必要的不良反应。
3.9 Azone
该类物质的促透机理是增加角质层细胞间磷脂双分子层的流动性,扰乱脂质结构从而形成通道,并且氮酮和丙二醇以适当比例混合能够促进亲脂性药物的渗透[30]。
3 结语
口腔黏膜给药方式是新兴的研究热点,具有起效快、避免首过效应和患者顺应性好等优点,促透剂能够增加药物的口腔黏膜透过率,对于口腔给药的临床推广具有重要意义。根据药物的结构特性不同,促透剂对其的促透机理也复杂多变。目前,化学促透剂应用最为普遍,但当用量较大或长时间使用含有这些成分的制剂时会引起毒副作用;天然促透剂如挥发油及植物油等萜(烯)类化合物,作用于粘膜后可不同程度地改变其理化性质及正常生理结构,但同时具有起效快、效果好、可逆速度快等优点。近年来研究发现,两种甚至多种促透剂联合使用可以取得优于单一促透剂的经皮渗透效果,可减少促透剂的使用量,降低不必要的毒副作用,同时增加主药利用率。因此,今后研究方向应为寻找药物最适促透剂,以及对复合促透剂的研究。
参考文献:
[1]戴亦晖,王小虹,戴晓东.口腔黏膜黏附制剂的研究进展[J].中国药业,2009(6):63 -64.
[2]Mathew ST,Mathapan R,Prasanth VV,et al.Buccal tablet- As mucoadhesive drug delivery:An over view[J].Journal of Pharmacy Research,2011,4(3):117 - 120.
[3]Abrams Jonathan.Nitroglycerin and long-acting nitrates in clinical practice[J].The American journal of medicine,1983,74(6):85 - 94.
[4]Squier Christopher,Brogden Kim.Human oral mucosa:development,structure and function[M].City:Wiley - Blackwell,2011:1 736 - 1 740.
[5]Paderni Carlo,Compilato Domenico,Giannola Libero Italo,et al.Oral local drug delivery and new perspectives in oral drug formulation[J].Oral Surgery,Oral Medicine,Oral Pathology and Oral Radiology,2012,114(3):e25 - e34.
[6]Wertz Philip W,Swartzendruber Donald C.,Squier Christopher A.Regional variation in the structure and permeability of oral mucosa and skin[J].Advanced Drug Delivery Reviews,1993,12(1 - 2):1 - 12.
[7]Rautava Jaana,Luukkaa Marjaana,Heikinheimo Kristiina,et al.Squamous cell carcinomas arising from different types of oral epithelia differ in their tumor and patient characteristics and survival[J].Oral Oncology,2007,43(9):911 - 919.
[8]Galey William R,Lonsdale Hk,Nacht Sergio.The in vitro permeability of skin and buccal mucosa to selected drugs and tritiated water[J].Journal of Investigative Dermatology,1976,67(6):713 - 717.
[9]李 丁,王 健,侯惠民.口腔黏膜给药系统研究进展[J].中国医药工业杂志,2009(4):303 -307.
[10]Dawson DV,Drake DR,Hill JR,et al.Organization,barrier function and antimicrobial lipids of the oral mucosa[J].International Journal of Cosmetic Science,2013,35(3):220 - 223.
[11]李玉清,黄绳武.药物口腔黏膜吸收机理的研究进展[J].中国新药杂志,2012,21(5):512 - 517.
[12]萧 燕,李秉琦.口腔粘膜的防御屏障[J].国外医学:口腔医学分册,1990(2):85 - 87,80.
[13]Hu Longsheng,Silva Sérgio MC,Damaj Bassam B.,et al.Transdermal and transbuccal drug delivery systems:Enhancement using iontophoretic and chemical approaches[J] .International Journal of Pharmaceutics,2011,421(1):53 - 62.
[14]张士洋.透皮给药系统(TDDS)中促透剂技术的发展[J].淮海医药,2009(3):281 - 283.
[15]Rai Vishwas,Tan Hock S,Michniak - Kohn Bozena.Effect of surfactants and pH on naltrexone (NTX)permeation across buccal mucosa[J].International Journal of Pharmaceutics,2011,411(1 - 2):92 - 97.
[16]Alexander A,Ajazuddin M,Swarna M,et al.Polymers and permeation enhancers:Specialized components of mucoadhesives[J].Stamford Journal of Pharmaceutical Sciences,2011,4(1):91 - 95.
[17]Sharma S,Kulkarni J,Pawar AP.Permeation enhancers in the transmucosal delivery of macromolecules[J].Die Pharmazie-An International Journal of Pharmaceutical Sciences,2006,61(6):495 - 504.
[18]花永刚,王 静.薄荷脑等透皮促进剂对泰必利体外释放的影响[J].安徽医药,2002,6(4):15.
[19]Shidhaye Supriyas,Thakkar Priteshv,Dand Neham,et al.Buccal Drug Delivery of Pravastatin Sodium[J].AAPS PharmSciTech,2010,11(1):416-424.
[20]Hoogstraate AJ,Senel S,Cullander C,et al.Effects of bile salts on transport rates and routes of FITC-labelled compounds across porcine buccal epithelium in vitro[J].Journal of Controlled Release,1996,40(3):211 -221.
[21]Senel S,Apan Y,Sargon MF,et al.Enhancement of transbuccal permeation of morphine sulfate by sodium glycodeoxycholate in vitro[J].Journal of Controlled Release,1997,45(2):153 - 162.
[22]Heard Charles M,Kung Denise,Thomas Chris P.Skin penetration enhancement of mefenamic acid by ethanol and 1,8-cineole can be explained by the ‘pull’effect[J].International Journal of Pharmaceutics,2006,321(1 - 2):167 - 170.
[23]程 薇,赵淑英,牛 欣.低频电磁复合脉冲对新乌头碱透皮吸收速率的影响[J].北京中医药大学学报,2010(8):533-536.
[24]褚爱武,崔跃红.油酸经皮促透作用微观机理的研究[J].电子显微学报,2002,21(2):184 -187.
[25]华 南,刘 卫,郭瑞臣.萜烯类经皮渗透促进剂的研究与应用进展[J].中国中药杂志,2009,33(24):2 875 -2 882.
[26]尹 婕,邓盛齐.环糊精及其衍生物在新型给药系统中的应用进展[J].国外医药:抗生素分册,2006,27(5):228 -232.
[27]Zhang Xuejiao,Zhang Xinge,Wu Zhongming,et al.β - Cyclodextrin grafting hyperbranched polyglycerols as carriers for nasal insulin delivery[J].Carbohydrate Polymers,2011,84(4):1 419 - 1 425.
[28]Rosenthal R,Heydt MS,Amasheh M,et al.Analysis of absorption enhancers in epithelial cell models[J].Ann N Y Acad Sci,2012,1 258:86-92.
[29]He Wen,Guo Xianxi,Xiao Lihai,et al.Study on the mechanisms of chitosan and its derivatives used as transdermal penetration enhancers[J].International Journal of Pharmaceutics,2009,382(1 - 2):234 - 243.
[30]Xu Xiangqun,Zhu Qiuhong.Evaluation of skin optical clearing enhancement with Azone as a penetration enhancer[J].Optics Communications,2007,279(1):223 - 228.
