鸭疫里默氏杆菌GroEL蛋白的原核表达和单克隆抗体制备
2014-04-14侯湾湾韩先干王少辉王小兰岳嘉蘋曹守林范红结于圣青
侯湾湾,韩先干,王少辉,王小兰,岳嘉蘋,曹守林,范红结,于圣青
(1.南京农业大学动物医学院 农业部动物疫病诊断与免疫重点开放实验室,南京 210095;2.中国农业科学院上海兽医研究所,上海 200241)
鸭疫里默氏杆菌GroEL蛋白的原核表达和单克隆抗体制备
侯湾湾1,2,韩先干2,王少辉2,王小兰2,岳嘉蘋2,曹守林2,范红结1,于圣青2
(1.南京农业大学动物医学院 农业部动物疫病诊断与免疫重点开放实验室,南京 210095;2.中国农业科学院上海兽医研究所,上海 200241)
本试验旨在研制鸭疫里默氏杆菌GroEL蛋白的单克隆抗体。将鸭疫里默氏杆菌WJ4菌株的groEL基因进行原核表达,重组蛋白经过纯化后作为免疫原免疫BALB/c小鼠。经过3次免疫后,取免疫小鼠脾细胞与SP2/0骨髓瘤细胞进行细胞融合,用间接ELISA筛选阳性细胞株并进行3次亚克隆后制备小鼠腹水单克隆抗体。共获得2株稳定分泌鸭疫里默氏杆菌GroEL单克隆抗体的杂交瘤细胞株,分别命名为1G2B6和1G2F10。2株单克隆抗体均为IgG1亚类。腹水单克隆抗体ELISA效价达到1:102 400。Western blot检测结果表明2株单克隆抗体均能与鸭疫里默氏杆菌血清1、2和10型菌株发生特异性结合,而与禽致病性大肠杆菌、沙门氏菌和禽巴氏杆菌菌株无反应性。本研究成功制备了稳定性好、特异性强的鸭疫里默氏杆菌GroEL单克隆抗体,为进一步研制基于抗体检测鸭疫里默氏杆菌抗原的试剂盒奠定了基础。
鸭疫里默氏杆菌;GroEL蛋白;单克隆抗体
Key words:Riemerella anatipestifer; GroEL; monoclonal antibody
鸭疫里默氏杆菌(Riemerella anatipestifer,RA)是鸭传染性浆膜炎的病原体,鸭、火鸡等禽类感染该病多呈急性或慢性败血症,特征病变为纤维素性心包炎、肝周炎、气囊炎、脑膜炎、干酪样输卵管炎等,是目前危害禽类养殖业的主要传染病之一。
检测鸭疫里默氏杆菌的血清学反应有间接血凝试验、平板凝集、试管凝集和琼脂扩散试验等。用裂解的全菌蛋白[1]和外膜蛋白[2]作为包被抗原建立的ELISA方法能检测出鸭疫里默氏杆菌抗体。检测鸭疫里默氏杆菌的分子生物学方法主要有基于该菌16S rRNA[3]和OmpA[4]的PCR方法,基于荚膜多糖基因序列的Real-time PCR[5]以及基于groEL的 LAMP[6]方法等。目前用单克隆抗体检测鸭疫里默氏杆菌的方法鲜有报道。
本实验室前期研究表明,GroEL是血清1、2和10 型鸭疫里默氏杆菌的一种共同免疫原性蛋白[7]。本研究通过构建鸭疫里默氏杆菌的GroEL蛋白的原核表达载体表达获得GroEL重组蛋白,免疫BALB/c小鼠后,制备单克隆抗体。ELISA和Western blot检测结果表明获得的2株单克隆抗体效价高,对血清1、2和10型鸭疫里默氏杆菌菌株具有交叉反应性,与禽致病性大肠杆菌、沙门氏菌和禽巴氏杆菌菌株无反应性。该研究为鸭疫里默氏杆菌检测试剂盒的研制奠定了基础。
1 材料与方法
1.1 材料所用菌株及来源如表1所示。SP2/0骨髓瘤细胞、pET-28a(+)质粒由中国农业科学院上海兽医研究所公共卫生研究室(以下简称本实验室)保存;BALB/c小鼠购自中国科学院斯莱克实验动物中心;HT、HAT、聚乙二醇和弗氏佐剂购自Sigma公司;RPMI1640和胎牛血清购自BIOWEST公司;T4 DNA连接酶、限制性核酸内切酶为TaKaRa公司产品;大肠杆菌DH5α和BL21(DE3)、普通质粒小提试剂盒、异丙基硫代-β-D半乳糖苷(IPTG)、可溶型单组分TMB底物溶液、DAB增强型底物显色试剂盒、羊抗鼠的IgG-HRP为天根生化科技有限公司产品;His-Binding-Resin亲和层析Ni柱购自上海悦克生物科技公司;胶回收试剂盒、产物纯化试剂盒、蛋白质分子质量标准购自Fermentas公司;BCA试剂盒购自上海碧云天生物技术研究所;小鼠单克隆抗体分型试剂盒SBA ClonotypingTMSystem/HRP购自Southern Biotech公司;单抗纯化试剂盒HiTrap Protein G HP为GE Healthcare Life Sciences公司产品。
1.2 方法
1.2.1 鸭疫里默氏杆菌GroEL原核表达及纯化
1.2.1.1 鸭疫里默氏杆菌GroEL原核表达载体的构建 根据GenBank中鸭疫里默氏杆菌groEL基因序列(1629 bp,GenBank登录号:GU060633.1),设计一对引物,引物两端添加BamH I和SalI酶切位点和保护性碱基,其中引物上游序列为5'-CAGGATCCA TGGCAAAAGATATTAAATTTGATATA-3',下游序列为5'-CTGTCGACTTACATCATACCTGGCATT CC-3'。
提取鸭疫里默氏杆菌WJ4的基因组,作为PCR模板扩增groEL基因,反应参数:95℃预变性5 min;95℃ 1 min,58℃ 2 min,72℃ 1 min,30个循环;72℃延伸10 min。PCR产物经琼脂糖凝胶电泳后回收目的片段,并以BamH I和SalI酶切,回收目的片段与经同样酶切处理的pET-28a(+)载体连接,并将pET28a-groEL转化感受态DH5α宿主菌。利用卡那抗性和限制性内切酶进行重组菌的筛选和鉴定。重组质粒送至上海华津生物公司进行序列测定,并以DNAStar软件进行同源性分析。
1.2.1.2 鸭疫里默氏杆菌GroEL的表达和纯化 将重组表达载体pET28a-groEL转入表达宿主菌BL21(DE3),37℃振荡培养至OD600≈0.5,随后加入1 mmol/L IPTG进行诱导表达,37℃振摇表达6 h,同时设置阴性对照。收集菌体后超声处理,离心分离上清和包涵体,进行SDS-PAGE检测重组蛋白GroEL的表达情况。可溶性表达的His-GroEL用His-Binding-Resin亲和柱进行纯化,纯化后用BCA法测定蛋白浓度。

表1 本文中所用的菌株Table 1 Strains used in this study.
1.2.2 鸭疫里默氏杆菌GroEL蛋白单克隆抗体细胞株的制备
1.2.2.1 动物免疫 取6~8周龄的BALB/c雌性小鼠,将GroEL重组蛋白与等体积的弗氏完全佐剂进行乳化后,按100 μg/只的剂量在小鼠背部和腹部皮下多点注射,进行首免;每隔2周用弗氏不完全佐剂加等体积的GroEL重组蛋白乳化后加强免疫,剂量、方法、途径同首免;经3次加强免疫后,从小鼠尾静脉取血,用间接ELISA法检测血清的抗体效价。选择血清效价最高的小鼠,腹腔注射重组蛋白100 μg/只,不添加佐剂,3 d后取脾细胞进行细胞融合。
1.2.2.2 单克隆抗体细胞株的制备及筛选 超免疫后3 d进行融合。取免疫小鼠脾细胞与骨髓瘤细胞SP2/0混合,离心后弃上清,45 s内加入1 mL聚乙二醇,然后逐滴加入10 mL 1640培养基进行中止,37℃水浴15 min。用含有饲养细胞的HAT培养基将细胞重悬,混匀后以100 μL/孔加入到96孔细胞培养板中。8~10 d后细胞集落长至培养孔1/4时,完全吸取细胞培养上清,用纯化GroEL重组蛋白包被的ELISA板(5 μg/mL, 100μL/孔)进行间接ELISA检测,筛选出阳性克隆,同时加入HT培养基继续培养,用有限稀释法进行亚克隆筛选,直至100%阳性。
1.2.3 鸭疫里默氏杆菌GroEL单克隆抗体的生物学特性研究
1.2.3.1 杂交瘤细胞株的稳定性测定 将杂交瘤细胞株在相同的操作下连续传30代,进行间接ELISA试验,测定其每代细胞培养上清效价;将杂交瘤细胞株冻存于液氮中,分别在3个月、6个月和12个月后取出冻存的杂交瘤细胞株复苏,扩大培养后制备腹水,进行间接ELISA检测单抗的腹水效价。
1.2.3.2 Ig类及亚类测定 采用小鼠单克隆抗体分型试剂盒SBA ClonotypingTMSystem/HRP测定获得的GroEL单克隆抗体Ig亚类,操作过程严格依照试剂盒说明书。
1.2.3.3 单克隆抗体腹水的制备及效价测定 取10周龄BALB/c雌性小鼠,腹腔注射液体石蜡0.3 mL/只,10 d后腹腔接种用无抗生素无血清的RPMI 1640培养基稀释的杂交瘤细胞,每只5×105/0.2 mL。间隔5 d后,观察小鼠状态,如腹部明显膨大,即可收集腹水。采用间接ELISA法测定腹水单抗效价。
1.2.3.4 单克隆抗体的特异性鉴定 采用免疫印迹法(Western blot)鉴定抗体特异性。以鸭疫里默氏杆菌血清1型菌株CH3、血清2型菌株NJ3、血清10型菌株HXb2全菌蛋白进行SDS-PAGE电泳,200 V,电泳60 min左右,利用Trans-Blot转印槽进行湿转印,转印条件为100 V、90 min,将蛋白转移至NC膜上。转印结束后将NC膜用含有5%的脱脂乳PBS封闭2 h,PBST洗涤3次,每次5 min。将腹水单抗做1∶2000稀释,孵育过夜,PBST洗涤5次,每次5 min。然后再与1∶5000稀释的HRP标记的山羊抗小鼠IgG室温孵育2 h,PBST洗涤5次,每次5 min。加DAB底物显色液进行显色。同时对禽致病性大肠杆菌O1(DE47)、O2(DE14)、O18(CE66)和O78(DE48)菌株,沙门氏菌(CVCC1805、CAU0118)和禽巴氏杆菌(CVCC 493)的全菌蛋白进行检测。
1.2.3.5 单克隆抗体的纯化 使用HiTrap Protein G HP亲和层析方法对单克隆抗体腹水进行纯化,操作过程严格依照试剂盒说明书。
2 结果
2.1 鸭疫里默氏杆菌GroEL原核表达及纯化利用引物从鸭疫里默氏杆菌WJ4菌株中扩增出1条1629左右的片段,将片段与空载体pET-28a(+)连接转化后,PCR鉴定获得了5株阳性克隆。重组质粒序列测定结果表明所获得的阳性克隆与目的序列同源性达到100%。将重组质粒pET28a-GroEL转化表达宿主菌BL21(DE3),经IPTG诱导后进行SDS-PAGE分析。结果表明,重组His-GroEL蛋白在pET-28a(+)载体中成功表达,在60 kDa左右出现目的条带。菌体经超声处理后的结果表明,重组蛋白主要存在上清中。融合蛋白带有His标签,利用亲和层析柱进行纯化后,重组蛋白经SDS-PAGE电泳显示,纯化蛋白显示清晰的目的蛋白条带,表明纯化效果较好(图1)。BCA法测定纯化重组蛋白的浓度为1.4 mg/mL。
2.2 鸭疫里默氏杆菌GroEL蛋白单克隆抗体细胞株的制备经3次免疫后,从小鼠尾静脉取血,用间接ELISA法检测血清的抗体效价,结果表明小鼠血清效价达到1∶12 800。对该小鼠进行加强免疫,3 d后取其脾细胞进行细胞融合。经过3次亚克隆筛选,最终获得2株稳定分泌鸭疫里默氏杆菌GroEL单克隆抗体的杂交瘤细胞株,分别命名为1G2B6、1G2F10。
2.3 鸭疫里默氏杆菌GroEL单克隆抗体的生物学特性研究
2.3.1 杂交瘤细胞株的稳定性测定 杂交瘤细胞株1G2B6、1G2F10经过连续传代和反复冻融后,测定其单克隆抗体效价,ELISA结果表明其效价基本一致,表明2株杂交瘤细胞株稳定性良好。
2.3.2 Ig类及亚类测定 采用小鼠单克隆抗体分型试剂盒测定获得的GroEL单克隆抗体Ig亚类,结果表明细胞株1G2B6、1G2F10均为IgG1。
2.3.3 单克隆抗体腹水的效价测定 按照常规方法收集单克隆抗体腹水,间接ELISA法测定腹水单抗效价,结果表明杂交瘤细胞株1G2B6、1G2F10的腹水效价达到1∶102 400(图2)。

图1 鸭疫里默氏杆菌GroEL蛋白的原核表达及纯化Fig.1 Expression and purif cation of Riemerella anatipestifer GroEL
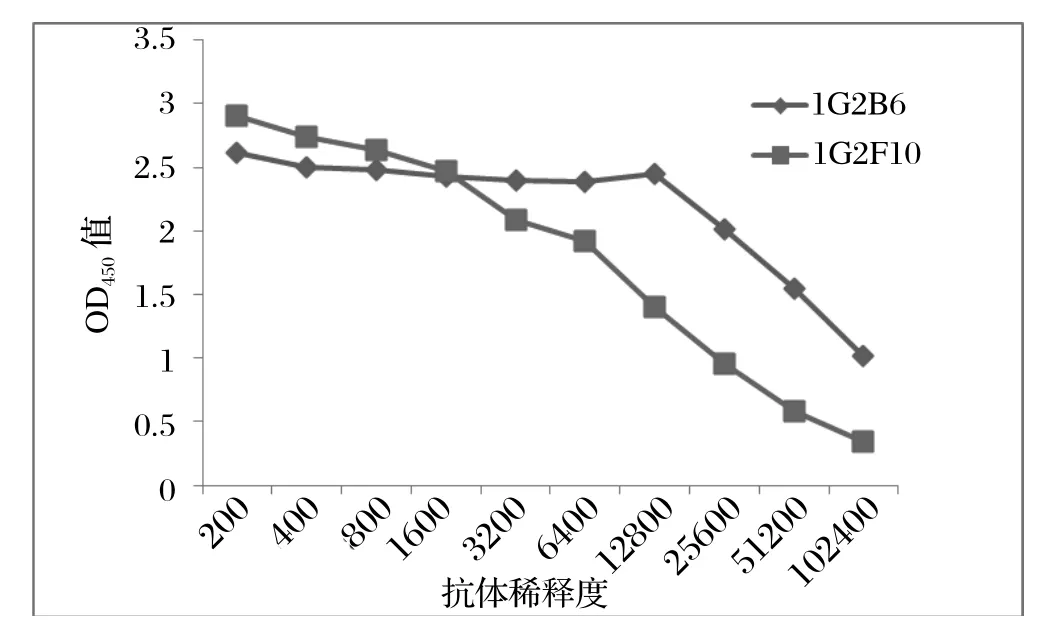
图2 GroEL单克隆抗体腹水的ELISA效价Fig.2 The ELISA titer of the monoclonal antibody in the ascite
2.3.4 单克隆抗体的特异性鉴定 采用Western blot方法鉴定单抗的特异性。结果表明,单克隆抗体1G2B6、1G2F10均与鸭疫里默氏杆菌血清1型菌株CH3、2型菌株NJ3、10型菌株HXb2发生特异性结合,在60 kDa左右出现目的条带;两株单抗与禽致病性大肠杆菌O1菌株DE47、O2菌株DE14、O18菌株CE66和O78菌株DE48,沙门氏菌菌株CVCC1805、CAU0118和禽巴氏杆菌菌株CVCC493均无反应性(图3、4)。说明单克隆抗体1G2B6,1G2F10特异性良好。
2.3.5 单克隆抗体的纯化 使用亲和层析方法对单克隆抗体腹水进行纯化,SDS-PAGE结果表明纯化效果良好,得到了纯度高的单克隆抗体(图5)。
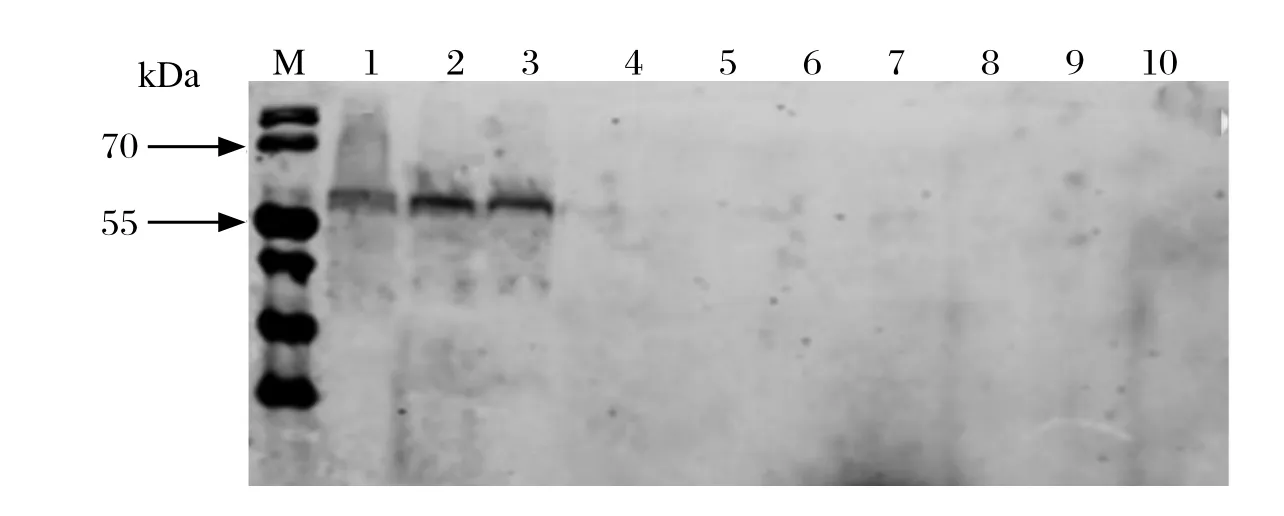
图3 Western blot鉴定GroEL单克隆抗体1G2B6特异性Fig. 3 Western blot analysis of the specif city of MAb 1G2B6
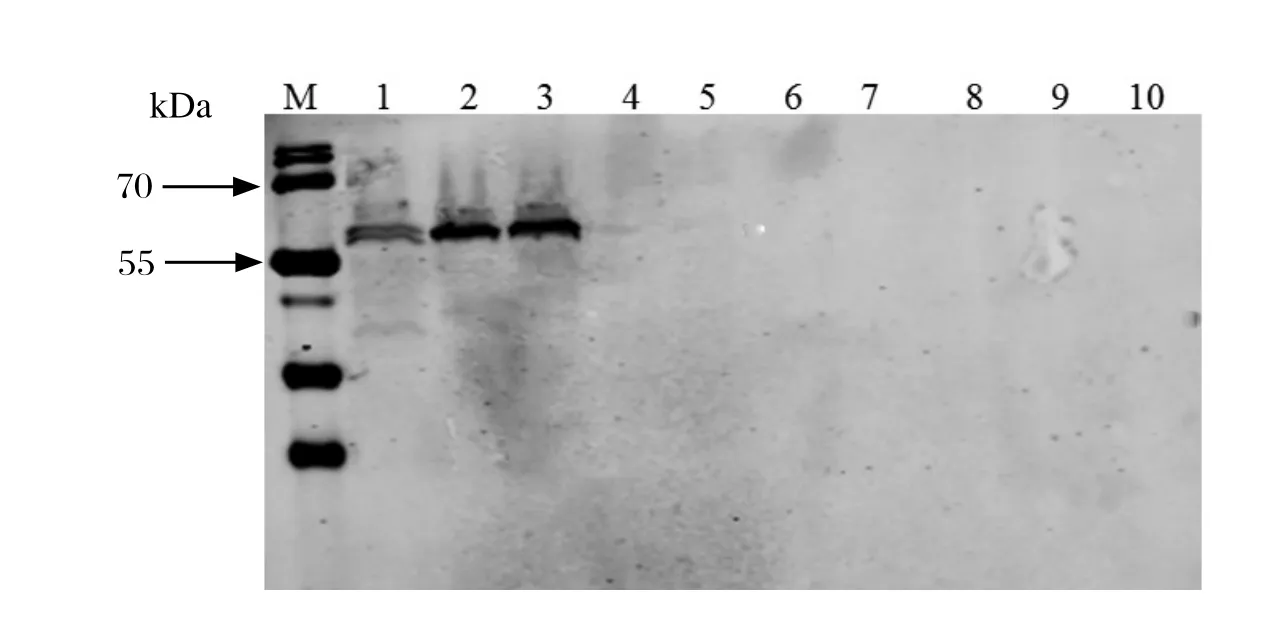
图4 Western blot鉴定GroEL单克隆抗体1G2F10特异性Fig. 4 Western blot analysis of the specif city of MAb 1G2F10
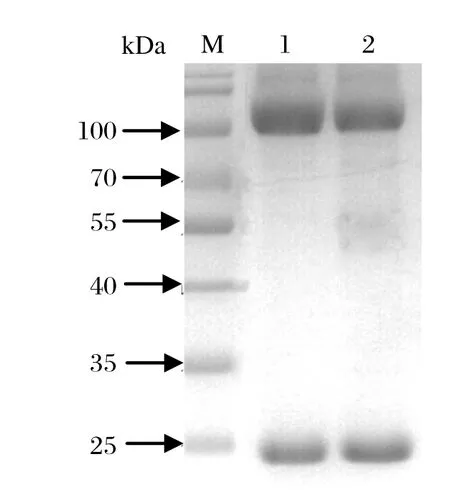
图5 GroEL单克隆抗体的纯化Fig. 5 Purif cation of the anti-GroEL monoclonal antibody
3 讨论
制备单克隆抗体的关键因素是获得纯度和活性高的免疫原。本研究选择pET-28a(+)表达载体进行重组蛋白表达,因其His标签小,并且在上清中获得大量表达,从而保证了重组蛋白的纯度与活性,为制备特异性强的单克隆抗体提供了良好的免疫原。本研究获得了2株效价高、特异性强的GroEL单克隆抗体,2株单抗对血清1、2和10型的菌株均具有交叉反应性,表明该蛋白是一种与不同血清型鸭疫里默氏杆菌具有交叉反应性的免疫原性蛋白,与我们先前报道的结果一致[9]。
GroEL是分子伴侣家族HSP60成员之一,在新生蛋白质的正确折叠和组装以及变性蛋白质的恢复过程中起重要作用。近年来的研究发现,HSP能引起体液和细胞免疫应答,因此这些分子具有发展成新生代预防和治疗型疫苗的潜力[10-12]。近期的研究进展表明,GroEL是很重要的免疫保护性蛋白,利用荚膜组织胞浆菌重组的Hsp60免疫小鼠,可诱导小鼠产生对肺部组织胞浆菌病的免疫保护力[13]。幽门螺旋杆菌重组GroES-GroEL免疫小鼠后,可保护小鼠免于胃十二指肠疾病的感染[14]。Chitradevi等[15]首次证明了伤寒伤门氏菌重组的GroEL对各种细菌病原体的交叉保护效力。本实验室的前期研究亦已证明鸭疫里默氏杆菌重组GroEL可诱导雏鸭产生对该菌不同血清型的交叉免疫保护力,保护率可达37.5%~50%[9]。
鸭疫里默氏杆菌血清型复杂,迄今为止,已公认的有21个血清型(l~21型)[16],各血清型之间缺乏有效的交叉保护,这使得对该病的免疫预防困难极大。本研究获得的2株单克隆抗体,抗体效价高、特异性强,并且对血清1、2和10型菌株具有交叉反应性,因此可用于研制鸭疫里默氏杆菌的检测试剂盒。该单抗的成功研制亦为GroEL蛋白生物学活性的研究奠定了基础。
[1] 张鹤晓, 郭玉璞. 间接ELISA检测鸭疫里氏杆菌抗体的研究[J]. 中国畜禽传染病, 1998, (3)∶ 56-59.
[2] Huang B, Subramaniam S, Frey J,et al. Vaccination of ducks with recombinant outer membrane protein (OmpA) and a 41 kDa partial protein (P45N') ofRiemerella anatipestifer[J]. Vet Microbiol, 2002, 84(3)∶ 219-230.
[3] Qu F F, Cai C, Zheng X J,et al. Rapid identification ofRiemerella anatipestiferon the basis of specific PCR amplifying 16S rDNA[J]. Wei Sheng Wu Xue Bao, 2006, 46(1)∶ 13-17.
[4] 胡清海, 刘晓文. 应用PCR技术检测鸭疫里默氏杆菌的研究[J]. 中国预防兽医学报, 2002, 24(6)∶ 471-473.
[5] 段泽, 程安春, 汪铭书, 等. 实时荧光定量PCR检测鸭疫里默氏杆菌方法的建立和应用[J]. 中国兽医杂志, 2008, 44(2)∶ 11-15.
[6] Han X, Ding C, He L,et al. Development of loopmediated isothermal amplification (LAMP) targeting the GroEL gene for rapid detection ofRiemerella anatipestifer[J]. Avian Dis, 2011, 55(3)∶ 379-383.
[7] Hu Q, Ding C, Tu J,et al. Immunoproteomics analysis of whole cell bacterial proteins ofRiemerella anatipestifer[J]. Vet Microbiol, 2012, 157(3-4)∶ 428-438.
[8] 陈文静, 韩先干, 何亮, 等. 鸭致病性大肠杆菌的分离鉴定及其生物学特性分析[J]. 中国动物传染病学报, 2010, 18(2)∶ 34-40.
[9] Han X, Hu Q, Ding S,et al. Identification and immunological characteristics of chaperonin GroEL inRiemerella anatipestifer[J]. Appl Microbiol Biotechnol, 2012, 93(3)∶ 1197-1205.
[10] Dakshinamoorthy G, Samykutty A K, Munirathinam G,et al. Biochemical characterization and evaluation ofa Brugia malayi small heat shock protein as a vaccine against lymphatic filariasis[J]. PLoS One, 2012, 7(4)∶e34077.
[11] Murshid A, Gong J, Stevenson M A,et al. Heat shock proteins and cancer vaccines∶ developments in the past decade and chaperoning in the decade to come[J]. Expert Rev Vaccines, 2011, 10(11)∶ 1553-1568.
[12] Hosseinzadeh S, Daemi A, Bolhassani A. Heat shock proteins as the efficient vehicle in cancer[J]. J Solid Tumors, 2012, 2(3)∶ 47-55.
[13] Gomez F J, Allendoerfer R, Deepe G S Jr. Vaccination with recombinant heat shock protein 60 from Histoplasma capsulatum protects mice against pulmonary histoplasmosis[J]. Infect Immun, 1995. 63(7)∶ 2587-2595.
[14] Ferrero R L, Thiberge J M, Kansau I,et al. The GroES homolog of Helicobacter pylori confers protective immunity against mucosal infection in mice[J]. Proc Natl Acad Sci U S A, 1995, 92(14)∶ 6499-6503.
[15] Chitradevi S T, Kaur G., Singh K,et al. Recombinant heat shock protein 60 (Hsp60/GroEL) of Salmonella enterica serovar Typhi elicits cross-protection against multiple bacterial pathogens in mice[J]. Vaccine, 2013, 31(16)∶2035-2041.
[16] Pathanasophon P, Phuektes P, Tanticharoenyos T,et al. A potential new serotype ofRiemerella anatipestiferisolated from ducks in Thailand[J]. Avian Pathol, 2002, 31(3)∶267-270.
GENERATION OF MONOCLONAL ANTIBODIES TO GROEL OF RIEMERELLA ANATIPESTIFER
HOU Wan-wan1,2, HAN Xian-gan2, WANG Shao-hui2, WANG Xiao-lan2, YUE Jia-pin2, CAO Shou-lin2, FAN Hong-jie1, YU Sheng-qing2
(1.Key Laboratory Animal Disease Diagnostic and Immunology, Colledge of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China; 2.Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
The objective of this study was to generate monoclonal antibodies (MAbs) against GroEL protein ofRiemerella anatipestifer. The GroEL gene was cloned fromR. anatipestiferstrain WJ4 and the recombinant GroEL was expressed inE. coli. After purif cation, the recombinant GroEL was used to immunize BALB/c mice 3 times. Spleen cells of immunized mice were fused with murine myeloma SP2/O cells. Specif c MAb secreting hybridomas were screened using indirect ELISA and positive hybridomas were cloned 3 times. As a result, two hybridoma cell lines (1G2B6, 1G2F10) stably producing anti-GroEL MAbs were identif ed and established. The isotype of both MAbs was IgG1. The ELISA titer of ascetic f uids was determined to be 1:102 400. In Western blot, both MAbs reacted withR. anatipestiferserotypes 1, 2 and 10 strains but not withEscherichia coli,Salmonella entericaandPasteurella multocidastrains. Besides, both MAbs were specif c forR. anatipestiferserotypes 1, 2 and 10 strains tested. The availability of MAbs specif c for GroEL paved a path for further development of diagnostic kit forR. anatipestifer.
S852.612
A
1674-6422(2014)02-0058-07
2014-03-07
公益性行业(农业)科研专项经费项目(201003012);国家自然科学基金(31272591)
侯湾湾,女,硕士研究生,预防兽医学专业
于圣青,E-mail∶ yus@shvri.ac.cn
