鸭坦布苏病毒E蛋白结构域III原核表达产物诱导中和抗体的研究
2014-04-13闫大为高旭元肖亚莉刘绍琼李雪松闫丽萍滕巧泱李国新李泽君
余 磊,闫大为,高旭元,肖亚莉,刘绍琼,李雪松,闫丽萍,滕巧泱,李国新,李泽君
(中国农业科学院上海兽医研究所,上海 200241)
·研究论文·
鸭坦布苏病毒E蛋白结构域III原核表达产物诱导中和抗体的研究
余 磊,闫大为,高旭元,肖亚莉,刘绍琼,李雪松,闫丽萍,滕巧泱,李国新,李泽君
(中国农业科学院上海兽医研究所,上海 200241)
黄病毒E蛋白结构域Ⅲ能够介导病毒与宿主受体结合以及诱导产生中和抗体,本研究利用原核表达系统表达了鸭坦布苏病毒E蛋白结构域Ⅲ,并研究了其免疫原性。按照大肠杆菌偏好性密码子对鸭坦布苏病毒E蛋白结构域Ⅲ核苷酸序列进行优化并合成后,克隆至pCold-TF载体构建重组质粒pCold-TF-optiEDIII。Western blot证实重组蛋白能与鸭坦布苏病毒特异性血清发生反应。用纯化的重组蛋白免疫BLAB/c小鼠3次,间接ELISA和间接免疫荧光实验证实E蛋白结构Ⅲ诱导了鸭坦布苏病毒特异性的体液免疫反应。中和实验证实鸭坦布苏病毒E蛋白结构域Ⅲ可诱导产生中和抗体。本研究为进一步研制鸭坦布苏病毒诊断抗原和亚单位疫苗奠定了基础。
鸭坦布苏病毒;E蛋白;结构域III;中和抗体
鸭坦布苏病毒病是由鸭坦布苏病毒(Duck Tembusu virus, DTMUV)引起的一种以蛋鸭产蛋下降为主要特征的传染病。2010年,鸭坦布苏病毒病在我国南方部分地区首次发生,之后蔓延到全国大部分鸭养殖地区[1-4]。其主要临床上表现为高热、食欲废绝、产蛋下降甚至停止,死亡率可达5%~10%[4]。该病传播迅速且发病范围广,给我国蛋鸭和种鸭养殖造成了极大经济损失。
鸭坦布苏病毒属于黄病毒科、黄病毒属,其基因组为不分节段的单股正链RNA,核苷酸长度约为11 kb,含有单一的开放阅读框,编码结构蛋白(C、PrM和E)和非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)[5,6]。其中,E蛋白是DTMUV主要表面结构蛋白,包含许多与宿主嗜性、宿主细胞膜融合及宿主细胞表面受体结合相关的抗原表位[7-9]。根据其功能不同,E蛋白分为三个结构域(I、II和III),而成免疫球蛋白样的第三结构域(EDIII)位于病毒最外层,在介导病毒与宿主受体结合中具有重要的作用,同时也是诱导中和抗体的优势表位区域[10,11]。因此,对EDIII的表达和功能研究,对病毒与宿主细胞的相互作用,临床诊断和亚单位疫苗研究具有重要意义。
1 材料与方法
1.1 病毒株、质粒和实验动物DTMUV奉贤分离株(FX2010)为本研究室分离、鉴定及保存;pCold-TF载体为TaKaRa 公司产品;DF-1细胞为上海兽医研究所禽传染病研究室(以下简称本研究室)保存;DTMUV的鸭阳性血清和DTMUV E蛋白的单克隆抗体(mAB)1F5由本研究室制备并保存;6周龄雌性BLAB/c小鼠购自上海斯莱克实验动物公司。
1.2 主要试剂限制性内切酶、蛋白Marker和DNA Marker购自TaKaRa 公司;质粒小提试剂盒和DNA胶回收试剂盒购自德国AXYGEN公司;Ni-NTA Agarose购自上海悦克生物技术有限公司;TMB显色液购自武汉博士德公司;荧光标记羊抗鼠IgG(FITC-IgG)、HRP标记的羊抗鼠IgG购自北京中杉金桥生物技术有限公司;HRP标记的羊抗鸭IgG为KPL公司产品;SuperSignal®West Pico Chemiluminescent Substrate为Thermo公司产品。
1.3 密码子优化DTMUV EDIII的核苷酸序列含有多个大肠杆菌稀有密码子,这可能会影响蛋白在原核系统中的高效表达。为了提高蛋白的表达量,本研究在不改变氨基酸序列前提下,对编码E蛋白第三结构域(EDIII)核苷酸序列进行优化,把大肠杆菌稀有密码子改变为大肠杆菌偏好性密码子,并在该基因的上游引入BamH I酶切位点,下游引入Hind Ⅲ酶切位点。优化后的基因序列由英骏生物技术有限公司合成,命名为optiEDⅢ。
1.4 原核表达载体构建将含有优化基因optiEDⅢ的质粒用限制性内切酶BamH I和Hind III 进行消化,与经相同酶消化的pCold-TF载体连接,连接好的产物转化至BL21(DE3)感受态细胞,挑取单菌落扩增培养,提取质粒后用BamH I 和Hind III 双酶切进行鉴定。将筛选到的阳性质粒进行测序以验证序列的正确性,阳性质粒命名为pCold-TF-optiEDIII。
1.5 重组蛋白的诱导表达将阳性质粒pCold-TF-optiEDIII转化至BL21(DE3)感受态细胞,挑取单菌落接种于含Amp的LB培养液中,37℃振荡培养,待菌液OD值达到0.6~0.8时,加入1 mmoL IPTG,静置30 min,15℃低温诱导24 h。将培养物4℃5600×g离心10 min,用1 mL PBS悬起管底菌液,置冰上裂解超声,4℃、5600×g离心10 min,取上清,分析表达产物。
1.6 SDS-PAGE和Western blot鉴定表达产物用10%的分离胶,将表达产物以每孔15 μL的上样量进行SDS-PAGE电泳,电泳结束后,凝胶经考马斯亮蓝R-250染色。另一部分凝胶转印至PVDF膜,采用5%脱脂乳封闭2 h,以抗DTMUV鸭阳性血清(1∶100)和His单抗(1∶1000)37℃孵育2 h,PBST洗5次,用羊抗鸭HRP-IgG(1∶ 5000)或羊抗鼠HRP-IgG(1∶10 000)为二抗,37℃孵育1 h。最后采用ECL显色和压片曝光。
1.7 重组蛋白的纯化将阳性克隆单菌落接种于含Amp的LB培养液中,37℃振荡培养至适当浓度,再按1%接种至200 mL LB培养液中培养,待菌液OD值达到0.6时,加入1 mmol/IPTG,静置30 min后,15℃低温诱导24 h。培养物4℃、5600×g离心10 min,用10 mLPBS悬起管底菌液,置冰上裂解超声,4℃、5600×g离心10 min,取上清。将收集的上清液4℃用Ni-NTA Agarose柱进行纯化,用含不同浓度咪唑的洗脱液进行滴度洗去杂蛋白,最后用400 mmol/L咪唑洗脱目的蛋白。纯化后的蛋白用BCA蛋白浓度测定试剂盒测定蛋白含量。
1.8 BALB/c小鼠免疫将BALB/c小鼠随机分成两组,每组5只。将50 μg融合蛋白和50 μg pCold-TF空载体蛋白与等体积的弗式佐剂乳化后,每3周腹腔注射免疫1次,共免疫3次,最后1次免疫后10 d采血,分离血清用于抗体检测。
1.9 间接ELISA检测血清抗体间接ELISA检测按参考文献[12]进行,将小鼠免疫血清1∶100倍稀释后加入到包被好的全病毒ELISA板中,同时设载体蛋白免疫血清(5份血清等体积混合)和小鼠阴性血清对照,37℃孵育1 h,PBST洗3次,每次5 min;加入1∶5000倍稀释的HRP标记的羊抗鼠IgG,37℃孵育1 h,PBST洗3次;用TMB显色液避光显色10 min,用2 mol/L浓H2SO4终止后,测定OD450。
1.10 间接免疫荧光试验 (indirect immunof uorescene assay, IFA) 检测血清抗体长满单层DF-1细胞的24孔细胞培养板,每孔接种1000 TCID50的DTMUV(FX2010株)病毒,培养24 h后,用4%多聚甲醛固定,用1%BSA封闭0.5 h,加入小鼠免疫血清,同时设载体蛋白免疫血清(5份血清等体积混合)和小鼠阴性血清对照,室温孵育1.5 h,以1∶200倍稀释的羊抗鼠FITC-IgG 37℃孵育1 h,PBS洗4次,在荧光显微镜下观察。
1.11 中和抗体检测将5份小鼠免疫血清等体积混合后,56℃灭活30 min,同时用小鼠高免血清和阴性血清作为对照。用含2%的FBS细胞维持液作为稀释液,将血清作2倍梯度稀释,与等体积的100TCID50病毒液混合,37℃孵育1.5 h。将50 μL混合液加入DF-1细胞长成单层的24孔细胞培养板,37℃孵育1.5 h。培养24 h,弃维持液,用4%多聚甲醛固定15 min,用0.5%Triton-100通透15 min,加入1∶400稀释的抗鸭坦布苏病毒单抗1F5,37℃孵育1 h后,用PBS洗3次,每次5 min。最后用1∶200倍稀释的荧光标记羊抗鼠FITC-IgG为二抗孵育,在荧光显微镜下观察。
2 结果
2.1 编码鸭坦布苏病毒E蛋白结构域III核苷酸序列的优化序列优化过程中,在不改变氨基酸序列的条件下,尽量采用大肠杆菌常用的密码子,优化前后序列的相似性为71.9%(图1)。

图1 鸭坦布苏病毒EDIII基因密码子优化前后的序列Fig.1 The sequences of the original and codon-optimized EDIII genes from DTMUV
2.2 重组质粒的构建与鉴定构建的质粒用BamHⅠ和Hind Ⅲ双酶切鉴定,电泳后,可以见到约350 bp左右和约5700 bp的片段,与预期大小相一致(图2)。重组质粒pCold-TF-optiEDIII经测序,结果和原序列完全一致。
2.3 SDS-PAGE和Western blot鉴定重组蛋白将重组质粒pCold-TF-optiEDIII转化BL21感受态细胞,经低温诱导后,将裂解物上清液进行SDS-PAGE电泳。结果显示在约70 kDa处出现明显条带,与预期大小一致,表明目的蛋白为可溶性表达(图3)。Western blot分析结果显示,目的蛋白与鸭坦布苏病毒阳性血清反应,也与His单抗发生反应,在约70 kDa处出现明显条带(图4),而对照的载体蛋白无特异性条带,表明表达的目的蛋白具有良好的反应原性。
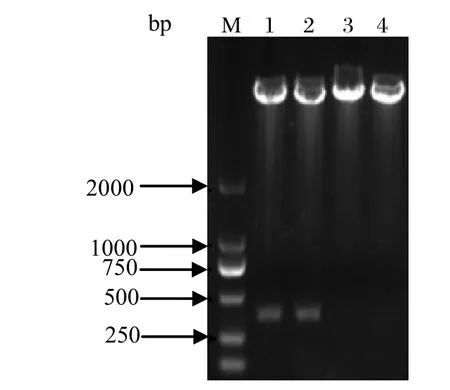
图2 BamH I and Hind III酶切鉴定重组质粒Fig.2 Identif cation of the recombinant plasmid digested with BamH I and Hind III
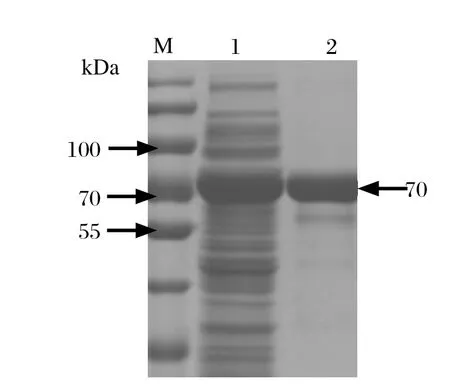
图3 SDS-PAGE分析重组蛋白Fig.3 SDS-PAGE analysis of recombinant protein
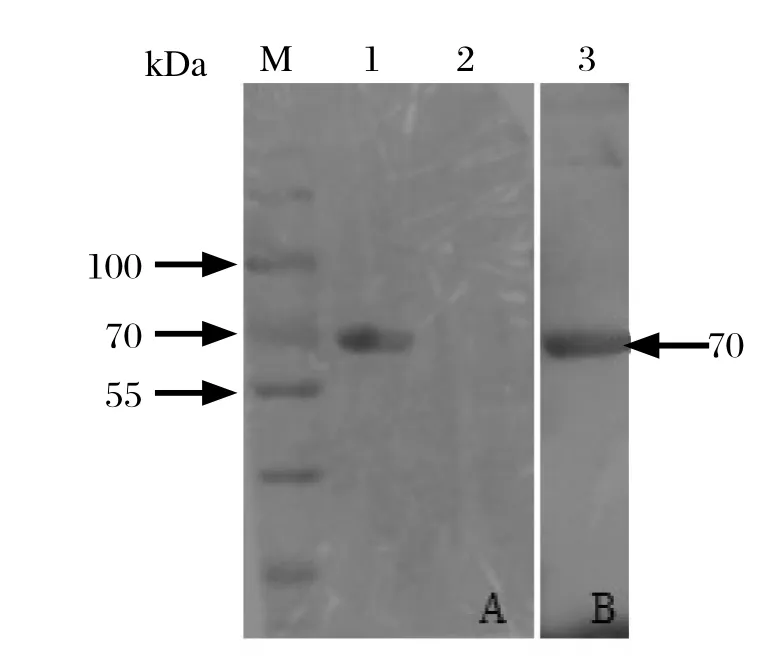
图4 用鸭坦布苏病毒血清(A)和His单抗(B)检测重组蛋白Fig.4 Western blot analysis of the recombinant protein with the duck serum against DTMUV(A) and anti-His monoclonal antibody(B)
2.4 间接ELISA和IFA检测重组蛋白免疫小鼠血清用全病毒ELISA和间接免疫荧光试验检测EDIII免疫小鼠血清,同时用载体蛋白免疫小鼠血清和小鼠阴性血清作为对照。ELISA检测结果显示,EDIII免疫小鼠抗体水平明显高于对照组(图5)。间接免疫荧光试验检测结果显示,EDIII免疫小鼠血清可与病毒发生特异性反应,病毒感染细胞呈现绿色荧光。而载体蛋白免疫小鼠血清和小鼠阴性血清都无特异性荧光(图6)。上述结果表明,重组蛋白EDIII能刺激机体产生良好的免疫应答,具有良好的免疫原性。
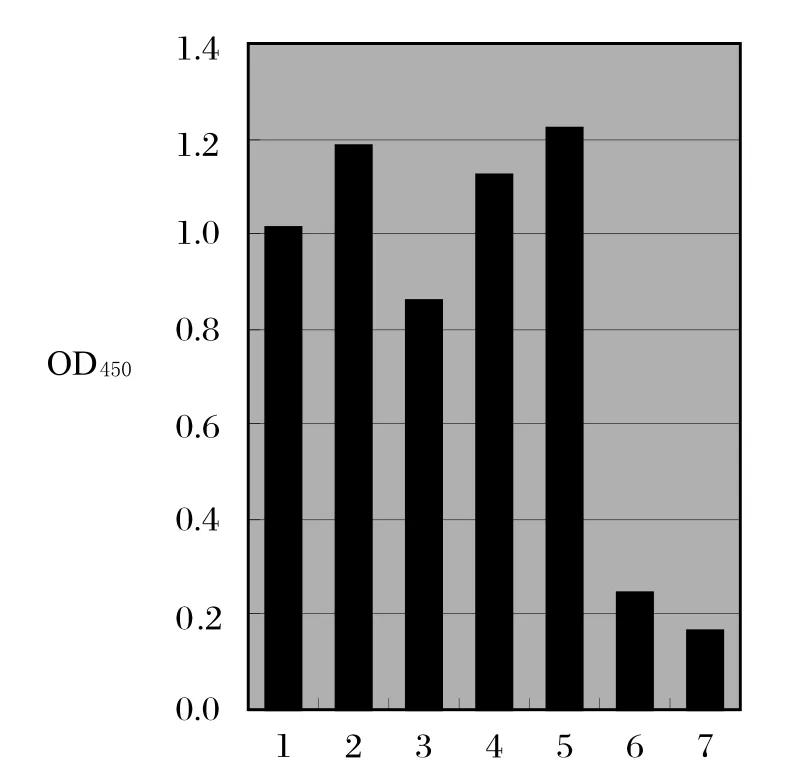
图5 间接ELISA检测重组蛋白EDIII免疫小鼠血清Fig.5 Detection of the sera from EDIII-immunized mice by indirect ELISA

图6 间接免疫荧光试验检测重组蛋白EDIII免疫小鼠血清Fig.6 Detection of the sera from EDIII-immunized mice by indirect IFA
2.5 微量血清中和试验检测免疫小鼠血清将EDIII重组蛋白和载体蛋白免疫的小鼠血清分别从1∶2开始做梯度稀释,稀释后的样品与等体积100TCID50病毒液混合感作后,用抗病毒单抗检测感染细胞的病毒。结果显示,EDIII重组蛋白免疫小鼠血清从1∶16开始可见绿色荧光,而载体蛋白免疫小鼠血清和小鼠阴性血清所有孔均可见绿色荧光(图7)。表明EDIII重组蛋白免疫血清具有中和活性。
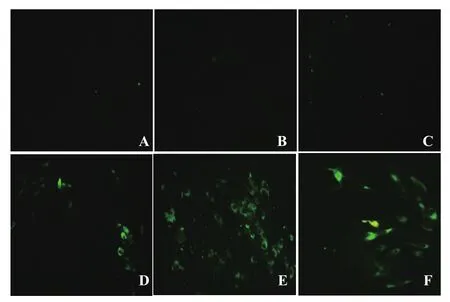
图7 微量中和试验检测重组蛋白EDIII免疫小鼠中和抗体Fig.7 Detection the neitralization antibody of sera from EDIII-immunized mice by the icroneutralization test
3 讨论
鸭坦布苏病毒与其他黄病毒一样,具有相似的E蛋白结构。E蛋白胞外区包含的三个结构域功能各异,位于中心的呈β桶装结构的第一结构域参与病毒入侵宿主细胞时构象改变;第二结构域决定二聚体形成内融合肽,而作为潜在受体结合区的免疫球蛋白样的第三结构域,其功能显得极为重要。乙型脑炎病毒、西尼罗病毒和登革热病毒等许多关于黄病毒第三结构域的研究都表明,重组表达EDIII蛋白具有良好的免疫原性,并且能够刺激机体产生中和抗体和为宿主提供有效的免疫保护[13-15]。本研究中原核表达的重组蛋白EDIII在免疫小鼠后能刺激产生有效的免疫应答,产生的抗体能中和病毒,阻断其侵染易感细胞。这预示着鸭坦布苏病毒EDIII具有良好的免疫原性,可以作为研制亚单位疫苗的候选结构区域。
以大肠杆菌为宿主的原核表达系统,由于其繁殖快、成本低等优点而被广泛使用。然而密码子对于宿主具有偏嗜性,不同宿主密码子的使用频率不同,经常会影响异源基因在宿主中的表达[16-18]。在本研究中,我们对编码鸭坦布苏病毒E基因结构域III的核苷酸序列进行了优化,使目的蛋白获得了高效表达。另外,密码子偏性只是影响蛋白表达的因素之一,载体的选择也很重要。我们将优化后的序列连接到pET-28a表达载体中,目的蛋白也得到了表达,但是非可溶性的,而且表达量明显低于pCold-TF表达载体。本研究选用的pCold-TF表达载体使目的蛋白得到了高效可溶性表达,并且证明其具有良好的免疫原性,为进一步研究鸭坦布苏病毒E蛋白结构域III的结构与功能奠定了良好的基础。
[1] Yan P, Zhao Y, Zhang X,et al. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China [J]. Virology, 2011, 417(1)∶ 1-8.
[2] Su J, Li S, Hu X,et al. Duck egg-drop syndrome caused by BYD virus, a new tembusu-related flavivirus[J]. PLoS ONE, 2011, 6(3)∶ e18106.
[3] Cao Z, Zhang C, Liu Y,et al. Tembusu virus in ducks, China[J]. Emerg Infect Dis, 2011, 17(10)∶ 1873.
[4] 滕巧泱, 颜丕熙, 张旭, 等. 一种新的黄病毒导致蛋鸭产蛋下降及死亡[J].中国动物传染病学报, 2010, 18(6)∶1-4.
[5] Yun T, Ye W, Ni Z,et al. Identification and molecular characterization of a novel flavivirus isolated from Pekin ducklings in China [J]. Vet Microbiol, 2012, 157(3-4)∶311-319.
[6] Tang Y, Diao Y, Gao X,et al. Analysis of the complete genome of Tembusu virus, a flavivirus isolated from ducks in China [J]. Transbound Emerg Dis, 2011, 59(4)∶336-343.
[7] Modis Y, Ogata S, Clements D,et al. Structure of the dengue virus envelope protein after membrane fusion [J]. Nature, 2004, 427(6972)∶ 313-319.
[8] Rey F A. Dengue virus envelope glycoprotein structure:new insight into its interactions during viral entry [J]. Proc Natl Acad Sci USA, 2003, 100(12)∶ 6899-6901.
[9] Rey F A, Heinz F X, Mandl C,et al. The envelope glycoprotein from tick-borne encephalitis virus at 2 Aresolution[J]. Nature, 1995, 375(6529)∶ 291-298.
[10] Kaufmann B, Rossmann M G. Molecular mechanisms involved in the early steps of flavivirus cell entry [J]. Microbes Infect, 2011, 13(1)∶ 1-9.
[11] Mukhopadhyay S, Kuhn R J, Rossmann M G. A structural perspective of the flavivirus life cycle[J]. Nat Rev Microbiol, 2005, 3(1)∶ 13-22.
[12] 姬希文, 闫丽萍, 颜丕熙, 等. 鸭坦布苏病毒抗体间接ELISA检测方法的建立[J]. 中国预防兽医学报, 2011, 33(8)∶ 630-634.
[13] Chu J H, Chiang C C, Ng M L. Immunization of Flavivirus West Nile Recombinant Envelope Domain III Protein Induced Specific Immune Response and Protection against West Nile Virus Infection[J]. J Immunol, 2007, 178∶ 2699-2705.
[14] Fan J, Liu Y, Xie X,et al. Inhibition of Japanese Encephalitis Virus Infection by Flavivirus Recombinant E Protein Domain III[J]. Virol Sin, 2013, 28 (3)∶ 152-160.
[15] Chin J F, Chu J J, Ng M L.The envelope glycoprotein domain III of dengue virus serotypes 1 and 2 inhibit virus entry[J]. Microbes Infect, 2007, 9(1) ∶1-6.
[16] Gustafsson C, Govindarajan S, Minshull J. Codon bias and heterologous protein expression[J]. Trends Biotechnol, 2004, 22(7)∶ 346-353.
[17] 雷子庆, 苏裕心, 郑学礼. 登革II型病毒E蛋白第三结构域在大肠杆菌中的表达、纯化及免疫性鉴定[J]. 南方医科大学学报, 2010, 30(7)∶ 1496-1500.
[18] 肖亚莉, 刘建龙, 李雪松, 等. 密码子优化的鸭坦布苏病毒E基因在昆虫细胞中的表达[J]. 中国动物传染病学报, 2013, 21(3)∶ 13-17.
PROKARYOTIC EXPRESSION OF DOMAIN III OF ENVELOPE PROTEIN OF DUCK TEMBUSU VIRUS AND CHARACTERIZATION OF NEUTRALIZING ANTIBODY RESPONSES
YU Lei, YAN Da-wei, GAO Xu-yuan, XIAO Ya-li, LIU Shao-qiong, LI Xue-song, YAN Li-ping, TENG Qiao-yang, LI Guo-xin, LI Ze-jun
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
The domain III of envelope glycoprotein (E) of the f aviviruses has been shown to bind cellular receptors and elicit neutralizing antibodies. In the present study, recombinant domain III (DIII) of E protein of Duck Tembusu virus (DTMUV) was expressed in E. coli and its immunogenicity was evaluated using BALB/c mouse model. The coding sequence of DIII was optimized (optiDIII) according to the bias codon usages of E.coli and then cloned into the multiple cloning site of pCold-TF vector to construct the recombinant plasmid pCold-TF-optiDIII. Western blot analysis showed the recombinant protein could react specif cally with DTMUV antiserum. The recombinant DIII was purif ed and used to immunize BALB/c mice three times. The humoral immune responses specif c for DTMUV were demonstrated by ELISA and indirect immunof uorescene assay(IFA). Importantly, neutralizing antibodies against DTMUV were detected in mouse serum samples by microneutralizing test. These f ndings have indicated that the recombinant DIII can be used for development of diagnostic reagents and subunit vaccines of DTMUV.
Duck Tembusu virus; envelope protein; domain III; neutralizing antibody
S852.659.6
A
1674-6422(2014)02-0001-06
2014-02-14
自然科学基金(面上)项目(31172332);上海市科技兴农重点攻关项目(沪农科攻字(2012)第2-6号);上海市科委“创新行动计划”基础研究重点项目(12JC1410600);上海市科委“创新行动计划”现代农业领域重点科技攻关项目(13391901601)
余磊,男,硕士研究生,预防兽医学专业
李泽君,E-mail:lizejun@shvri.ac.cn;李国新,E-mail:guoxinli@shvri.ac.cn
