危重患者使用人血白蛋白有效性及安全性的Meta分析
2014-04-13辛传伟孙云峰叶佐武
辛传伟 孙云峰 叶佐武
●诊治分析
危重患者使用人血白蛋白有效性及安全性的Meta分析
辛传伟 孙云峰 叶佐武
人血白蛋白(human serum albumin,HSA)是以健康人血浆为原料的制剂,长期以来被认为能有效扩充血容量和维持胶体渗透压,有人工胶体液无法比拟的运输功能,并能与阴离子、阳离子、活性的或有毒的游离物质可逆结合[1]。作为自由基清除剂,在动物模型中已证实HSA具有改善成人呼吸窘迫综合征(ARDS)的预后,保护微血管完整性等功能[2]。但另一方面,HSA可能引起过敏反应、心力衰竭、肺水肿、组织水肿及稀释性凝血障碍等不良反应。由于其昂贵的价格、有限的供应量以及它对重要器官功能和疾病结局带来的额外不良反应,对于危重患者是否应该输注HSA,临床上一直颇有争议[3]。为促进HSA在危重患者中的合理应用,笔者采用循证医学的方法对其应用进行系统评价,现报道如下。
1 资料和方法
1.1 资料来源 以“Critical illness”and“Serum Albumin”为关键词检索PubMed数据库(1995—2013年)、Cochrane Library(2013年第12期),以“人血白蛋白”和“危重患者”为关键词检索CNKI(1995—2013年)、万方数据库(1995—2013年)。文献检索无语种限制,同时补充检索已获文献的参考文献。
1.2 文献纳入标准 文献纳入参照以下标准:(1)研究设计为临床对照研究,包括随机和非随机试验;(2)研究人群为危重患者;(3)试验组(应用HSA)与对照组(应用其它胶体液或晶体液);(4)结局测量指标采用相同标准;(5)明确交代随访时间和排除标准。
1.3 资料提取 由2位研究者独立进行文献选择、资料提取和方法学质量评价工作,而后进行交叉核对,如有分歧通过协商解决,如仍不能解决可求教第三方。提取的资料:基线情况包括患者性别、年龄、临床分型、病因学分型等;试验设计包括随机方法、分配隐藏、盲法、样本量等;干预措施包括治疗方案、剂量、疗程、随访时间、有无失访退出及其原因、测量指标的结果。
1.4 质量评价 按照Cochrane系统推荐的质量评价标准[4]:(1)随机方法是否正确;(2)是否采用分配隐藏;(3)是否采用盲法;(4)失访及其处理是否恰当。将研究质量从高到低分为A、B、C 3级。A级:低度偏倚,完全满足以上4条质量标准,发生各种偏倚的可能性最小;B级:中度偏倚,其中1条或1条以上的标准为部分满足,有发生偏倚的可能性;C级:高度偏倚,其中1条或1条以上的标准完全不满足,有发生偏移的高度可能性。
1.5 统计学处理 使用Cochrane协作网提供的RevMan 5.2软件。计数资料用相对危险度(RR)或比值比(OR),计量资料采用加权均数差(WMD)或标准化均数差(SMD),两者均以95%可信区间(CI)表示。当试验结果存在异质性时采用随机效应模型分析,反之采用固定效应模型分析。
2 结果
2.1 原始资料数量和证据级别 初检获得文献85篇,去重后得到42篇;通过阅读文题和摘要,初筛出27篇;通过阅读全文进一步筛选,最终纳入17篇研究,均为国外文献。国内文献由于存在设计欠合理、没有对照药物、临床资料缺乏全文等原因未入选。共有5 588例患者接受了HSA治疗,5 653例患者接受了其它胶体液或晶体液治疗。符合要求的文献及特征详见表1。
2.2 纳入文献的临床试验及Meta分析结果
2.2.1 HSA对于危重患者病死率的影响 共检索到符合要求的文献11篇,异质性检验表明结果间具有异质性(P<0.01,I2=66%),故采用随机效应模型分析,结果见图1。Meta分析结果显示,纳入文献研究合并后的OR= 0.03,95%CI(-0.03~0.09),菱形位于垂直线右侧,结合OR值说明,HSA治疗危重患者时病死率较对照组(晶体液或其他胶体液)高。
该评价中由于Boldt等的研究[16-17,20-21]纳入患者数量较少,为了评估结果的稳定性,笔者排除了Boldt等的研究[16-17,20-21],将其他研究再进行合并分析,其结果如图2所示,异质性检验表明结果间具有异质性(P<0.01,I2=79%),故采用随机效应模型分析,结果见图2。Meta分析显示,纳入文献研究合并后的OR=0.04,菱形位于垂直线右侧,结合OR值说明HSA组治疗危重患者时病死率较对照组(晶体液或其他胶体液)高,与总体结果一致。
2.2.2 HSA对危重患者并发症发生率的影响 共检索到符合的文献7篇,异质性检验表明结果间具有同质性(P>0.05,I2=43%),故采用固定效应模型分析,结果见图3。Meta分析结果显示,纳入文献研究合并后的OR= 0.66,95%CI(0.55~0.79),菱形位于垂直线左侧,经Z检验,两组比较有统计学差异(P<0.01),结合OR值说明HSA在治疗危重患者时并发症发生率明显低于对照组。

表1 纳入Meta分析的17篇文献研究特征及质量评价

图1 HSA与对照药物对危重患者病死率影响的Meta分析森林图
3 讨论
Meta分析是对具备特定条件的、同课题的诸多研究结果进行综合分析的一类统计方法,主要用于随机对照临床试验(RCT)结果的综合分析。RCT研究方法在各种临床疗效考核的方法中具有最高的论证强度,能最真实地反映所研究药物的临床疗效,高质量的RCT分析结果被各国列为最高等级的证据,为循证医学服务。本研究通过将检索到的相关文献进行Meta分析,发现在危重患者中应用HSA可以减少并发症,但和对照组(晶体液或其他胶体液)相比,现有的证据不支持HSA能降低患者病死率。

图2 排除Boldt研究后HSA与对照药物对危重患者病死率影响的Meta分析森林图
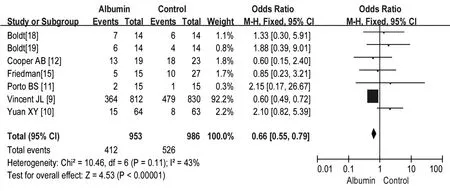
图3 HSA与对照药物对危重患者并发症发生率影响的Meta分析森林图
HSA具有增加循环血容量、维持血浆胶体渗透压、结合与运输血液中的小分子物质等功能,因此有部分医师习惯对病情危重、低蛋白血症和营养不良的患者应用HSA来提高患者的生存率。关于HSA对危重患者的疗效评价,SAFE研究(saline versus albumin fluid evaluation)[6]是一个重要的里程碑,该研究是澳大利亚和新西兰危重医学会发起的一项大型双盲随机对照研究,是迄今为止评价HSA疗效的规模最大的临床研究。共纳入6 997例患者,以病死率为主要终点指标,比较HSA和0.9%氯化钠溶液在危重患者液体复苏中的作用。结果在28d的观察期结束后,由于各种原因导致HSA组和对照组的患者病死率无明显差异,两组患者病死率分别为20.9%和21.1%(RR=0.99,95%CI 0.91~1.09)。综合另外几篇以病死率为终点指标的文献中,Meta分析的结果显示菱形位于垂直线的右侧,说明和晶体液或其他胶体液相比,目前的证据尚不支持HSA能降低患者病死率。其可能的主要原因有[23]:(1)应用HSA快速扩容后可致血容量明显增加,因而可能导致患者心脏功能代偿失调,发生肺间质水肿;(2)在低血容量休克复苏中应用HSA可能影响钠和水的排泄而加重患者肾功能衰竭;(3)HSA的抗凝和减少血小板的作用可能增加手术后或外伤患者的失血。
在评价HSA疗效时,由于在重症患者中并发症发生率较高,并发症的发生还可导致住院时间延长和费用增加,因此有时以并发症的发生率作为指标来评价HSA对于重症患者的有效性。从图3可见,纳入HSA对于危重患者并发症发生率影响的共有7篇文献,Meta分析得出的森林图中,最下方的菱形位于垂直线的左侧,说明同对照组比较,HSA组的并发症发生率较低。以上结果提示,HSA在多种临床情况下有可能带来益处,与晶体液相比,HSA可降低心脏手术、非心脏手术、腹水等患者的并发症发生率,且含HSA的治疗方案可改善脑损伤患者的预后[24],这些效果可能是由于HSA比晶体液更能增加血管内容积,维持胶体渗透压,抗血小板聚集,而且HSA还能作为生物活性分子的运输载体、作为药物结合剂,以及作为自由基抗氧化剂。这也提示临床不能完全排除HSA的应用,而是应进一步深入研究,为各种临床适应证制订最佳的治疗方案。
正如所有的Meta分析一样,本研究还存在着局限性,比如集中分析结果仅仅能证明所包括的研究结果是可靠的。在这些分析中,所进行的研究方法的质量评价则不一定是最佳的。在检索文献的过程中笔者发现,关于HSA用于危重患者的治疗研究资料较多,但是具体到某一病种或大规模的高质量RCT资料则较少,应鼓励临床开展足够的、设计良好的RCT进一步研究。
综上所述,本研究结果表明,与其他液体相比,HSA用于危重患者的治疗并不能降低患者病死率,但在治疗并发症上有明显优势。今后有必要对危重患者的特定病种进行针对性的临床试验,以便指导HSA的临床应用。
[1]徐宝全.国内人血白蛋白市场供需状况及应对策略研究[J].生物产业技术,2009,4(4):89.
[2]何超,王虑,李文放,等.大剂量人血白蛋白快速滴注治疗重度ARDS的临床观察[J].中国急救医学,2011,31(5):475-476.
[3]Fanali G,di Masi A,Trezza V,et al.Human serum albumin:from bench to bedside[J].Mol Aspects Med,2012,3(3):209-290.
[4]Julian P T Higgins,Sally G.Cochrane Handbook for Systematic Reviews of Intervention Version 5.2.0[EB/OL].The Cochrane Collaboration,2013.
[5]Finfer S,Bellomo R,Boyce N,et al.A comparison of albumin and saline for fluid resuscitation in the intensive care unit[J].N Engl J Med,2004,350(22):2247-2256.
[6]SAFE Study Investigators,Australian and New Zealand Intensive Care Society Clinical Trials Group.Saline or albumin for fluid resuscitation in patients with traumatic brain injury[J].N Engl J Med, 2007,357(9):874-881.
[7]Vincent J L,Sakr Y,Reinhart K,et al.Is albumin administration in the acutely ill associated with increased mortality?Results of the SOAP Study[J].Crit Care,2005,9(6):745-754.
[8]Veneman T F,Oude Nijhuis J,Woittiez A J.Human albumin and starch administration in critically ill patients:A prospective randomized clinical trial[J].Wien Klin Wochenschr,2004,116(9-10): 305-309.
[9]Vincent J L,Navickis R J,Wilkes M M.Morbidity in hospitalized patients receiving human albumin:A Meta-analysis of randomized, controlled trials[J].Crit Care Med,2004,32(10):2029-2032.
[10]Yuan X Y,Zhang C H,He Y L,et al.Is albumin administration beneficial in early stage of postoperative hypoalbuminemia following gastrointestinal surgery?:a prospective randomized controlled trial[J].Am J Surg,2008,196(5):751-755.
[11]Porto B S,Jorge S M,de Assis M G.Exogenous human albumin supplementation in total parenteral nutrition of critically ill newborns[J].J Pediatr(Rio J),2005,81(1):41-46.
[12]Cooper A B,Cohn S M,Zhang H S,et al.Five percent albumin for adult burn shock resuscitation:lack of effect on daily multiple organ dysfunction score[J].Transfusion,2006,46(1):80-89.
[13]Dolecek M,Svoboda P,Kantorova I,et al.Therapeutic influence of 20%albumin versus 6%hydroxyethylstarch on extravascular lung water in septic patients:a randomized controlled trial[J].Hepatogastroenterology,2009,56(96):1622-1628.
[14]Van der Heijden M,Verheij J,van Nieuw Amerongen G P,et al.Crystalloid or colloid fluid loading and pulmonary permeability, edema,and injury in septic and nonseptic critically ill patients with hypovolemia[J].Crit Care Med,2009,37(4):1275-1281.
[15]Friedman G,Jankowski S,Shahla M,et al.Hemodynamic effects of 6%and 10%hydroxyethyl starch solutions versus 4%albumin solution in septic patients[J].J Clin Anesth,2008,20(7):528-533.
[16]Boldt J,Heesen M,Müller M,et al.The effects of albumin versus hydroxyethyl starch solution on cardiorespiratory and circulatory variables in critically ill patients[J].Anesth Analg,1996,83(2): 254-261.
[17]Boldt J,Heesen M,Welters I,et al.Does the type of volume therapy influence endothelial-related coagulation in the critically ill [J]?Br J Anaesth,1995,75(6):740-746.
[18]Boldt J,Müeller M,Menges T,et al.Influence of different volume therapy regimens on regulators of the circulation in the critically ill[J].Br J Anaesth,1996,77(4):480-487.
[19]Boldt J,Müller M,Heesen M,et al.Influence of different volume therapies on platelet function in the critically ill[J].Intensive Care Med,1996,22(10):1075-1081.
[20]Boldt J,Müller M,Heesen M,et al.Influence of different volume therapies and pentoxifylline infusion on circulating soluble adhesion molecules in critically ill patients[J].Crit Care Med,1996, 24(3):385-391.
[21]Boldt J,Müller M,Mentges D,et al.Volume therapy in the critically ill:Is there a difference[J]?Intensive Care Med,1998,24(1):28-36.
[22]Cochrane Injuries Group Albumin Reviewers.Human albumin administration in critically ill patients:systematic review of randomized controlled trials[J].BMJ,1998,317(7153):235-240.
[23]Youngja P,Dean P J,Thomas R Z,et al.Metabolic effects of albumin therapy in acute lung injury measured by 1H-NMR spectroscopy of plasma:a pilot study[J].Crit Care Med,2011,39(10): 2308-2313.
[24]丁振汉,李燕青,杨嫦.人血白蛋白的临床使用调查分析[J].中国医药指南,2013,11(22):127-128.
2014-02-13)
(本文编辑:胥昀)
浙江省药学会医院药学科研基金项目(2012ZYY12)
310012 杭州,浙江省立同德医院药学部
