TGF-β1对哮喘大鼠气道平滑肌细胞增殖的影响研究
2014-04-13吴立琴戴元荣李凤琴王瑞丽曾潍贤
吴立琴 戴元荣 李凤琴 王瑞丽 曾潍贤
TGF-β1对哮喘大鼠气道平滑肌细胞增殖的影响研究
吴立琴 戴元荣 李凤琴 王瑞丽 曾潍贤
目的 探究TGF-β1对哮喘大鼠气道平滑肌细胞(ASMC)增殖的影响,进一步揭示哮喘的发病机制。方法建立大鼠慢性哮喘模型,原代分离培养大鼠ASMC,将细胞分为正常组、哮喘组、TGF-β1组和TGF-β1+PD-98059组,以CCK-8法检测细胞增殖,Western blot法检测caveolin-1和p-ERK1/2蛋白表达。结果TGF-β1组细胞增殖较正常组和哮喘组明显(均P<0.01);TGF-β1+PD-98059组细胞增殖较TGF-β1组减低,但较哮喘组仍明显(均P<0.05)。TGF-β1组p-ERK1/2表达量较正常组和哮喘组增加;TGF-β1+PD-98059组p-ERK1/2表达量较TGF-β1组减少,但较哮喘组表达量仍有所增加(均P<0.05)。TGF-β1组caveolin-1表达量较正常组和哮喘组减少(均P<0.05);TGF-β1+PD-98059组caveolin-1表达量较TGF-β1组增加(P<0.05)。结论TGF-β1可以下调caveolin-1蛋白的表达量,激活ERK通路,从而促进哮喘大鼠ASMC的增殖,引起气道重塑。
转化生长因子-β1 哮喘 气道平滑肌细胞 微囊蛋白-1 ERK
支气管哮喘(简称哮喘)是由多种细胞和细胞组分参与的气道慢性炎症性疾病。气道重塑是其重要的病理特征,而气道平滑肌细胞(ASMC)的增殖和肥大在哮喘气道重塑中发挥了重要作用[1]。丝裂原活化蛋白激酶(MAPK)是参与哮喘发病机制的一类信号转导酶,其中细胞外信号调节激酶(ERK)是该家族中最先被发现且研究最多的成员,包括p44MAPK(ERK1)和p42MAPK(ERK2)亚型[2]。转化生长因子-β1(TGF-β1)是参与呼吸道重塑的重要细胞因子[3],有研究表明TGF可能是通过ERK信号转导促进大鼠ASMC的增殖。微囊是ASMC表面的凹陷结构,其主要结构蛋白微囊蛋白-1(caveolin-1)在细胞的物质转运、信号转导方面具有重要的作用。本研究拟通过复制大鼠慢性哮喘模型,分离培养大鼠ASMC,并给予MAPK特异性抑制剂PD-98059干预,探讨TGF-β1对ASMC增殖的影响,进一步揭示哮喘的发病机制。
1 材料和方法
1.1 实验动物 购自上海实验动物中心的SPF级健康雄性SD大鼠30只,6~8周龄,体重(200±10)g。饲养于温州医科大学实验动物中心SPF级实验室,饲养温度25℃,相对湿度70%,12h交替采光。
1.2 主要仪器和试剂 倒置显微镜NIKON TS100为日本尼康公司产品;Ⅰ型胶原酶、SM α-actin单克隆抗体购于美国Sigma公司;TGF-β1购于美国PeproTech公司;PD-98059购自美国CST公司;兔抗大鼠p-ERK1/ 2抗体(1∶1 000)、兔抗大鼠caveolin-1抗体(1∶1 000)购于美国abcam公司;小鼠抗大鼠GAPDH抗体(1∶5 000)、辣根过氧化物酶标记的山羊抗兔二抗(1∶2 000)、山羊抗鼠二抗(1∶3 000)均为苏州碧云天生物工程有限公司产品。
1.3 大鼠慢性哮喘模型的建立及鉴定 将30只SD大鼠按照随机数字表法分为哮喘组(15只)和正常组(15只)。建立大鼠慢性哮喘模型,即第1天和第8天大鼠腹腔内注射含1mg卵白蛋白(OVA)和100mg Al(OH)3的OVA/Al(OH)3混合液1ml致敏;第15天开始雾化吸入含1%OVA的0.9%氯化钠溶液8ml激发哮喘,每次30min,隔日1次,共8周。正常组用等量0.9%氯化钠溶液致敏和激发。模型制备成功后行组织切片观察气道形态,肺泡灌洗液细胞计数等对哮喘模型进行鉴定。
1.4 细胞培养及鉴定 大鼠模型建立成功后,原代分离正常组和哮喘组大鼠ASMC,利用组织块贴壁法分别培养,待细胞长满后用胰酶消化细胞传代,取第3代细胞进行实验。ASMC鉴定采用SM α-actin抗体,免疫组化SABC法。
1.5 CCK-8法检测大鼠ASMC的增殖 收集细胞,调整浓度为4~5×103个/ml,接种于96孔板,每孔100μl,待细胞80%~90%融合后,以无血清RPMI 1640培养24h,使细胞同步于G0期后换用10%FBS的RPMI 1640液培养。细胞分组如下:哮喘组、1μg/L TGF-β1组、10μg/L组和100μg/L组,各组中加入不同浓度TGF-β1分别培养24、48h。进一步研究TGF-β1对ASMC增殖的影响,经前期实验TGF-β1浓度选择10μg/L。细胞分组如下:正常组、哮喘组、TGF-β1(10μg/L)组、PD-98059组和TGF-β1(10μg/L)+PD-98059组。TGF-β1组细胞以10μg/L TGF-β1作用48h,TGF-β1+PD-98059组细胞用PD-98059预处理1h后加入10μg/L TGF-β1作用48h。培养结束时,每孔中加入10μl的CCK-8,混匀后继续培养1~4h,注意避光操作。酶联免疫检测仪450nm波长测定各孔OD值。每组设4个复孔,实验重复4次。
1.6 Western blot法检测p-ERK1/2及caveolin-1表达 大鼠ASMC分组为正常组、哮喘组、TGF-β1(10μg/ L)组和TGF-β1(10μg/L)+PD-98059组,培养同上。收集细胞,提取蛋白质,上样检测,化学发光试剂显色,胶片贴近曝光,显影、定影后用AlphaEaseFC 4.0软件分析目的蛋白相对含量。
1.7 统计学处理 应用SPSS 17.0统计软件,计量资料以表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。
2 结果
2.1 各组大鼠肺组织支气管病理改变 与正常组相比,哮喘组大鼠支气管壁及支气管平滑肌明显增厚,黏膜下水肿,黏膜下层增宽,黏膜皱褶增多,管腔狭窄,气道上皮细胞脱落,杯状细胞增多,黏膜下及管周有大量炎性细胞浸润(包括嗜酸粒细胞),见图1。

图1 大鼠肺组织支气管病理改变(A:正常组;B:哮喘组;HE染色,×200)
2.2 各组大鼠ASMC鉴定 倒置显微镜下观察见细胞呈梭形,有较长的突起,圆形细胞核位于细胞中央,呈疏密相间、典型“峰和谷”生长状态。SM α-actin免疫组化染色产物呈棕黄色,95%细胞染色阳性,证实传代培养的细胞为ASMC,见图2。

图2 各组大鼠ASMC鉴定(A:形态学观察,×100;B:SMα-actin免疫组化鉴定,SABC法染色,×200)
2.3 各组ASMC增殖情况 与1μg/L TGF-β1组细胞OD值 0.946±0.041比较,10μg/L TGF-β1组 1.018± 0.042和100μg/L TGF-β1组OD值1.019±0.435均明显增加(均P<0.01),10μg/L TGF-β1组和100μg/L TGF-β1组比较则无统计学差异(P>0.05)。1μg/L TGF-β1组作用24h时细胞OD值为0.946±0.041,而作用48h时为 0.988±0.038;10μg/L TGF-β1组作用 24h时为1.018±0.042,而作用 48h时为 1.083±0.037;100μg/L TGF-β1组作用24h时为1.019±0.435,而作用48h时为1.104±0.039,各浓度作用48h均较24h增殖作用明显(均P<0.05)。
进一步研究发现,10μg/L TGF-β1组细胞OD值1.222±0.143较正常组0.867±0.109和哮喘组1.008± 0.161增加明显(均P<0.01);TGF-β1+PD-98059组1.114±0.147较10μg/L TGF-β1组则减低(P<0.05),但较哮喘组仍增加(P<0.05);PD-98059组与哮喘组比较无统计学差异(P>0.05)。
2.4 各组ASMC中p-ERK1/2及caveolin-1的表达情况 10μg/L TGF-β1作用后,p-ERK1/2表达逐渐增强,作用20min时p-ERK1/2表达达到高峰,见图3。10μg/L TGF-β1组p-ERK1/2表达量较正常组和哮喘组增加(均P<0.05);TGF-β1+PD-98059组较TGF-β1组p-ERK1/2表达量减少,但较哮喘组表达量仍有所增加(均P<0.05)。10μg/L TGF-β1组caveolin-1表达量较正常组、哮喘组减少(均P<0.05),且TGF-β1+PD-98059组caveolin-1表达量较TGF-β1组增加(P<0.05),见图4。
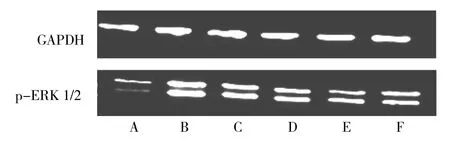
图3 各组ASMC中p-ERK1/2的表达(A:30min;B:20min;C:15min;D:10min;E:5min;F:0min)
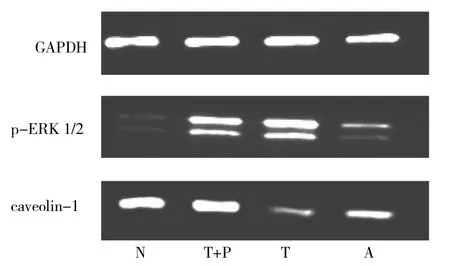
图4 各组ASMC中caveolin-1及p-ERK1/2的表达(N:正常组;T+P:10μg/L TGF-β1+PD-98059组;T:10μg/L TGF-β1组;A:哮喘组)
3 讨论
既往研究已证实,TGF-β1与气道重塑有重要的关系[4],如果气道受到反复抗原刺激引起持续的慢性炎症,就可导致TGF-β1持续过度增高,从而引起组织纤维化、气道重塑及气道慢性阻塞[5]。本实验通过建立大鼠慢性哮喘模型,原代分离培养大鼠ASMC,经过不同浓度和时间的作用,发现TGF-β1能促进ASMC增殖,并有一定的时间和浓度依赖性。10μg/L与100μg/L TGF-β1组之间无统计学差异,笔者推测这与本实验条件下TGF-β1受体表达可能已近峰值有关。
ERK通路是与细胞增殖相关的一条重要的细胞信号转导通路,作为关键酶的ERK存在多种亚型,已有研究证明,ERK1/2主要分布在ASMC上[6]。Lee等[7]研究认为ERK1、ERK2在ASMC增殖的信号转导通路中发挥重要作用,有研究表明TGF-β1可能通过ERK信号途径促使大鼠ASMC增殖[8],Finlay等[9]证实PD-98059是ERK1/2信号通路的非竞争性抑制剂,它们通过特异性地抑制其上游激酶MEK1/2的活性进而阻断ERK1/2通路的激活,由此抑制了细胞的增殖和表型的转化。本研究结果显示随着10μg/L TGF-β1作用时间延长,ASMC中p-ERK1/2蛋白表达增强,作用20min时达高峰,30min时减弱,说明TGF-β1能促进p-ERK表达,并存在表达高峰。本研究还显示TGF-β1组较正常组和哮喘组p-ERK1/2表达量增加,加入抑制剂PD-98059干预后,其表达量较TGF-β1组减少,但仍高于哮喘组,提示了TGF-β1促进大鼠ASMC的增殖与ERK信号传导通路有关,PD-98059能抑制上述效应,但不能使其恢复至对照组水平,说明TGF-β1引起的细胞增殖过程中,ERK通路可能不是唯一途径。
caveolin-1位于细胞表面,与胆固醇的转运、胞饮作用及信号转导密切相关,其与多种信号分子存在反向调节关系。Gosens等[10]研究显示caveolin-1在人类哮喘ASMC中有明显的抗有丝分裂的作用。本实验中TGF-β1组较正常组和哮喘组caveolin-1表达量减少,抑制剂PD-98059干预后表达量增加,提示caveolin-1可能参与了TGF-β1通过ERK信号传导通路促进ASMC增殖的过程。
综上所述,本研究结果表明TGF-β1促进ERK通路的活化在哮喘气道重塑中发挥着重要的作用,其可能是通过调节caveolin-1的表达来实现的。抑制TGF-β1的分泌及ERK通路的活化可以有效阻止ASMC异常增殖,从而减缓哮喘的气道重塑,本研究可能为哮喘气道重塑的防治提供了一种新思路。
[1]Munakata M.Airway remodeling and airway smooth muscle in asthma[J].Allergol Int,2006,55(3):235-243.
[2]范晓燕,张焕萍.p-ERK1/2及ERK mRNA在哮喘大鼠气道中的表达变化[J].中国比较医学杂志,2008,18(3):14-18.
[3]Kohan M,Bader R,Puxedduw I,et al.Enhanced osteoponin expression in amurine model of allergen-induced airway remodeling [J].Clin Exp All,2007,37(10):1444-1454.
[4]Chu H W,Truderu J B,Balzar S,et al.Peripheral blood and airwaytissue expression of transforming growth factor-beta by neutrophills in asthmatic subjects normal control subjects[J].J Allergy Clin Immunol,2000,106(6):1115-1123.
[5]Nakao A.Is TGF-beta1 the key to suppression of human asthma [J]?Trends Immunol,2001,22(3):115-118.
[6]Kavurma M M,Khachigian L M.ERK,JNK,and p38 MAP kinases differentially regulate proliferation and migration of phenotypically distinct smooth muscle cell subtypes[J].J Cell Biochem,2003,89 (2):289-300.
[7]Lee J H,Johnson P R,Roth M,et al.ERK activation and mitogenesis in human airway smooth muscle cells[J].Am J Physiol Lung Cell Mol Physiol,2001,280(5):1019-1029.
[8]Chen G,Khalil N.TGF-beta1 increases proliferation of airway smooth muscle cells by phosphorylation of map kinases[J].Respir Res,2006,7:2-3.
[9]Finlay G A,Thannickal V J,Fanburg B L,et al.Transforming growth factor-beta 1-induced activation of the ERK pathway/activator protein-1 in human lung fibroblasts requires the autocrine induction of basic fibroblast growth factor[J].J Biol Chem,2000, 275(36):27650-27656.
[10]Gosens R,Stelmack G L,Dueck G,et al.Role of caveolin-1 in p42/p44 MAP kinase activation and proliferation of human airway smooth muscle[J].Am J Physiol Lung Cell Mol Physiol,2006, 291(3):523-534.
Effect of TGF-β1 on proliferation of airway smooth muscle cells in asthma rats
Objective To investigate the effect of TGF-β1 on the proliferation of airway smooth muscle cells(ASMCs)in asthma rats.MethodsChronic asthma model was induced in rats and airway smooth muscle cells were isolated and cultured in vitro.The cultured ASMCs were divided into normal group,asthma group,TGF-β1 group and TGF-β1+PD-98059 group.The cell proliferation was determined with CCK-8 method and the expression of caveolin-1 and p-ERK1/2 protein was detected with Western blot.ResultsThe expression of p-ERK1/2 increased significantly in TGF-β1 group compared with other 3 groups(P<0.05),while the expression in TGF-β1+PD-98059 group was higher than that in asthma group(P<0.05).The expression of caveolin-1 in TGF-β1 group was lower than that in the normal group and asthma group as well as in TGF-β1+PD-98059 group (P<0.05).ConclusionTGF-β1 can down-regulate the expression of protein caveolin-1 to activate the ERK pathway,thereby to promote the proliferation of airway smooth muscle cells,which finally causes airway remodeling.
TGF-β1 Asthma ASMC Caveolin-1 ERK

2013-09-22)
(本文编辑:胥昀)
浙江省卫生厅课题(2009A144)
325027 温州医科大学附属第二医院呼吸内科(吴立琴、戴元荣、李凤琴),ICU(王瑞丽),急诊科(曾潍贤)
戴元荣,E-mail:daiyr@126.com
