醋酸菌的分类进展
2014-04-12陈福生
王 斌,陈福生*
(华中农业大学食品科技学院,食品生物技术与安全实验室,湖北武汉 430070)
醋酸菌(acetic acid bacteria,AAB)是指能以氧气为终端电子受体,氧化糖类、糖醇类和醇类生成相应的糖醇、酮和有机酸的革兰氏阴性细菌的总称[1]。第一个AAB属——醋酸杆菌属(Acetobacter,A.),是1898年由BEIJERINCK M[2]提出的。随后,葡糖杆菌属(Gluconobacter,G.)和酸单胞菌属(Acidomonas,Ac.)分别在1935年和1989年由ASAI和UHLIG提出[3]。从1898第一个AAB属被发现至1989年的91年中,仅报道了2个新AAB属,不到10个种。而从1989年至今的25年中,AAB的研究突飞猛进,截至2014年初,已报道的AAB共16个属,84个种。随着AAB种类的增加,AAB的功能也逐渐被发掘。AAB最初因具有生产醋酸的能力而得名,随后的研究发现,有些AAB并不具有产醋酸能力,如朝井杆菌属(Asaia,As.)和糖杆菌属(Saccharibacter,S.)[4-5];而有些AAB除生产醋酸外,还具有产生纤维素、色素、吲哚乙酸、抗坏血酸和固氮等功能[6-10]。本文总结了AAB常用的分离培养基、AAB分类、鉴定与保藏方法、AAB命名原则与种属名称演变,并对AAB的种属特征进行了归纳。
1 AAB的分离、分类与保藏
1.1 分离AAB常用的培养基
AAB广泛分布于发酵食品(如食醋、酒类产品、可可豆和红茶)、植物器官(如水果、花朵、花粉、茎和根)、动物器官(如果蝇肠道和人体淋巴结)和土壤(如植物根系周围土壤)、酿造厂周边土壤和古墓墙壁中。样品不同,分离AAB的培养基种类不同(见表1),分离得到的AAB特性也不同。
分离AAB的常用培养基主要包括葡萄糖酵母浸膏蛋白胨乙醇(glucose yeast peptone ethanol,GYPE)培养基和葡萄糖酵母浸膏(glucose yeast,GY)培养基。采用这些培养基分离AAB时,通常还需要采用含有100 μg/kg环己酰亚胺等真菌抑制剂,pH值为3.5的葡萄糖酵母浸膏蛋白胨醋酸乙醇(glucose yeast peptone acetic acid-ethanol,GYPAE)富集培养基进行富集,然后再进行分离;分离具有固氮功能的AAB时,一般选用Dobereiner无氮培养基(又名LGI培养基);而分离高耐酸(醇)的AAB时,常常采用含有一定浓度醋酸和酒精的强化醋酸乙醇(reinforced acetic acidethanol,RAE)培养基和醋酸乙醇(acetic acid-ethanol,AE)培养基。此外,也有学者采用双层培养基分离AAB。如ENTANI E等[11]以含0.5%琼脂的AE作为底层培养基,用1%琼脂的AE培养基作为上层培养基,并将分离平板置于水分活度达95%~100%的密闭容器中培养,成功分离得到了产酸量达10%~15%的AAB。表1列出了分离AAB的主要培养基的名称、组成成分和适用范围。

表1 分离醋酸菌的主要培养基及其适用范围Table 1 Medium to isolate AAB and their applicable scope
1.2 AAB的分类、鉴定方法
关于AAB的分类与鉴定,早期主要基于其菌落(菌体)形态与碳(氮)源的同化特征以及辅酶Q的类型和脂肪酸组成等特征进行[3]。随着分子生物学技术的发展,常常将这些特征与AAB的遗传特征相结合来进行分类与鉴定。自从1980年GILLIS M等[15]第一次将DNA碱基组成[16]用于AAB的分类之后,16S rRNA限制性片段长度多态性分析、16S-23S rDNA ITS[17]、PCR-DGGE[18]、16S-23S-5S rDNA PCR-RFLP[19]、(GTG)5-PCR[20]和Taqman-MGB探针[21]等分子生物学技术与手段被先后作为AAB分类鉴定的辅助手段。目前,通常是将上述三方面信息相结合,对AAB进行分类。
1.3 AAB的保藏
AAB菌种的保藏方法与一般微生物的保藏方法相同。但是研究表明,部分AAB,特别是高产酸AAB的遗传特征非常不稳定,所以这类AAB最好的保藏方法是冷冻干燥保藏,且尽可能减少传代次数[22]。高产酸AAB遗传稳定性差的原因可能与AAB基因组中的质粒、高可变的重复序列(hyper mutable tandem repeats)以及转座子(transposons)含量较多相关[23]。
目前,国际上主要的微生物菌种保藏中心均保藏有AAB,并对外提供菌种保藏、交换与销售服务。其中,日本微生物保藏中心(Japan Collectionof Microorganisms,JCM)、日本技术评价研究所生物资源中心(NITE Biological Re source Center,NBRC)、德国菌种保藏中心(Deutsche Samm lung von Mikroorganismen und Zellkulturen,DSMZ)、比利时微生物综合保藏中心(Belgian Co-ordinated Collections of Microorganisms,BCCM)、美国典型菌种保藏中心(American Type Culture Collection,ATCC)以及国内的工业微生物菌种保藏中心(Center of Industrial Culture Collection,CICC)和普通微生物菌种保藏中心(General Microbiological Culture Collection Center,CGMCC)等是AAB的主要保藏中心。在这些菌种保藏中心中,JCM、NBRC和DSMZ保藏的AAB的种类与数量最全面和最多,它们保藏的AAB几乎覆盖了目前所有的AAB种属,保藏的AAB数量也超过世界AAB菌株总数量的一半。而我国的上述两个菌种保藏中心仅保藏4个AAB属:醋酸杆菌属(Acetobacter)、葡糖杆菌属(Gluconobacter)、葡糖醋杆菌属(Gluconacetobacter)和朝井杆菌属(Asaia),13种AAB,共137株。
2 AAB的种属
AAB的分类发展大致分为两个阶段。第一阶段是AAB的发现与认识阶段,从1898年第一个AAB属,醋酸杆菌属的提出至1989年的91年中,仅仅报道了醋酸杆菌属、葡糖杆菌属和酸单孢菌属,共3个AAB属,约10种。第二阶段从1989年至今,是AAB分类的发展阶段。在这25年中,基本上平均以每两年报道1个AAB新属、3个新种的速度发展。截至2014年初,已报道了16个AAB属,共84个种(见表2)。这一方面与分子生物学技术用于AAB的辅助分类有关,另一方面,与AAB新的生物学功能发现、研究和应用也密不可分[24]。如HESTRIN S等[25]1947年就在《Nature》上发表了[木杆菌(A.xylinum),1997年和2012年先后更名为木葡糖醋杆菌(Ga.xylinus)和木驹形杆菌(K.xylinus)]可生产纤维素的研究结果。此后的研究发现,柿子葡糖醋杆菌(Ga.persimmonis)、柿醋驹形杆菌(K.kakiaceti)、麦德林驹形杆菌(K.medellinensis)等AAB也能产生纤维素[26-28]。
随着越来越多的AAB被发现,AAB种属命名、名称变更以及种属特征的描述等带来了很大的挑战。在以下的内容中将主要叙述AAB命名原则、AAB种属名称演变以及AAB的种属特征。
2.1 AAB命名原则
AAB的命名原则与其他微生物的命名原则基本相同,属名主要是根据AAB特性或某位杰出科学家的姓氏来命名。如糖杆菌属(Saccharibacter)因具有耐高浓度糖(Saccharon=sugar)的能力且为杆状(bacter=baktron=rod)而得名;塔堤查仁杆菌属(Tanticharoenia)以泰国微生物学家Morakot Tanticharoen的姓氏命名。而AAB种名则主要是根据菌落颜色、菌体形态、菌种特性、分离样品来源、采样地名称、菌株分离与命名者或者某位杰出科学家的姓氏等来命名。以采样地名称命名时,一般用采样地城市或国家名后+后缀“ensis”作为种名,如芝庇侬醋酸杆菌(A.cibinongensis)由芝比侬(Cibinong,位于印尼爪哇岛西部的一座城市)+后缀(ensis)组成;加纳醋酸杆菌(A.ghanensis)由加纳(Ghana,位于非洲西部的一个国家)+后缀(ensis)组成;冲绳醋酸杆菌(A.okinawensis)由冲绳(Okinawa,位于日本九州岛和中国台湾省之间,旧称琉球)+后缀(ensis)组成。以分离样品命名时,一般是直接引用或适当修改样品名称来命名,如啤酒醋酸杆菌(A.cerevisiae)表明该AAB分离自啤酒(cerevisiae);古坟葡糖醋杆菌(Ga.aggeris)表明该AAB分离自古坟(aggeris=mound);蒲桃醋酸杆菌(A.syzygii)表明该AAB分离自蒲桃属(Syzygium)的植物。以AAB特性命名时,一般是以AAB特性或特性的缩写组合来命名,如白葡糖杆菌(G.albidus)表明该AAB菌落为白色(albidus=white);球形葡糖杆菌(G.sphaericus)表明该AAB菌体为球形(spherical);固氮葡糖醋杆菌(Ga.azotocaptans)的种名由氮(azotum=nitrogen)+固定(captans=catching)组成,表明该菌具有固定氮气的能力(特征)。以微生物学家姓氏命名时,一般是为纪念在AAB研究领域作出了具大贡献的微生物家,以其姓氏为主体并作适当修改来命名,如内村葡糖杆菌(G.uchimurae)为纪念日本微生物学家Tai Uchimura(主要从事AAB的系统研究,尤其是朝井杆菌、醋酸杆菌、葡糖杆菌和葡糖醋酸杆菌菌株),以其姓氏内村(Uchimura)进行命名;婉贞葡糖杆菌(G.wancherniae)为纪念泰国微生物学家Wanchern Potacharoen(主要从事AAB系统学研究);圆谷葡糖醋杆菌(Ga.entanii)为纪念日本微生物学家Etsuzo Entani(最先从事酒精醋中AAB的分离与繁殖方面的研究工作);约翰娜葡糖醋杆菌(Ga.johannae)为纪念巴西微生物学家Johanna Döbereiner(第一个分离到葡糖醋杆菌属中具有固氮功能的AAB)。
2.2 AAB种属名称的演变
根据2005年出版的第九版《伯杰氏系统细菌学手册》第2卷,AAB属于变形杆菌门(Proteobacteria)α-变形菌菌纲(α-Proteobacteria)红螺菌目(Rhodospirillales)醋杆菌科(Acetobacteraceae),记载了6个AAB属,共31个种。图1是第九版《伯杰氏系统细菌学手册》第2卷中,采用最大简值法对收录的葡糖醋杆菌属、酸单胞菌属、朝井杆菌、醋酸杆菌属和葡糖杆菌属的31个AAB构建的进化树。其中,醋酸杆菌属是醋杆菌科的典型属。
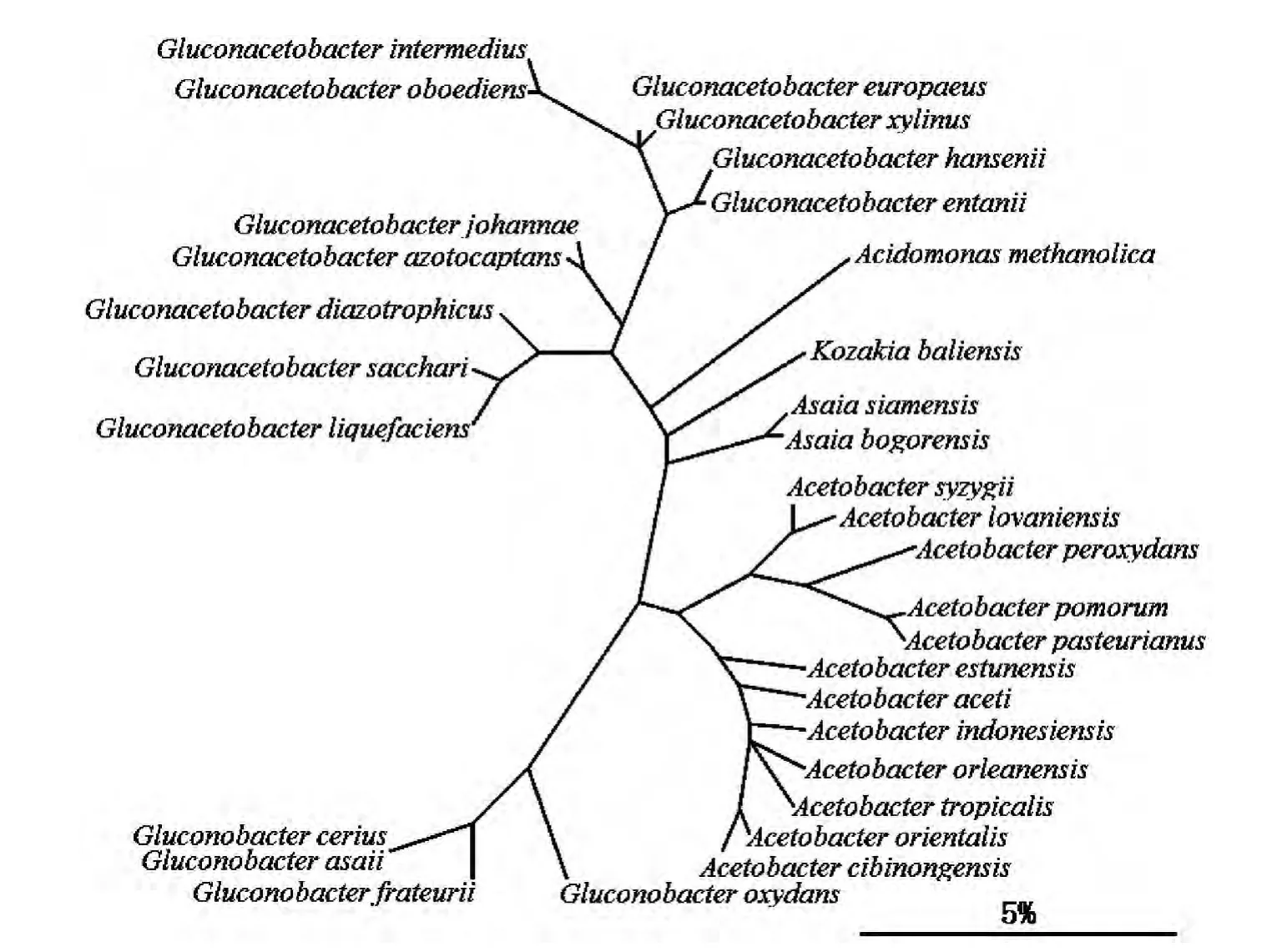
图1 葡糖醋杆菌属、酸单胞菌属、朝井杆菌、醋酸杆菌属和葡糖杆菌属的亲缘关系[29]Fig.1 Relationship between Gluconacetobacter, Acidomonas, Asaia, Acetobacter and Gluconobacter
像其他微生物一样,随着对AAB分类特征的进一步观察和分析,各种新的分类方法和手段的不断引入以及对微生物功能(作用)的拓展与再认识,它们的分类地位和种属名称一直在变化之中。如前所述,AAB的分类方法,经历了由以形态特征为主,到辅以化学成分特征与遗传特征,再到三种分类方法相结合的发展,而对AAB功能的认识也从原来认为AAB可以分泌醋酸等有机酸到有些AAB具有产生纤维素和固氮等能力。此外,AAB的辅酶Q(ubiquinone,UQ)与菌体脂肪酸组成特性被用作其分类依据之一,也都推动了其分类地位与种属名称的变化。下面将通过对AAB中一些重要的种属分类地位和名称变化进行概述。
在AAB的表型分类学方面,自从1898年第一个AAB属,醋酸杆菌属提出后,研究发现,该属中的有些AAB不但可以分别利用葡萄糖和酒精产生葡萄糖酸和醋酸,还可以进一步以醋酸(盐)作为碳源,将其分解成CO2并产生能量;而另外一些AAB对酒精的利用能力很弱,或者不能利用酒精作为碳源。依据这些特点,1935年,ASAI T[30]将醋酸杆菌属中氧化酒精能力弱,且不能氧化醋酸(盐)的AAB归属为另一个AAB属——葡糖杆菌属;1954年LEIFSON E[31]根据醋酸杆菌属中AAB菌体的鞭毛着生情况和对醋酸盐氧化能力,建议将极生鞭毛且不氧化醋酸盐的AAB独立为一个新属——“醋单胞菌属(Acetomonas)”。由于葡糖杆菌属和“醋单胞菌属”的特征极为相似,所以1961年,DE LEY J[32]通过进一步研究,明确了葡糖杆菌属为第二个AAB属,并确立了氧化葡糖杆菌(G.oxydans)为该属典型种的地位,从此,“醋单胞菌属”逐渐停止了使用。
众所周知,由于形态分类方法依据的菌落特征、菌体形态等特征不稳定,容易受到培养基组成和培养条件变化等的影响,所以辅酶Q类型和细菌膜脂肪酸组成等作为形态分类的辅助手段被广泛用于AAB的分类中。辅酶Q是一种广泛存在于微生物细胞膜中的脂溶性醌类化合物,其结构与维生素K、维生素E与质体醌相似,参与呼吸系统的电子传递。AAB的辅酶Q主要包括Q-9和Q-10两种类型(Q-9的侧链含有9个异戊二烯单元,Q-10的侧链含有10个异戊二烯单元)[33]。1968年和1981年,YAMADA Y等[34-35]先后探讨了AAB中辅酶Q类型和脂肪酸组成特点,发现它们在不同的AAB中存在较大差异,可以用来对AAB进行分类,所以1983年,YAMADA Y等[36]将辅酶Q-10的醋化醋酸杆菌木醋杆菌亚种(A.acetisubsp.xylinum)提升为木醋酸杆菌(A.xylinum);1985年,YAMADA Y等[33]又将醋酸杆菌属中Q-10型的AAB归入醋酸杆菌属葡糖酸醋酸杆菌亚属(Acetobacter(subgen.Gluconoacetobacter)),这样醋酸杆菌属就形成了分别具有辅酶Q-9和Q-10的两类AAB。1989年,URAKAMI T等[34]通过分析醋酸杆菌属中AAB和嗜酸菌属(Acidiphilium)菌株的形态学特征、生理生化特征、辅酶Q的类型以及脂肪酸组成,将其中具有甲醇氧化能力的AAB独立为一个新属——酸单胞菌属(Acidomonas,Ac.),并提出了甲醇酸单孢菌种(Ac.methanolica)[32]。但是,葡糖酸醋酸杆菌亚属和酸单胞菌属的分类地位曾一度受到质疑,直到1997年,YAMADA Y等[57]通过16S rRNA序列分析确定了酸单胞菌属的分类地位,所以至1989年,醋酸杆菌属、葡糖杆菌属和酸单胞菌属,共3个AAB属被提出。
随着分子生物学方法的快速发展,遗传学信息逐渐成为AAB分类的重要参考依据。1994年,SIEVERS M等[37]基于16S核糖体DNA序列信息对醋杆菌科(Acetobacteraceae)的四个属:醋酸杆菌属、葡糖杆菌属、红球状菌属和嗜酸菌属的系统发育进行了研究,发现醋酸杆菌属和葡糖杆菌属是变形菌门(Proteobacteria)α-亚门中一个独立分支。1997年,YAMADA Y等[57]基于16S rRNA的序列信息,将葡糖酸醋酸杆菌亚属提升为葡糖酸醋酸杆菌属(Gluconoace tobacter),并以液化葡糖酸醋酸杆菌(Gluconoacetobacter liquefaciens)为典型菌株。同年,根据国际细菌命名法规,Gluconoacetobacter被正式更名为Gluconacetobacter(Ga.),并沿用至今。自此,基于形态、化学和遗传学特征相结合的AAB分类方法被普遍采用。随后,朝井杆菌属(Asaia,As.)[38]、公崎杆菌属(Kozakia,Ka.)[39]、斯瓦米纳坦杆菌属(Swaminathania,Sw.)[8]、糖杆菌属(Saccharibacter,S.)[4]、新朝井杆菌属(Neoasaia,N.)[40]、颗粒杆菌属(Granulibacter,Gr.)[41]和塔堤查仁杆菌属(Tanticharoenia,T.)[42]等新的AAB属先后被提出。
从21世纪初开始,为了明确AAB的系统进化关系,一些统计学方法结合数据处理软件也开始应用于AAB的分类,形成了基于邻接法(neighbor-joining method)、最大简约法(maximum parsimony)和最大似然估计(maximum likeli hood method)构建系统树的AAB分类方法[43]。YUKPHAN P等[43]采用这三种方法,基于AAB的16S rRNA序列分析建立其系统树,再结合生理生化特性,发现从泰国清迈红姜花朵中分离到AAB菌株不同于已报道的AAB属,于是提出了一个新AAB属—雨山杆菌属(Ameyamaea,Am.)。2011年,YUKPHAN P等[44]又对从泰国马樱丹和翅荚决明的花中分离的AAB进行了鉴定,根据细胞膜脂肪酸组成分析和系统树分析结果,提出了另外一个AAB新属——新驹形杆菌属(Neokomagataea,Ne.)。目前,基于形态与化学特征,结合邻接法、最大简约法、最大似然估计等遗传进化分析结果的AAB分类方法被普遍采用。YAMADA Y等[45]根据此分类方法,从葡糖醋杆菌属中分离出驹形杆菌属(Komagataeibacter,K.),并以木驹形杆菌(K.xylinus)为典型种。阮杆菌属(Nguyenibacter,Ng.)[46]和斯温斯杆菌属(Swingsia,Sw.)[47]也是在此分类学方法下被发现的。2014年初,YAMADA Y[66]又根据此分类法将曾归类到葡糖醋杆菌属的3个AAB(Ga.kakiaceti,Ga.medellinesis和Ga.maltaceti)重新归类于驹形杆菌属,命名为柿醋驹形杆菌(K.kakiaceti)、麦德林驹形杆菌(K.medellinesis)和麦芽醋驹形杆菌(K.maltaceti)。至2014年初,已报道的AAB包括16个属,共84种(见表2)。

表2 AAB的种属分类Table 2 Species and genus classification of AAB
下面将就这些AAB属及其代表性种的主要特征和用途进行归纳和分析。考虑到篇幅的限制,关于AAB各属典型菌种的生理生化特征、辅酶Q类型、细胞脂肪酸组成以及DNA的G+C摩尔百分含量等更多具体信息可参考其中的相关文献。
2.3 AAB的种属特征
2.3.1 醋酸杆菌属(Acetobacter,A.)
醋酸杆菌因能产醋(aceti)且为杆菌(bacter=baktron=rod)而得名。醋酸杆菌属菌株不能运动,能氧化乙酸盐和乳酸盐,能氧化乙醇产乙酸,泛醌为Q-9型,其典型菌种为醋化醋酸杆菌(A.aceti)。醋化醋酸杆菌可能是正式报道发现的第一个AAB属,广泛用于食醋的生产。醋化醋酸杆菌的应用研究主要包括食醋的液态发酵工艺条件优化[48]、固定化细胞生产食醋[49]和两步法生产纤维素[50]。此外,醋化醋酸杆菌的耐酸机制方面,包括质子泵、ABC盒转运蛋白、应激蛋白、特殊三羧酸循环、顺乌头酸酶和柠檬酸合成酶也有大量的研究报道[51]。
2.3.2 酸单胞菌属(Acidomonas,Ac.)
酸单孢菌属因其嗜酸(acid)且为单细胞(monas=monad)生长而得名。酸单胞菌属菌株不产芽胞,圆头杆状,主要以单个存在,很少成对出现,不能运动,能氧化酒精生产醋酸,能在pH 2.0~5.5条件下生长,辅酶Q为Q-10型,DNA的G+C含量为64.4%。该属典型菌种为甲醇酸单胞菌(Ac.methanolica)。甲醇酸单胞菌是酸单胞菌属唯一的种,能同化甲醇,其典型菌株TK 0705(=IMET 10945T)分离自酵母发酵淤泥[34]。
2.3.3 雨山杆菌属(Ameyamaea,Am.)
雨山杆菌属以日本山口大学Minoru Ameyama教授的姓氏命名。该属菌体呈杆状,极生鞭毛,能运动,能氧化酒精生产食醋,氧化醋酸盐能力强而氧化乳酸盐能力较弱,能在含0.35%乙酸的培养基上生长,辅酶Q为Q-10型,DNA的G+C含量为66.0%~66.1%。典型菌种清迈雨山杆菌(Am.chiangmaiensis),以菌株分类地泰国清迈(Chiang Mai)命名,典型菌株AC04T(=BCC 15744T=NBRC 103196T)分离自泰国红姜的花朵[43]。
2.3.4 朝井杆菌属(Asaia,As.)
朝井杆菌属以日本细菌学家Toshinobu Asai的姓氏命名。该属菌株呈杆状,周生鞭毛,能运动,能氧化乙酸盐和乳酸盐,不能氧化酒精生产食醋,泛醌为Q-10型,DNA的G+C含量为59.3%~61.0%,该属的典型菌种为茂物朝井杆菌(As.bogorensis)。茂物朝井杆菌典型菌株为71T(=JCM 10569T=NRIC 9311T),分离自印度尼西亚的紫荆花,不能或极微弱的氧化酒精产醋酸,不能在含0.35%醋酸的培养基上生长[38]。
朝井杆菌属菌株主要分离自植物的花朵,普遍耐渗透压但不能产酸。该属的一些菌株为昆虫的共生菌,也是引起饮料腐败的主要微生物,茂物朝井杆菌(As.bogorensis)和兰那朝井杆菌(As.lannaensis)也可能是人类的条件致病菌[5,38,52]。朝井杆菌也具有一些潜在的应用价值,如用于粘附剂[53]和虐疾控制[54],生物固氮[55]和产生超细纤维素[56]。
2.3.5 葡糖杆菌属(Gluconobacter,G.)[30]
葡糖杆菌因能氧化葡萄糖(glucose)且为杆菌(bacter)而得名。葡糖杆菌属菌株具有极生鞭毛,能运动,能氧化酒精产乙酸,但不能氧化乙酸盐和乳酸盐,泛醌为Q-10型,该属典型菌种为氧化葡糖杆菌(G.oxydans)。氧化葡糖杆菌也是最早被发现的AAB之一,其相关研究很多,主要包括三个方面:生化产品生产、酶学研究和传感器开发。在生物产品生产方面,应用氧化葡糖杆菌可以生产2,5-二酮葡萄糖酸、2-酮-L-葡萄糖酸盐、抗坏血酸、D-葡萄糖酸、山梨酮糖和半乳糖酸等;酶学研究包括葡萄糖脱氢酶、葡萄糖酸脱氢酶、2-酮葡萄糖酸脱氢酶、山梨酮糖脱氢酶和乙醛脱氢酶等;传感器开发包括用氧化葡糖杆菌纯化的酶用于酒精、糖、乳糖和木糖的快速检测[24]。
2.3.6 葡糖醋杆菌属(Gluconacetobacter,Ga.)[57]
葡糖醋杆菌因能氧化葡糖酸盐(gluconate)和醋酸盐(acetate)且为杆菌(bacter)而得名。葡糖醋杆菌属菌株具有周生鞭毛,能运动,能氧化酒精产醋,辅酶Q为Q-10型,DNA的G+C百分含量为64.4%。该属典型菌种为液化葡糖醋杆菌(Ga.liquefaciens),它引起菠萝发生红肉病的病原菌[58],也可以用来降解甲基红[59]和生产2-酮-古洛糖酸[60]。液化葡糖醋杆菌曾被归属于醋化醋杆菌亚种(A.aceti subsp.liquefaciens)(Asai 1935)。1983年,YAMADA Y[69]将其提升为种,命名为液化醋杆菌(A.liquefaciens)。1997年,YAMADA Y等[57]基于16S rRNA序列分析,将液化醋杆菌(A.liquefaciens)更名为液化葡糖醋杆菌(Ga.liquefaciens)。
该属的相关种研究较多,并具有多种功能。例如,古坟葡糖醋杆菌(Ga.aggeris)、固氮葡糖醋杆菌(Ga.azotocaptans)、固氮葡糖醋杆菌(Ga.diazotrophicus)、约翰娜葡糖醋杆菌(Ga.johannae)和高松冢葡糖醋杆(Ga.takamatsuzukensis)具有固氮作用[11,61];柿子葡糖醋杆菌(Ga.persimmonis)能生产纤维素[27];约翰娜葡糖醋杆菌(Ga.johannae)、液化葡糖醋杆菌(Ga.liquefaciens)、甘蔗葡糖醋杆菌(Ga.sacchari)和古墓土壤葡糖醋杆菌(Ga.tumulisoli)能生产水溶性棕色素[11,62-63];圆谷葡糖醋杆菌(Ga.entanii)能耐受较高浓度乙醇和乙酸[64];固氮葡糖醋杆菌(Ga.azotocaptans)、固重氮葡糖醋杆菌(Ga.diazotrophicus)、约翰娜葡糖醋杆菌(Ga.johannae)和甘蔗葡糖醋杆菌(Ga.sacchari)能耐受较高浓度葡萄糖[7,28,62]。
2.3.7 颗粒杆菌属(Granulibacter,Gr.)
颗粒杆菌因产生粒斑或肉芽肿(肉芽肿病患者临床特征和淋巴结切片均为颗粒状)而得名。该属菌体呈球杆状,不能运动,菌体为球状或杆状,可生产黄色素,能氧化醋酸盐和乳酸盐,能氧化酒精产醋酸,适合在含较高浓度葡萄糖的培养基中生长,辅酶Q为Q-10型,DNA的G+C含量为59.1%。该属典型菌种为贝塞斯达颗粒杆菌(Gr.bethesdensis),以菌株分离地美国贝塞斯达(Bethesda)命名,典型菌株CGDNIH1T(=ATCC BAA-1260T=DSM 17861T)分离自患有慢性肉芽肿病病人的淋巴结,被视为条件致病菌[41]。
2.3.8 驹形杆菌属(Komagataeibacter,K.)
以日本微生物学家Kazuo Komagata的姓氏命名。[45]菌体不能运动,能氧化醋酸盐和乳酸盐,能化酒精产醋酸,典型菌种木驹形杆菌(K.xylinus),是最早发现能产纤维素的AAB,所以相关研究非常透彻[63]。
驹形杆菌属主要是由葡糖醋杆菌属分化出来的。早在1999年,FRANKE I H等[62]发现葡糖醋杆菌属系统树中存在二象性,2000年,YAMADA Y等[67]将葡糖醋杆菌属分成两个子集。之后也陆续有报道称发现此现象,YAMADA Y等[3]报道称Ga.liquefaciens(葡糖醋杆菌属的典型种)和Ga.xylinus在表型特征、遗传学特征和生态学特征上存在属级的差异。直到2012年,YAMADA Y等[68]提出由葡糖醋杆菌属的12个种组成新AAB属——驹形杆菌属,但是根据《细菌学代码》27条规则,该属典型菌株存在争议,同年,YAMADA Y等[45]再一次提出此属,并将该属详细信息进行了总结。
该属AAB除包括可以产纤维素的木驹形杆菌(K.xylinus)、莱蒂亚驹形杆菌(K.rhaeticus)、斯温驹形杆菌(K.swingsii)、蔗糖驹形杆菌(K.sucrofermentans)、柿醋驹形杆菌(K.kakiaceti)、麦德林驹形杆菌(K.medellinensis)和hansenii(K.hansenii)种外,还包括高耐酸(醇)的欧洲驹形杆菌(K.europaeus)、中间驹形杆菌(K.intermedius)、温驯驹形杆菌(K.oboediens)、麦芽醋驹形杆菌(K、maltaceti)(较弱)。
2.3.9 公崎杆菌属(Kozakia,Ka.)
公崎杆菌属以日本微生物学家Michio Kozaki的姓名命名的。该属菌株为杆状,不能运动,能利用蔗糖或D-果糖生产类似果聚糖的黏性物质,能氧化醋酸盐和乳酸盐,能利用酒精生产食醋,辅酶Q为Q-10型,DNA的G+C含量为56.8%~57.2%。巴厘岛公崎杆菌(Ka.baliensis)是该属的典型菌种,也是唯一的种。它以采样地印度尼西亚巴厘岛(Bali)命名,其典型菌株Yo-3T(=IFO 16664T=JCM 11301T=DSM 14400T)分离自巴厘岛的红糖中[39]。
2.3.10 新朝井杆菌属(Neoasaia,N.)
以日本微生物学家Toshinobu Asai的姓氏命名(Neoasaia=new Asaia)。该属菌落为粉红色,能氧化酒精产醋酸,能氧化醋酸盐和乳酸盐,辅酶Q为Q-10型,DNA的G+C含量为63.1%。访属典型菌种为清迈新朝井杆菌(N.chiangmaiensis),以菌株分离地泰国清迈(Chiang Mai)命名,典型菌株AC28T(=BCC 15763T=NBRC 101099T)分自离泰国红姜的花朵[40]。
2.3.11 新驹形杆菌属(Neokomagataea,Ne.)
以日本微生物学家Kazuo Komagata的姓氏命名。菌体呈杆状,不能运动,氧化酒精产醋酸能力较弱,不能氧化醋酸盐和乳醋盐,能在含30%(w/v)葡萄糖的培养基上生长,但不能在含0.35%(w/v)醋酸的培养基上生长,辅酶Q为Q-10型,DNA的G+C含量为51.2%~56.8%。该属包括泰国新驹形杆菌(Ne.thailandica)和谭岛新驹形杆菌(Ne.tanensis),均以菌种分离地命名。前者能氧化蜜二糖和蜜三糖产生有机酸,而后者不能。两者的典型菌株分别是AH11T(=BCC 25710T=NBRC 106555T)和AH13T(=BCC 25711T=NBRC 106556T),均分离自泰国的花朵[44]。
2.3.12 阮杆菌属(Nguyenibacter,Ng.)
以越南微生物学家Dung Lan Nguyen的姓氏命名。菌体呈杆状,周生鞭毛,能运动,能氧化醋酸盐但不能氧化乳酸盐,不能氧化酒精产食醋,在含30%葡萄糖或0.35%乙酸的培养基上弱生长,能生产水溶性棕色素,有固氮能力,可在不含氮源的LGI培养基上生长,辅酶Q为Q-10型,DNA的G+C含量为68.1%~69.4%。典型菌种为安南阮杆菌(Ng.vanlangensis),以菌种分离地越南(Vietnam,旧称Vanlang)命名,典型菌株TN01LGIT(=BCC 54744T=NBRC 109046T)分离自越南水稻根部[65]。
2.3.13 糖杆菌属(Saccharibacter,S.)
糖杆菌属因其具有耐高浓度糖的能力而得名。该属菌体为直杆状,不能运动,能在含2%~40%(w/v)糖类的培养基中生长,利用酒精生产乙酸的能力极弱,不能氧化醋酸盐,辅酶Q为Q-10型,DNA的G+C含量为52%~53%,该属典型菌种为花糖杆菌(S.floricola),典型菌株为S-877T(=AJ 13480T=JCM 12116T=DSM 15669T)分离自日本神奈川县的樱花花粉[4]。
2.3.14 斯瓦米纳坦杆菌属(Swaminathania,Sw.)
斯瓦米纳坦杆菌属以印度生物学家Swaminathan的姓名命名。该属菌体呈圆头杆状,周生鞭毛,能运动,能氧化酒精产醋酸,能氧化醋酸盐和乳酸盐,能生产水溶性棕色素,能固氮和同化水溶性磷酸盐,辅酶Q为Q-10型,DNA的G+C含量为57.6%~59.9%。典型菌种为耐盐斯瓦米纳坦杆菌(Sa.salitolerans),其典型菌株PA51T(=LMG 21291T=MTCC3853T)分离自印度野生水稻根系[8]。
2.3.15 斯温斯杆菌属(Swingsia,Si.)
以比利时根特大学微生物学家Jean Swings的姓氏命名。该属菌体不能运动,能利用酒精生产食醋,不能氧化醋酸盐或乳酸盐,能在含30%(w/v)葡萄糖的培养基上生长,但不能耐受0.35%(w/v)醋酸,能生产水溶性棕色素,辅酶Q为Q-10型,DNA的G+C含量为46.9%~47.3%。苏梅斯温斯杆菌(Si.samuiensis)是其唯一的种,典型菌株AH83T(=BCC 25779T=NBRC 107927T),种名因菌株分离地泰国他尼府苏梅岛(Samui island)而得名[47]。
2.3.16 塔堤查仁杆菌属(Tanticharoenia,T.)
以泰国微生物学家Morakot Tanticharoen的姓氏命名。该属菌体呈杆状,能氧化酒精生产食醋,能生产水溶性棕色素,不能运动,不能氧化乙酸盐或乳酸盐,可以在含30%(w/v)葡萄糖的培养基中生长,耐渗透压的能力较强,但仅能耐受0.35%的乙酸,辅酶Q为Q-10型,DNA的G+C含量为64.5%~65.6%。典型菌种为萨克塔塔堤查仁杆菌(T.sakaeratensis),以菌种分离地泰国呵叻府萨克塔(Sakaerat)命名,典型菌株为NBRC 103193T(=BCC 15772T=NBRC 103193T)分离自泰国土壤[42]。
3 总结与展望
AAB是革兰氏阴性细菌,主要分离自发酵食品、植物器官、动物器官和土壤。分离时,可将AAB分为三类:普通AAB、耐酸(醇)AAB和固氮AAB。不同类型AAB的分离培养基和分离方法有所不同。随着分子生物技术的发展,目前AAB的鉴定和分类主要是结合表观特征(形态学特征和营养代谢)、化学成分特征(辅酶Q类型和细胞膜脂肪酸组成)和遗传学特征(基于NJ、MP和ML分析16S rRNA序列)三方面信息来进行。自1898年,BEIJERINCK M[2]定义了第一个AAB属以来,截至2014年初,已报道的AAB有16个属,共84种。像其他微生物一样,AAB的种属分类一直在变化,而且会一直变化下去。一百多年以来,随着AAB鉴定和分类方法的发展,AAB种属分类了发生了重大的转变,一方面,不断有新属和新种陆续被发现;另一方面,一些AAB被重新归类。AAB最初因具有产酸能力而得名,但近年来研究发现:有些AAB并不具有产酸能力,而有些AAB除了产生醋酸外,还具有很多其它功能,如产生纤维素、色素、吲哚乙酸、抗坏血酸和固氮等,正是这些功能和特性促进了AAB研究的发展。目前,AAB生产纤维素和固氮研究较为透彻,技术也渐趋成熟。AAB属各具特色,包括耐渗透压AAB、耐酸(醇)AAB、固氮AAB、产纤维素AAB等等。AAB的特性(如耐酸、耐醇、耐渗透压和耐热性)和功能(如固氮以及生产纤维素、吲哚乙酸、抗坏血酸和水溶性色素)已成为AAB的研究热门。
[1]MATSUSHITA K,INOUE T,ADACHI O,et al.Acetobacter acetipossesses a proton motive force-dependent efflux system for acetic acid [J].J Bacteriol,2005,187(13):4346-4352.
[2]BEIJERINCK M.Ueber die arten der essigbakterien[J].Centralblatt für Bakteriologie,Parasitenkunde und Infektionskrankheiten,1898,2(4):209-216.
[3]YAMADA Y,YUKPHAN P.Genera and species in acetic acid bacteria[J].Int J Food Microbiol,2008,125(1):15-24.
[4]JOJIMA Y,MIHARA Y,SUZUKI S,et al.Saccharibacter floricolagen.nov.,sp.nov.,a novel osmophilic acetic acid bacterium isolated from pollen[J].Int J Syst Evol Micr,2004,54(6):2263-2267.
[5]MOORE J E,MCCALMONT M,XU J,et al.Asaiasp.,an unusual spoilage organism of fruit-flavored bottled water[J].Appl Environ Microbiol,2002,68(8):4130-4131.
[6]BASTIÁN F,COHEN A,PICCOLI P,et al.Production of indole-3-acetic acid and gibberellins A1and A3byAcetobacter diazotrophicusandHerbaspirillum seropedicaein chemically-defined culture media[J].J Plant Growth Regul,1998,24(1):7-11.
[7]FUENTES-RAMÁREZ L E,BUSTILLOS-CRISTALES R,TAPIAHERNÁNDEZ A,et al.Novel nitrogen-fixing acetic acid bacteria,Gluconacetobacter johannaesp.nov.andGluconacetobacter azotocaptanssp.nov.,associated with coffee plants[J].Int J Syst Evol Micr,2001,51(4):1305-1314.
[8]LOGANATHAN P,NAIR S.Swaminathania salitoleransgen.nov.,sp.nov.,a salt-tolerant,nitrogen-fixing and phosphate-solubilizing bacterium from wild rice(Porteresia coarctataTateoka)[J].Int J Syst Evol Micr,2004,54(4):1185-1190.
[9]NGUYEN V T,FLANAGAN B,GIDLEY M J,et al.Characterization of cellulose production by aGluconacetobacter xylinusstrain from Kombucha[J].Curr Microbiol,2008,57(5):449-453.
[10]REWATKAR A R.Microbial production of L-ascorbic acid from sorbitol[J].Biotechnol Resour,2010,3:268-274.
[11]ENTANI E,OHMORI S,MASAI H,et al.Acetobacter polyoxogenessp.nov.,a new species of an accetic acid bacterium useful for producing vinegar with high acidity[J].J Gen Appl Microbiol,1985,31(5):475-490.
[12]YAMADA Y,HOSONO R,LISDYANTI P,et al.Identification of acetic acid bacteria isolated from Indonesian sources,especially of isolates classified in the genusGluconobacter[J].J Gen Appl Microbiol,1999,45(1):23-28.
[13]SCHULLER G,HERTEL C,HAMMES W P.Gluconacetobacter entaniisp.Nov.,isolated from submerged high-acid industrial binegar fermentations[J].Int J Syst Evol Micr,2000,50:2013-2020.
[14]DUTTA D,GACHHUI R.Nitrogen-fixing and cellulose-producingGluconacetobacter kombuchaesp.nov.,isolated from Kombucha tea[J].Int J Syst Evol Micr,2007,57(2):353-357.
[15]GILLIS M,DE LEY J.Intra-and intergeneric similarities of the ribosomal ribonucleic acid cistrons ofAcetobacterandGluconobacter[J].Int J Syst Bacterio,1980,30(1):7-27.
[16]POBLET M,ROZÈS N,GUILLAMÓN J M,et al.Identification of acetic acid bacteria by restriction fragment length polymorphism analysis of a PCR-amplified fragment of the gene coding for 16S rRNA[J].Lett Appl Microbiol,2000,31(1):63-67.
[17]TRCEK J.Quick identification of acetic acid bacteria based on nucleotide sequences of the 16S-23S rDNA internal transcribed spacer region and of the PQQ-dependent alcohol dehydrogenase gene[J].Syst Appl Microbiol,2005,28(8):735-745.
[18]DE VERO L,GALA E,GULLO M,et al.Application of denaturing gradient gel electrophoresis(DGGE)analysis to evaluate acetic acid bacteria in traditional balsamic vinegar[J].Food Microbiol,2006,23(8):809-813.
[19]GULLO M,CAGGIA C,DE VERO L,et al.Characterization of acetic acid bacteria in“traditional balsamic vinegar”[J].Int J Food Microbiol,2006,106(2):209-212.
[20]DE VUYST L,CAMU N,DE WINTER T,et al.Validation of the(GTG)5-rep-PCR fingerprinting technique for rapid classification and identification of acetic acid bacteria,with a focus on isolates from Ghanaian fermented cocoa beans[J].Int J Food Microbiol,2008,125(1):79-90.
[21]TORIJA M J,MATEO E,GUILLAMÓN J M,et al.Identification and quantification of acetic acid bacteria in wine and vinegar by TaqMan-MGB probes[J].Food Microbiol,2010,27(2):257-265.
[22]SOKOLLEK S J,HERTEL C,HAMMES W P.Cultivation and preservation of vinegar bacteria[J].J Biotechnol,1998,60(3):195-206.
[23]AZUMA Y,HOSOYAMA A,MATSUTANI M,et al.Whole-genome analyses reveal genetic instability ofAcetobacter pasteurianus[J].Nucleic Acids Res,2009,37(17):5768-5783.
[24]GUPTA A,SINGH V K,QAZI G,et al.Gluconobacter oxydans:its biotechnological applications[J].J Mol Microb Biotechnol,2001,3(3):445-456.
[25]HESTRIN S,ASCHNER M,MAGER J.Synthesis of cellulose by resting cells ofAcetobacter xylinum[J].Nature,1947,159(4028):64-65.
[26]CASTRO C,ZULUAGA R,ÁLVAREZ C,et al.Bacterial cellulose produced by a new acid-resistant strain ofGluconacetobactergenus[J].Carbohyd Polym,2012,89(4):1033-1037.
[27]HUNGUND B S,GUPTA S.Improved production of bacterial cellulose fromGluconacetobacter persimmonisGH-2[J].J Microbial Biochem Technol,2010,2(5):127-133.
[28]IINO T,SUZUKI R,TANAKA N,et al.Gluconacetobacter kakiacetisp.nov.,an acetic acid bacterium isolated from a traditional Japanese fruit vinegar[J].Int J Syst Evol Micr,2012,62(7):1465-1469.
[29]SIEVERS M,SWINGS J.Family II.Acetobacteraceae[M].2th edition.New York:Springer,2005.
[30]ASAI T.Taxonomic studies on acetic acid bacteria and allied oxidative bacteria isolated from fruits:a new classification of the oxidative bacteria[J].J Agr Chem Soc Jpn,1935,11(1):674-708.
[31]LEIFSON E.The flagellation and taxonomy of species ofAcetobacter[J].Anton Leeuw,1954,20(1):102-110.
[32]DE LEY J.Comparative carbohydrate metabolism and a proposal for a phylogenetic relationship of the acetic acid bacteria[J].Microbiology,1961,24(1):31-50.
[33]YAMADA Y.Gluconoacetobacter,a new subgenus comprising the acetate-oxidizing acetic acid bacteria with ubiquinone-10 in the genusAcetobacter[J].J Gen Appl Microbiol,1984,30(4):297-303.
[34]URAKAMI T,TAMAOKA J,SUZUKI K I,et al.Acidomonasgen.nov.,IncorporatingAcetobacter methanolicusasAcidomonas methanolicacomb.nov[J].Int J Syst Bacteriol,1989,39(1):50-55.
[35]YAMADA Y,NUNODA M,ISHIKAWA T,et al.The cellular fatty acid composition in acetic acid bacteria[J].J Gen Appl Microbiol,1981,27(5):405-417.
[36]YAMADA Y.Acetobacter xylinussp.nov.,nom.rev.,for the celluloseforming and cellulose-less,acetate-oxidizing acetic acid bacteria with the Q-10 system[J].J Gen Appl Microbiol,1983,29(5):417-420.
[37]SIEVERS M,LUDWIG W,TEUBER M.Phylogenetic positioning ofAcetobacter,Gluconobacter,RhodopilaandAcidiphiliumspecies as a branch of acidophilic bacteria in the α-subclass ofProteobacteriabased on 16S ribosomal DNA sequences[J].Syst Appl Microbiol,1994,17(2):189-196.
[38]YAMADA Y,KATSURA K,KAWASAKI H,et al.Asaia bogorensisgen.nov.,sp.nov.,an unusual acetic acid bacterium in the alpha-Proteobacteria[J].Int J Syst Evol Micr,2000,50(2):823-829.
[39]LISDIYANTI P,KAWASAKI H,WIDYASTUTI Y,et al.Kozakia baliensisgen.nov.,sp.nov.,a novel acetic acid bacterium in the alpha-proteobacteria[J].Int J Syst Evol Micr,2002,52(3):813-818.
[40]YUKPHAN P,MALIMAS T,POTACHAROEN W,et al.Neoasaia chiangmaiensisgen.nov.,sp.nov.,a novel osmotolerant acetic acid bacterium in the alpha-Proteobacteria[J].J Gen Appl Microbiol,2005,51(5):301-311.
[41]GREENBERG D E,PORCELLA S F,STOCK F,et al.Granulibacter bethesdensisgen.nov.,sp.nov.,a distinctive pathogenic acetic acid bacterium in the familyAcetobacteraceae[J].Int J Syst Evol Micr,2006,56(11):2609-2616.
[42]YUKPHAN P,MALIMAS T,MURAMATSU Y,et al.Tanticharoenia sakaeratensisgen.nov.,sp.nov.,a new osmotolerant acetic acid bacterium in the alpha-Proteobacteria[J].Biosci Biotech Biochem,2008,72(3):672-676.
[43]YUKPHAN P,MALIMAS T,MURAMATSU Y,et al.Ameyamaea chiangmaiensisgen.nov.,sp.nov.,an acetic acid bacterium in the alpha-Proteobacteria[J].Biosci Biotech Biochem,2009,73(10):2156-2162.
[44]YUKPHAN P,MALIMAS T,MURAMATSU Y,et al.Neokomagataeagen.nov.,with descriptions ofNeokomagataea thailandicasp.nov.andNeokomagataea tanensissp.nov.,osmotolerant acetic acid bacteria of the α-Proteobacteria[J].Biosci Biotech Biochem,2011,75(3):419-426.
[45]YAMADA Y,YUKPHAN P,LAN VU H T,et al.Description ofKomagataeibactergen.nov.,with proposals of new combinations (Acetobacteraceae)[J].J Gen Appl Microbiol,2012,58(5):397-404.
[46]MALIMAS T,CHAIPITAKCHONLATARN W,THI LAN VU H,et al.Swingsia samuiensisgen.nov.,sp.nov.,an osmotolerant acetic acid bacterium in the α-Proteobacteria[J].J Gen Appl Microbiol,2013,59(5):375-384.
[47]NISHIJIMA M,TAZATO N,HANDA Y,et al.Gluconacetobacter tumulisolisp.nov.,Gluconacetobacter takamatsuzukensissp.nov.andGluconacetobacter aggerissp.nov.,isolated from Takamatsuzuka Tumulus samples before and during the dismantling work in 2007[J].Int J Syst Evol Microbiol,2013,63(11):3981-3988.
[48]AWAD H,DIAZ R,MALEK R,et al.Efficient production process for food grade acetic acid byAcetobacter acetiin shake flask and in bioreactor cultures[J].E-Journal of Chemistry,2012,9(4):2275-2286.
[49]LOTONG N,MALAPAN W,BOONGORSRANG A,et al.Production of vinegar byAcetobactercells fixed on a rotating disc reactor[J].Appl Microbiol Biotechnol,1989,32(1):27-31.
[50]OKIYAMA A,SHIRAE H,KANO H,et al.Bacterial cellulose I.Twostage fermentation process for cellulose production byAcetobacter aceti[J].Food Hydrocolloid,1992,6(5):471-477.
[51]NAKANO S,FUKAYA M.Analysis of proteins responsive to acetic acid inAcetobacter:Molecular mechanisms conferring acetic acid resistance in acetic acid bacteria[J].Int J Food Microbiol,2008,125(1):54-59.
[52]KREGIEL D,RYGALA A,LIBUDZISZ Z,et al.Asaia lannensis-the spoilage acetic acid bacteria isolated from strawberry-flavored bottled water in Poland[J].Food Control,2012,26(1):147-150.
[53]KREGIEL D.Attachment ofAsaia lannensisto materials commonly used in beverage industry[J].Food Control,2013,32(2):537-542.
[54]FAVIA G,RICCI I,MARZORATI M,et al.Transgenesis and the management of vector-borne disease[M].New York:Springer,2008.
[55]SAMADDAR N,PAUL A,CHAKRAVORTY S,et al.Nitrogen fixation inAsaiasp.[J].Curr Microbiol,2011,63(2):226-231.
[56]KUMAGAI A,MIZUNO M,KATO N,et al.Ultrafine cellulose fibers produced byAsaia bogorensis,an acetic acid bacterium[J].Biomacromolecules,2011,12(7):2815-2821.
[57]YAMADA Y,HOSHINO K,ISHIKAWA T.The phylogeny of acetic acid bacteria based on the partial sequences of 16S ribosomal RNA:the elevation of the subgenusGluconoacetobacterto the generic level[J].Biosci Biotech Biochem,1997,61(8):1244-1251.
[58]GOSSELÉ F,SWINGS J.Identification ofAcetobacter liquefaciensas causal agent of pink-disease of pineapple fruit[J].J Phytopathol,1986,116(2):167-175.
[59]SO K O,WONG P K,CHAN K Y.Decolorization and biodegradation of methyl red byAcetobacter liquefaciens[J].Environ Toxicol Water Qual,1990,5(3):221-235.
[60]SHINJOH M,SUGISAWA T,MASUDA S,et al.Efficient conversion of l-sorbosone to 2-keto-l-gulonic acid byAcetobacter liquefaciensstrains[J].Journal of Fermentation and Bioengineering,1994,78(6):476-478.
[61]SHRIDHAR B S.Review:nitrogen fixing microorganisms[J].Int J Microbiol Res,2012,3(1):46-52.
[62]FRANKE I H,FEGAN M,HAYWARD C,et al.Description ofGluconacetobacter saccharisp.nov.,a new species of acetic acid bacterium isolated from the leaf sheath of sugar cane and from the pink sugar-cane mealy bug[J].Int J Syst Evol Micr,1999,49(4):1681-1693.
[63]FUENTES-RAMÍREZ L E,BUSTILLOS-CRISTALES R,TAPIAHERNÁNDEZ A,et al.Novel nitrogen-fixing acetic acid bacteria,Gluconacetobacter johannaesp.nov.andGluconacetobacter azotocaptanssp.nov.,associated with coffee plants[J].Int J Syst Evol Micr,2001,51(4):1305-1314.
[64]SCHÜLLER G,HERTEL C,HAMMES W P.Gluconacetobacter entaniisp.nov.,isolated from submerged high-acid industrial vinegar fermentations[J].Int J Syst Evol Micr,2000,50(6):2013-2020.
[65]HI LAN VU H,YUKPHAN P,CHAIPITAKCHONLATARN W,et al.Nguyenibacter vanlangensisgen.nov.,sp.nov.,an unusual acetic acid bacterium in the α-Proteobacteria[J].J Gen Appl Microbiol,2013,59(2):153-166.
[66]YAMADA Y.Transfer ofGluconacetobacter kakiaceti,Gluconacetobacter medellinensisandGluconacetobacter maltacetito the genusKomagataeibacterasKomagataeibacter kakiaceticomb.nov.,Komagataeibacter medellinensiscomb.nov.andKomagataeibacter maltaceticomb.nov.[J].Int J Syst Evol Micr,2014,64(5):1670-1672.
[67]YAMADA Y.Transfer ofAcetobacter oboediensSokollet andAcetobacter intermediusBoesch to the genusGluconacetobacterasGluconacetobacter oboedienscomb.Nov.andGluconacetobacter intermediuscomb.nov[J].Int J Syst Evol Micr,2000,50(6):2225-2227.
[68]YAMADA Y,YUKPHAN P,VU H T L,et al.Subdivision of the genusGluconacetobacterYamada,Hoshino and Ishikawa 1998:the proposal ofKomagatabactergen.nov.,for strains accommodated to theGluconacetobacter xylinusgroup in the α-Proteobacteria[J].Annal Microbiol,2012,62(2):849-859.
[69]YAMADA Y,AKITA M,KODA T,et al.Elevation ofAcetobacter acetisubsp.liquefacienstoAcetobacter liquefacienssp.nov.comprising the peritrichously flagellated intermediate in acetic acid bacteria[J].J Gen Appl Microbiol,1983,29(5):327-333.
