金沙窖酒酒醅中产香酵母分离与鉴定
2014-04-12王晓丹魏燕龙邱树毅
庞 博,王晓丹,魏燕龙,邱树毅*
(1.贵州省发酵工程与生物制药重点实验室,贵州贵阳 550025;2.贵州金沙窖酒酒业有限公司,贵州金沙 551800;3.贵州大学酿酒与食品工程学院,贵州贵阳 550025)
以微生物菌种为核心的发酵工业,其菌种是关键[1],目前的产香酵母主要属于产酯酵母和假丝酵母,是中国白酒中酯香的主要产生菌[2],主要能为不同种类的白酒产酯增香,去除杂味,协调酒体,改善白酒的质量[3],除了在白酒生香中有的广泛应用,也逐渐适用于香料、果汁、食醋的生产加工中,所以具有高产酯能力、各种酯组合优化的产酯产香酵母的选育,是目前酿造行业急需研究且非常有意义的课题[4]。
本实验主要从酱香型大曲酒的大曲和酒醅中分离具有高产酯增香功能的酵母,进行发酵实验并对菌种进行鉴定、保藏,也为利用该菌种进行原生质体融合来选育能够产香的酿酒酵母奠定基础。本研究对该菌种的生物学特性进行了详细的研究,并通过分子生物学手段进行初步鉴定,为后期进一步研究和在白酒中的应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酒醅、大曲:金沙窖酒酒业有限公司。
1.1.2 培养基
(1)分离培养基
孟加拉红琼脂培养基[5]:蛋白胨5 g,葡萄糖10 g,磷酸二氢钾1 g,硫酸镁(MgSO4·7H2O)0.5 g,琼脂20 g,1/3 000孟加拉红溶液100 mL,蒸馏水1 000 mL,氯霉素0.1 g。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[6]:马铃薯汁1 000 mL,葡萄糖20 g,琼脂20 g。
(2)富集培养基
麦芽汁液体培养基:麦芽汁70 mL,pH自然,121 ℃灭菌20 min。
麦芽汁琼脂培养基[7]:麦芽汁150 mL,琼脂3 g,pH 自然,121 ℃灭菌20 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯20 g,葡糖糖2.0 g,琼脂1.5 g,蒸馏水100 mL,pH值自然。
(3)筛选培养基
小麦高粱培养基:小麦∶高粱的质量比为1∶1,其中整粒高粱∶碎粒质量比为3∶1,小麦全部粉碎,搅拌均匀后90 ℃润粮5 h,高温蒸汽,121 ℃灭菌20 min,装瓶。
(4)鉴定培养基
玉米粉琼脂培养基:在60 g 玉米粉中加入少量水调成糊状,再加水至1 000 mL,搅拌均匀后80~90 ℃水浴1.5 h,之后过滤(中间搅拌3~4 次),滤液补加水至1 000 mL,再加琼脂15 g,加热融化,趁热用脱脂棉过滤,分装到试管和三角瓶内,113 ℃灭菌30 min。
麦氏培养基:0.1%葡萄糖,0.18%氯化钾,0.25%酵母膏,0.82%醋酸钠,2%琼脂,以蒸馏水1 000 mL配制,113 ℃灭菌30 min。
豆芽汁培养基:10%豆芽汁、0.5%葡萄糖,蒸馏水100 mL调配,pH 值自然。
酵母膏胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:2%葡萄糖、2%蛋白胨、1%酵母浸膏、2%琼脂、蒸馏水100 mL配制。
尿素培养基[8]:蛋白胨0.1 g、氯化钠0.5 g、磷酸二氢钾0.2 g、尿素0.2 g、葡萄糖0.01 g、蒸馏水100 mL、酚红(0.2%)0.4 mL、琼脂2%,调pH至7.2 后过滤,121 ℃高压灭菌30 min。
1.1.3 主要试剂
EXTaq酶、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)、10×PCR Buffer:宝生物工程(大连)有限公司;内转录间隔区(internal transcribed spacers,ITS)引物:Invitrogen 合成;Marker(DL 2000):上海欣百诺生物有限公司。
1.2 仪器与设备
DY-CX1A电泳仪:上海赵迪生物科技有限公司;ABI PCR 仪:北京新阳创业科技发展有限公司;ABI 3730XL 测序仪:北京新阳创业科技发展有限公司;TDZ5-WS离心机:上海乔跃电子有限公司;SZX-IS1A恒温培养箱:北京陆希科技有限公司。
1.3 实验方法
1.3.1 产香酵母的分离与筛选
(1)初筛
酒醅样粉碎,分别取25.0 g粉碎样品于三角瓶中,并加225 mL无菌生理盐水及玻璃珠,摇床中振荡摇匀30 min。无菌条件下吸取1 mL菌悬液于装有9 mL生理盐水的试管中,进行系列稀释,取10-2、10-3、10-4、10-5和10-6梯度进行平板涂布于孟加拉红琼脂培养基上。28 ℃倒置培养3~5 d后挑取平板中酵母单菌落,于10 mL生理盐水中制成菌悬液,再稀释涂布到PDA固体培养基上,重复3~4次,直至获得纯菌种,分别斜面划线低温保藏。
(2)复筛
分别把初筛分离得到的菌株接种于麦芽汁液体培养基中,28 ℃摇床振荡培养36 h后吸取4 mL菌液接种到盛有200 g高粱小麦培养基的三角瓶中,加入20 000 U糖化酶。模拟酱香白酒窖池内33 ℃发酵25 d,蒸酒,感官评定,初步筛选产香酵母。
1.3.2 GC-MS分析
通过GC-MS对产香酵母制备的酒样进行风味成分检测。分别取产香酵母所发酵的酒样1 g,置于4 mL固相微萃取仪采样瓶中,插入装有2 cm~50/30 μm DVB/CAR/PDMS StableFlex纤维头的手动进样器,在85 ℃顶空萃取30 min取出,快速移出萃取头并立即插入气相色谱仪进样口(温度250 ℃)中,热解析3 min进样。
色谱柱为ZB-5MSI弹性石英毛细管柱(30 m×0.25 mm×0.25 μm),柱温45 ℃,保留2 min,以4 ℃/min升温至220 ℃,保持2 min;汽化室温度250 ℃;载气为高纯He(纯度≥99.999%);柱前压7.62 psi,载气流量1.0 mL/min;不分流进样;溶剂延迟时间1.5 min。离子源为电子电离(electron ionization,EI)源;离子源温度230 ℃;四极杆温度150 ℃;电子能量70 eV;发射电流34.6 μA;倍增器电压1 125 V;接口温度280 ℃;质量范围20~450 amu。
对总离子流图中的各峰经质谱计算机数据系统检索及核对Nist2005和Wiley275标准质谱图,确定了挥发性化学成分,用峰面积归一化法测定了各化学成分的相对含量。
1.3.3 产酱香酵母的形态特征
(1)菌落形态观察
将分离接种纯化过的菌株接种于最小必需培养基(minimum essential medium,MEA)固体培养基,28 ℃培养3 d,观察菌落形态。
(2)细胞形态观察
将分离接种纯化过的菌株接种于MEA 斜面培养基上,28 ℃倒置培养36 h,无菌条件下用接种环挑取少许菌体置于载玻片上的无菌水中,盖上盖玻片,于显微镜下观察。
(3)假菌丝观察[9]
将分离接种纯化过的菌株接种在玉米粉琼脂平板上28 ℃培养2 d后观察假菌丝有无。
(4)子囊孢子的观察[10]
将分离接种纯化过的菌株接种于麦氏培养基斜面上,28 ℃培养7 d后用接种环挑取少量生长在葡萄糖醋酸盐培养基中的酿酒酵母于载玻片上,制片,干燥、固定后用孔雀绿芽孢染液染色,晾干之后于油镜下观察子囊孢子。
1.3.4 产香酵母的代谢实验
(1)糖发酵实验[11]
为制备碳源饥饿酵母,将纯化过的酵母于25 ℃在氮源基础培养基上饥饿培养3 d,后2.5%的接种量接种到12.5%豆芽汁中(加20 g/L葡萄糖),28 ℃静置发酵14 d,每天观察其产气状况。
(2)硝酸盐利用实验[12]
为制备氮源饥饿酵母,将纯化过的酵母先在25 ℃用碳源基础培养液培养5~7 d后稀释涂布于碳源基础培养基平板上,并点少量硝酸盐于平板上,25 ℃培养3 d,观察试剂周围是否有酵母菌落生长。
(3)产类淀粉化合物测定实验[12]
纯化过的酵母接种在蛋白胨酵母膏葡萄糖(YPD)培养液中,28 ℃培养5~6 d后加入1滴Lugol’s 碘液,观察是否产类淀粉化合物。
(4)脲酶实验[12]
纯化过的酵母接种于水解尿素实验的琼脂斜面上28 ℃培养6~7 d,观察是否分解尿素。
1.3.5 产香酵母的ITSrDNA PCR测序及系统发育树分析
提取样品基因组DNA,PCR引物:ITS1:(5'-TCCGTAGGTGAACCTGCGC-3'),ITS4:(5'-TCCCCTCCGCTTATTGATATGC-3')。模板DNA 5 μL,反应体系50 μL,PCR Premix 25 μL,引物ITS1和ITS4各0.5 μL,将ddH2O补足至50 μL。PCR 反应条件为:94 ℃5 min,94 ℃1 min,55 ℃1 min,72 ℃1 min,30个循环后琼脂糖凝胶电泳检测。将测序结果利用Blast 程序搜索同源序列,以Clustal X 软件进行多重序列比对[13],再用MEGA5.0软件构建系统发育树[14]。
2 结果与分析
2.1 产香酵母的感官评定
经过初筛,共从大曲、酒醅中分离出12株菌落形态不同的菌株,可将其分为3类,其菌落形态描述见表1。
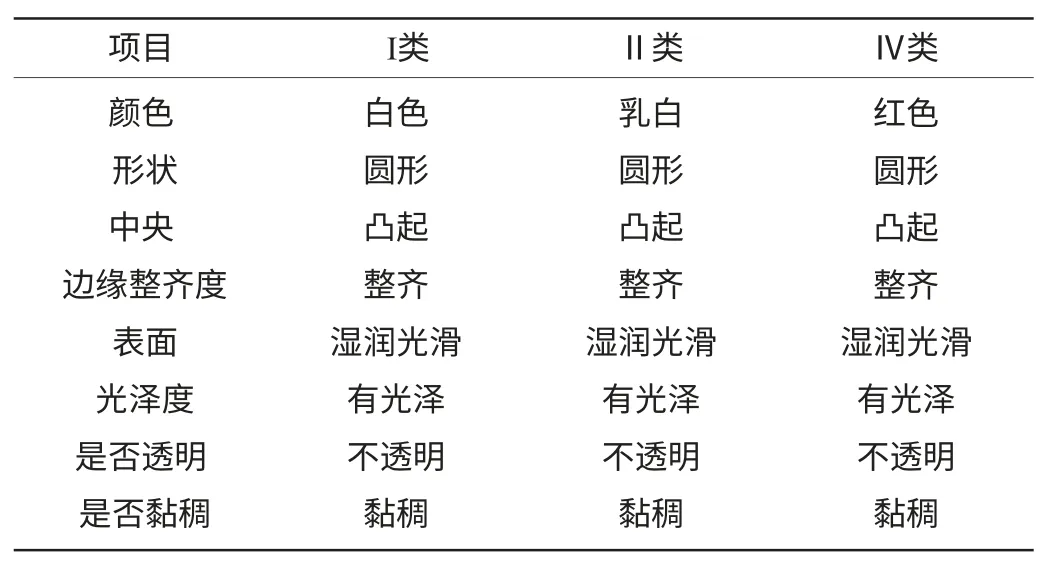
表1 酵母菌菌落形态描述Table 1 Colony morphology of yeasts
为了研究表1中12株3类不同酵母发酵产酒情况,将该12株酵母按照1.3.1的方法进行实验室模拟发酵产酒,并感官评定,其中气味强度按照数字1~10气味强度逐渐升高,结果如表2所示。
由表2可知,总体可接受性最大的为11号酵母,总体可接受性>5的酵母为11号、10号、6号、2号酵母菌株,初步筛选出该4株产香功能酵母,进行后续实验。

表2 不同酵母发酵产酒样感官评定Table 2 Sensory evaluation of liquor samples
2.2 GC-MS分析
为分析初筛中4株酵母实验室模拟发酵所蒸馏的酒样中的风味成分,对酒样进行了GC-MS分析,在4株酵母中对比筛选出1株产香优势酵母FBKL2.0011,其GC-MS分析结果如图1所示。

图1 FBKL2.0011发酵酒样挥发成分GC-MS图谱Fig.1 GC-MS analysis results of aroma components of liquor sample fermented by strain FBKL2.0011
通过GC-MS总离子流图谱进行解析后,在FBKL2.0011菌株发酵制备的酒样中共鉴定出43种挥发性物质,结果见表3。
由表3可知,FBKL2.0011菌株发酵酒样中共检出43种香气成分,包括醇类、酸类、醛类、酯类、酮类、烯烃类、芳香类化合物及烷烃类。挥发性物质中以醇类的含量最多,其中乙醇相对含量32.202%;其次是酯类如乙酸乙酯相对含量达8.009%。以醇类和酯类为主的香气物质共同形成了白酒香气。
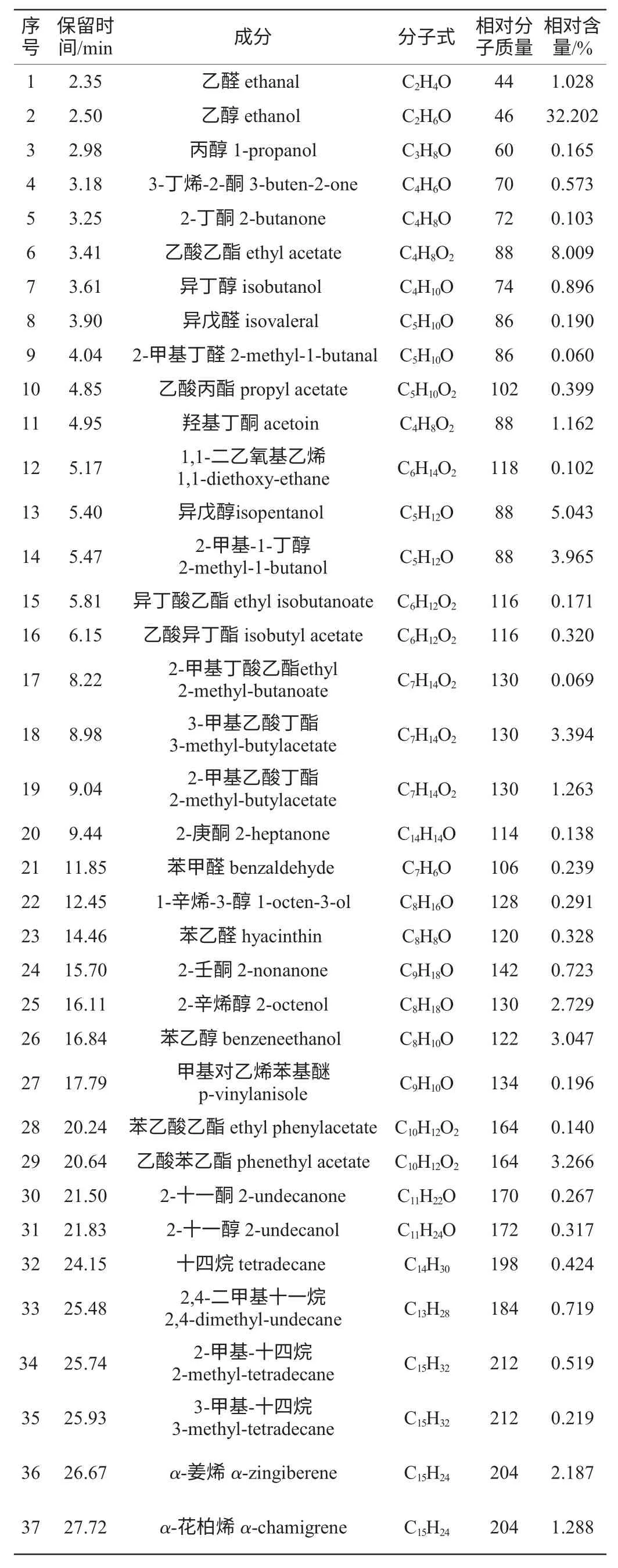
表3 FBKL2.0011菌株发酵制备的酒样中香气物质组成Table 3 Aroma compositions in liquor sample produced by strain FBKL2.0011

续表
2.3 产香酵母的鉴定
2.3.1 菌落形态及显微形态观察
菌株FBKL2.0011在MEA固体培养基上,28 ℃倒置培养3 d,其菌落形态结果见表4及图2。

表4 FBKL2.0011菌株在MEA培养基培养3 d的菌落形态Table 4 Colonial morphology of strain FBKL2.0011 cultured in MEA medium for 3 d
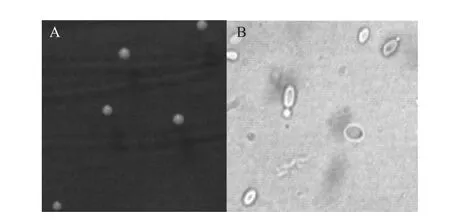
图2 FBKL2.0011的菌落形态(A)及镜检图(B)Fig.2 Colonial morphology (A) and microscopy examination (B) of strain FBKL2.0011
2.3.2 酵母菌部分代谢实验
对酵母菌株FBKL2.0011进行生理生化特性试验,其结果见表5。
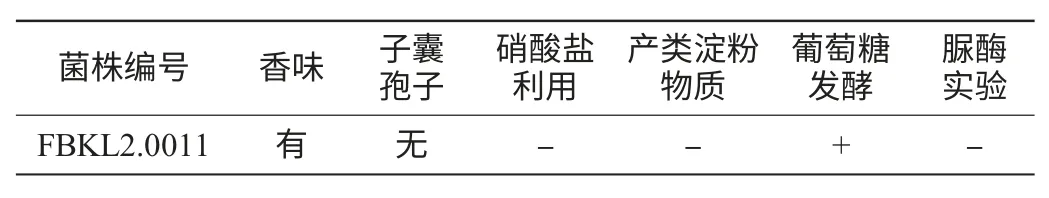
表5 酵母菌生理生化特性形态Table 5 Physiological and biochemical properties of yeasts
由表5可知,酵母菌株FBKL2.0011无孢子,能利用葡萄糖发酵产生香气成分,不能利用硝酸盐,不产类淀粉物质及不能分解尿素。
2.3.3 分子生物学鉴定
为了进一步确定该酵母的分类地位,又在形态学和生理生化的基础上进行了分子生物学鉴定。采用ITS序列分析方法,对菌株DNA序列进行扩增,将扩增出的核酸片断与Marker条带比较,有一条明亮的PCR 特征性条带,如图3所示,并且其分子质量大小与预测的理论值基本相符,菌株FBKL2.0011的PCR产物片段大小为817 bp。利用Blast程序与GenBank 中已登录的基因序列进行比对,获得已定名的与之相似的属、种的相关信息。构建发育树和同源性分析结果见图4。由图4可知,菌株FBKL2.0011 与uncultured compost fungus 同源性最高为99%。

图3 PCR产物电泳图谱Fig.3 Electrophoresis of PCR products

图4 菌株FBKL2.0011的ITS序列系统发育树Fig.4 Phylogenetic tree of ITS sequences of strain FBKL2.0011
通过以上形态、生理学特征采用《酵母菌特征及鉴定手册》介绍的方法[15]对该酵母分类,并结合其分子生物学鉴定结果,判断判菌株FBKL2.0011 为酵母属(Saccharomyces)。
3 结论
从金沙窖酒酒醅中分离到一株产香菌株,通过形态学、生理生化试验和分子生物学鉴定,确定FBKL2.0011为酵母属(Saccharomyces)。FBKL2.0011菌株发酵酒样中共检出43种香气成分,包括醇类、酸类、醛类、酯类、酮类、烯烃类、芳香类化合物及烷烃类。挥发性物质中以醇类的含量最多,其中乙醇相对含量32.202%;其次是酯类如乙酸乙酯相对含量达8.009%。以醇类和酯类为主的香气物质共同形成了白酒香气。
今后将对该菌与实验室筛选的功能细菌和霉菌联合培养发酵条件进行研究与优化,期望发现能够提高白酒生产过程中的高级醇和酯类含量的一种方法。
[1]毕金丽,刘 娅,张殿朋,等.耐高温酵母的筛选鉴定及发酵性能的初步研究[J].中国酿造,2013,32(5):112-115.
[2]王国良,宋俊梅,曲静然.生香酵母及其应用[J].食品工业,2004(3):16-17.
[3]陆振群.酒曲中生香酵母的分离及生理生化鉴定[J].酿酒科技,2012(3):37-39.
[4]周世水,熊建春.酒曲中生香酵母的分离鉴定与产酯工艺优化[J].现代食品科技,2010(3):98-108.
[5]陈天寿.微生物培养基的制造与应用[M].北京:中国农业出版社,1995.
[6]汪江波,张 晶,方尚玲,等.稻花香包包曲制曲过程微生物区系动态变化研究[J].酿酒,2010,37(2):35-37.
[7]何国庆,贾英民.食品微生物学[M].北京:中国农业大学出版社,2005.
[8]陈兰兰.优良酵母菌株的筛选及其在干红葡萄酒中的应用[D].石河子:石河子大学硕士论文,2009.
[9]胡开辉.微生物学实验[M].北京:中国林业出版社,2004.
[10]杨文博.微生物学实验[M].北京:化学工业出版社,2004.
[11]王小红,徐 康,赵 山,等.孝感凤窝酒曲中酵母菌的分离及特性研究[J].现代食品科技,2008,24(2):134-137.
[12]赵 斌,何绍江.微生物学实验[M].北京:科学出版社,2002.
[13]THOMPSON J D,HIGGINS D G,GIBSON T J,et al.Improving the sensitivity of progressive multiple sequence alignment through sequence weighting,position-specific gap penalties and weight matrix choice[J].Nucleic Acids Res,1994,22(22):4673-4680.
[14]TAMURA K,DUDLEY J,NEI M,et al.MEGA4:Molecular evolutionary genetics analysis (MEGA) software version 4.0[J].Molecul Biol Evol,2007,24(8):1596-1599.
[15]巴尼特,佩恩·亚罗.酵母菌的特征与鉴定手册[M].胡瑞卿,译.青岛:青岛海洋大学出版社,1991.
