靶向TIPE2基因的shRNA慢病毒载体构建及病毒包装
2014-04-06王耀辉王明丽陈九格马远方
王耀辉,王明丽,陈九格,张 晶,马远方
(河南大学 医学院,河南 开封 475004)
靶向TIPE2基因的shRNA慢病毒载体构建及病毒包装
王耀辉,王明丽,陈九格,张 晶,马远方*
(河南大学 医学院,河南 开封 475004)
目的包装表达TIPE2-shRNA的慢病毒颗粒。方法查询并合成7对针对TIPE2的shRNA序列,将其克隆入pLK0.1载体,经酶切及测序正确后,将构建好的7种pLKO.1-TIPE2-shRNA质粒分别与pCDNA3.1/3×FLAG-TIPE2共转染293T细胞,Western blot鉴定干扰效率并进行后续的病毒包装。结果4号质粒沉默效果最好,将其与Non-target-shRNA质粒分别进行病毒包装,Western blot和免疫荧光证实病毒具有良好的感染效率和沉默效果。结论TIPE2-shRNA的慢病毒载体构建及病毒包装成功。
TIPE2;shRNA;慢病毒包装;基因
TIPE2(tumor necrosis factora induced protein-8-like 2,TNFAIP8L-2)隶属于 TNFAIP8家族,它由184个氨基酸组成,在维持机体免疫平衡中扮演重要角色。研究[1]表明,TIPE2优先表达于淋巴组织,敲除TIPE2后会使老鼠体内多器官功能障碍,脾脏肿大,甚至过早死。在人体内,除免疫细胞外,TIPE2还在神经细胞、宫颈、胃肠道的上皮细胞中表达[2],由此说明,TIPE2可能参与体内多方面生理功能调节。我们的实验旨在构建携带TIPE2基因shRNA的慢病毒载体,包装高效的慢病毒颗粒,为进一步研究TIPE2功能奠定基础。
1 材料和方法
1.1 材料
1.1.1 细胞、载体和质粒 Huh7人肝癌细胞系、DH5α感受态细胞、HEK293T人胚肾细胞系(实验室保存);第三代慢病毒表达载体pLKO.1、慢病毒包装载体psPAX2、pMD2.G 及对照载体 Non-targetshRNA(自带绿色荧光蛋白)(复旦大学基础医学院袁正宏教授馈赠);pCDNA3.1/3×FLAG-TIPE2质粒(实验室制备)。
1.1.2 试剂与仪器 DMEM培养基、胎牛血清(美国 Life Technologies公司);PEI(实验室制备);Puromycin(美国 Sigma-Aldrich公司);限制性内切酶(加拿大Fermentas公司);T4连接酶及Buffer(日本Takara公司);金牌超量无内毒素质粒大提试剂盒(北京康为世纪生物科技有限公司);胶回收试剂盒(美国 Axygen公司);倒置荧光显微镜(德国Zeiss公司);ImageQuant350(美国 GE公司)。
1.2 方法
1.2.1 寡核苷酸设计与合成 从Sigma页面(http://www.sigmaaldrich.com/catalog/mission/shclnvnm024575?lang=en&region=AS)查找并挑选7对针对TIPE2基因的shRNA寡核苷酸序列并进行合成(苏州金唯智生物科技有限公司)。
1.2.2 构建与鉴定sh-TIPE2慢病毒表达载体pLKO.1载体经EcoRI、Age I两种限制性内切酶双酶切后胶回收,并将退火后的7对shRNA序列与胶回收产物在16℃连接4h,用DH5α转化连接产物,涂板后置37℃温箱孵育12h,次日挑取饱满单克隆摇菌过夜,然后用金牌超量无内毒素质粒大提试剂盒提取质粒;质粒经EcoRI、NcoI双酶切及测序(苏州金唯智生物科技有限公司)鉴定后正确。将pCDNA 3.1/3×FLAG-TIPE2和构建好的7种质粒共转染HEK293T细胞,48h后收集细胞并进行 Western blot检测,以蛋白表达降低50%视为干扰有效。
1.2.3 慢病毒包装制备 培养293T细胞,并于转染前一天接种于10cm培养皿内,待细胞密度达到70%左右时即用PEI进行转染。体系如下:在1.5mL EP管内加入9g/L NaCl 480μL、PEI 20μL,轻弹混匀,于另一1.5mL EP管内加入 Non-targe-shRNA 5 μg、psPAX23.75μg、pMD2.G 1.25μg,9g/L NaCl补足500μL,混匀。5min后把前者加入后者混匀,期间对培养皿内细胞更换新鲜培养基,20min后把混合液均匀加入培养皿混匀;pLKO.1-TIPE2-shRNA质粒转染如上。转染24h后更换培养基,72h后收集富含病毒颗粒培养上清,离心(800g,5min,25 ℃)后用0.45μm滤膜过滤,分装后于 -80℃保存。
1.2.4 病毒感染与检测 用293T细胞转染pCDNA3.1/3×FLAG-TIPE2表达质粒,48h后取部分细胞接种于6孔板内,待细胞密度达到60%时,用包装后的病毒与培养基按1∶1比例感染细胞,其中以Mock和Non-target-shRNA病毒颗粒为实验对照。24h后弃上清,收细胞,并用Western blot检测病毒感染效果。具体实验步骤如下:配置150g/L SDSPAGE,取10μL蛋白样品上样,分离胶14mA,浓缩胶18mA条件下跑胶,之后湿转至NC膜(300mA,1h);50g/L的脱脂奶粉封闭1h,洗膜(10min/次,3次);一抗室温封闭2h [anti-β-actin(1∶10000),anti-FLAG(1∶3000)],洗膜,二抗山羊抗鼠-HRP(1∶3000)、山羊抗兔-HRP(1∶3000)室温孵育2h,洗膜;用ECL发光液于暗室曝光。
2 结果
2.1 引物设计
设计7对针对TIPE2的shRNA特异性引物(表1),用高压灭菌水溶解为终浓度20μmon/L,按照正义引物 5μL、反义引物 5μL、10×NEB Buffer25μL、H2O 35μL的配比混合均匀,置于1L装满水的烧杯中,加热至95~100℃,放置4~5min,缓慢降温至室温(2h左右),将合成的单链寡核苷酸退火形成具有黏性末端的寡核苷酸双链(58bp)。

表1 TIPE2-shRNA引物序列

续表1
2.2 pLKO.1-TIPE2-shRNA 慢病毒表达载体构建及鉴定
经EcoRI、Age I两种内切酶酶切后的慢病毒表达载体pLKO.1与退火后具有黏性末端的7对TIPE2-shRNA片段进行定向连接,转化后提质粒,经EcoRI,NcoI酶切,在2kb及5kb处有与预期一致的条带(图1),测序鉴定正确。将pCDNA3.1/3×FLAG-TIPE2质粒与构建好的7个 TIPE2-shRNA质粒分别共转染293T细胞,经 Western blot验证4号质粒干扰效果最好。
2.3 病毒包装与鉴定
将4号质粒pLKO.1-TIPE2-shRNA 和 Non-target-shRNA质粒分别与慢病毒包装载体共转293T细胞。用包装后含 Non-target-shRNA、TIPE2-shRNA的病毒颗粒分别感染转染有pCDNA3.1/3×FLAG-TIPE2表达质粒的293T细胞,前者于荧光显微镜下观察,发现绝大部分细胞表达绿色荧光蛋白(图2);后者收集细胞经Western blot检测发现,病毒感染后TIPE2蛋白水平显著下调(图3)。

图1 pLKO.1-TIPE2-shRNA质粒酶切后

图2 荧光显微镜检测慢病毒感染效率(×100)
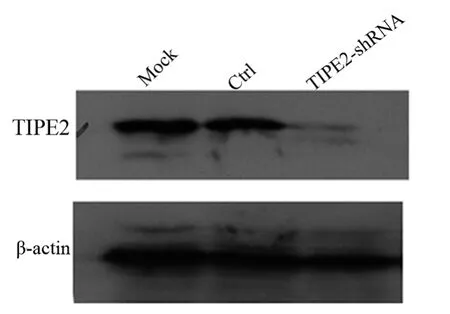
图3 Western blot检测慢病毒感染后的沉默效果
3 讨论
TIPE2于2002年作为新基因被发现[3],是TNFAIP8家族的一员,二者在结构方面相似,都可调节固有免疫和适应性免疫,在维持免疫自稳中具有重要作用。有研究[4]表明,TIPE2在肝癌组织中低表达,沉默TIPE2会显著激活Ras下游信号,从而抑制细胞凋亡,增强细胞迁移,提示TIPE2可能参与了肝癌的发生发展过程。此外,敲除TIPE2的动物更易患败血症休克[1],这就提示TIPE2可能参与体内多方面功能调节,而这需要更深入研究来揭示。
随着分子生物学的发展,RNA干扰技术在研究基因功能方面具有重要作用。RNA干扰是利用双链RNA高效、特异地阻断体内特定基因表达,使细胞表现出特定基因缺失表型的过程[5]。但细胞内siRNA易降解不利于对基因功能长期研究,而病毒感染可弥补这一缺陷,易于筛选稳定细胞进行长期研究。病毒包装常用载体之一慢病毒载体具有感染分裂期、非分裂期细胞,目的基因表达时间长,不易诱发免疫反应等特点,可以作为理想载体携带shRNA[6]。
我们的研究成功构建了 pLKO.1-TIPE2-shRNA慢病毒表达载体,并包装高感染效率的慢病毒颗粒,这为今后研究TIPE2功能奠定了良好基础。
[1]Sun H ,Gong S,Carmody R J,et al.TIPE2,a negative regulator of innate and adaptive immunity that maintains immune homeostasis[J].Cell,2008,133(3):415-426.
[2]Xi W,Hu Y,Liu Y,et al.Roles of TIPE2in hepatitis B virus induced hepatic inflammation in humans and mice[J].Mol Immunol,2011,48(9/10):1203-1208.
[3]Hansson G K.Immune mechanisms in atherosclerosis[J].Nat Immunol,2001,21(12):1876-1890.
[4]Gus-Brautbar Y,Johnson D,Zhang L,et al.The anti-inflammatory TIPE2is an inhibitor of the oncogenic Ras[J].Mol Cell,2012,45(5):610-618.
[5]Moffat J,Sabatini D M.Building mammalian signalling pathways with RNAi screens[J].Nat Revmol Cell Biol,2006,7(3):177-187.
[6]Nishitsuji H,Ikeda T,Miyoshi H,et al.Expression of small hairpin RNA by lentivirus-based vector confers efficient and stable gene-suppression of HIV-1on hum an cells including primary non-dividing cells[J].Microbes Infect,2004,6(1):76-85.
[责任编辑 姬 荷]
Construction and package of recombinant lentivirus expressing shRNA targeting TIPE2 gene
WANG Yaohui,WANGmingli,CHEN Jiuge,ZHANG Jing,MA Yuanfang*(Medical College of Henan University,Kaifeng,Henan 475004,China)
ObjectiveTo package the recombinant lentivirus expressing TIPE2shRNA.MethodsInquiring and synthesizing seven pairs shRNA sequences targeting TIPE2,then inserted into pLKO.1lentivirus vector.After the constructions were verified to be correct,co-transfected them with pCDNA3.1/3×FLAG TIPE2plasmids into 293T cells,respectively.Then,Non target shRNA,the highest silence efficiency plasmid were co-transfected with psPAX2,pMD2.G into 293Tcells for lentivirus packaging,respectively.ResultsThe No.4plasmid was screened by Western blotting that has the highest silence efficiency and followed by virus packing.The infection and silence efficiency was confirmed by immunofluorescence and Western blot.ConclusionThe recombinant lentivirus expressing shRNA targeting TIPE2gene was packaged successfully.
TIPE2;shRNA;lentivirus package;gene
Q782
A
1672-7606(2014)02-0120-03
2014-02-15
河南大学校内基金资助(2011YBZR005)。
王耀辉(1982-),男,河南许昌人,博士,讲师,从事病毒与宿主相互作用及抗体药物研发的教学与科研工作。
*通讯作者:马远方(1960-),男,河南巩义人,博士,教授,从事免疫学及分子免疫学的教学及科研工作。
