不同设备引导个性化非球面人工晶体选择的可行性观察
2014-04-04赵晓彬高辉李科军
赵晓彬 高辉 李科军
随着超声乳化手术及人工晶体(IOL)技术的发展,白内障手术已发展为晶体性的屈光手术。现代白内障手术的目标不仅是恢复清晰的视力,还包括获得更好的视觉质量。传统的球面IOL具有正球差,植入后会增加全眼球差[1],而非球面IOL由于特殊的设计,具有零球差或负球差,植入后可减少全眼球差[2]。尽管目前白内障术后的最适宜球差尚不明确,但研究证实对术后接近正视的患者,降低全眼球差可提高对比敏感度,改善视觉质量[3-5]。但不同患者角膜球差不同,如果盲目植入相同球差的IOL,则会导致部分患者术后全眼球差增加,视觉质量下降,因此有必要根据术前角膜球差个性化选择非球面IOL。本研究采用Atlas 9000角膜地形图系统及Pentacam眼前节分析系统测量术前角膜球差,根据角膜球差植入不同的非球面IOL,使术前角膜球差与所植入非球面IOL球差之和接近零。通过观察术后全眼球差预测值与测量值的一致性,探讨这两种设备引导个性化非球面IOL选择的可行性。
1 资料与方法
1.1 一般资料 收集2013年1~6月在我科就诊拟行白内障超声乳化手术的患者60例(60眼)。采用随机数字表法将患者随机分为2组,每组30例,术前1 d分别采用Atlas 9000角膜地形图系统(德国Zeiss公司)(Atlas 9000组)及Pentacam眼前节分系统(德国Oculus公司)(Pentacam组)测量6.0 mm直径角膜球差,并根据角膜球差植入不同的非球面IOL,使术后全眼球差接近零。角膜球差≥+0.235 μm者植入Tecnis Z9003 IOL(AMO 公司),球差为 -0.27 μm;角膜球差 < +0.1 μm 者植入 Rayner 920H IOL(Rayner 公司),球差为零;角膜球差 ≥ +0.1 μm 并 < +0.235 μm 的患者,植入 Acrysof IQ IOL(Alcon 公司),球差为 -0.20 μm。
1.2 病例入选标准 年龄相关性白内障,散瞳下瞳孔直径≥6.0 mm。病例排除标准:(1)患有影响视力的眼部疾病如弱视、青光眼、黄斑变性、糖尿病性视网膜病变等;(2)患有可能会影响术后IOL居中性的疾病如假性囊剥脱;(3)角膜疾患如角膜云翳、角膜变性、累及角膜的翼状胬肉等;(4)角膜散光大于1.0D;(5)既往有屈光或内眼手术病史;(6)术中或术后出现并发症如后囊膜破裂、IOL偏位、后囊膜混浊等。所有患者均签署知情同意书。
1.3 其他术前检查 包括视力、眼压、屈光状态、角膜内皮细胞计数、详细的裂隙灯及眼底检查。采用A超或IOL Master测量角膜曲率、前房深度及眼轴长度,SRK-T或Holladay公式计算IOL度数。
1.4 手术方法 所有手术均由同一位经验丰富的医师完成。表面麻醉后,11点位行隧道式透明角膜切口,长3.2 mm,2点位行侧切口,前房注入玻璃酸钠维持前房深度及保护角膜内皮细胞,行直径5.5 mm连续环形撕囊以预防后囊膜混浊及保持IOL居中,水分离水分层后,采用WhiteStar超声乳化机(美国眼力健公司)乳化吸除混浊晶体,囊袋内植入非球面IOL,水密切口。术后滴用妥布霉素地塞米松滴眼液及双氯芬酸钠滴眼液1个月。
1.5 观察指标 术后3个月随访并进行以下检查。采用国际标准视力表检查5 m远处裸眼视力(uncorrected visual acuity,UCVA),验光确定屈光状态及最佳矫正视力(best corrected visual acuity,BCVA)。并进行详细的裂隙灯、眼底及眼压检查。散瞳状态下采用WASCA波前像差仪(德国Zeiss公司)测量患者6 mm瞳孔直径全眼球差,此像差仪是基于Hartmann-Shack原理设计的波前像差测量系统。采集数据前要求患者迅速眨眼1~2次以减轻泪膜对像差测量结果的影响,每只眼重复测量3次,取平均值。
1.6 统计学分析 应用SPSS 16.0统计软件,计量资料以表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 患者一般情况 60例患者中术后出现后囊膜混浊1例,数据予以剔除。最后符合纳入排除标准的患者共有59例(59眼),Atlas组30例(30眼),Pentacam组29例(29眼)。
2.2 术后视力 术后3个月Atlas 9000组和Pentacam组裸眼视力、最佳矫正视力、等效球镜值差异均无统计学意义(P>0.05)。见表1。
表1 2组术后视力及等效球镜值n=30,±s
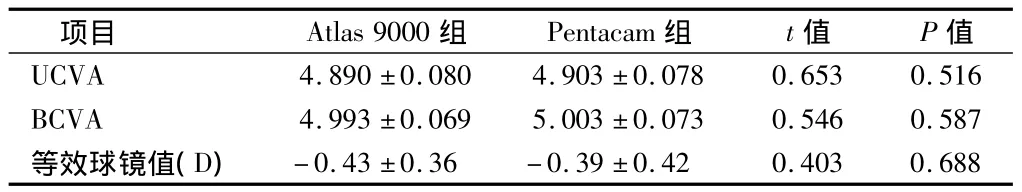
表1 2组术后视力及等效球镜值n=30,±s
项目 Atlas 9000组 Pentacam组 t值 P值UCVA 4.890 ±0.080 4.903 ±0.078 0.653 0.516 BCVA 4.993 ±0.069 5.003 ±0.073 0.546 0.587等效球镜值(D)-0.43 ±0.36 -0.39 ±0.42 0.403 0.688
2.3 球差测量
2.3.1 术前角膜球差:Atlas 9000组平均术前角膜球差为(0.270 ±0.072)μm,Pentacam 组平均术前角膜球差为(0.264±0.081)μm,差异无统计学意义(t=0.313,P=0.756)。
2.3.2 术后全眼球差:术前角膜球差与所植入IOL球差之和为全眼球差预测值,术后采用WASCA波前像差仪测量所得值为全眼球差测量值。预测值与测量值之差为预测误差。①Atlas 9000组及Pentacam组术后全眼球差预测值分别为(0.028 ±0.041)、(0.022 ±0.046)μm,测量值分别为(0.012 ±0.058)、(0.010 ±0.067)μm,预测值与测量值之间差异无统计学意义(P>0.05)。2组术后全眼球差测量值差异无统计学意义(t=0.129,P=0.898)。③Atlas 9000 组术后全眼球差在 ±0.1 μm 范围内的比例为86.7%,Pentacam组为89.7%。见表2。
表2 2组术后全眼球差预测值与测量值n=30,μm,±s

表2 2组术后全眼球差预测值与测量值n=30,μm,±s
组别 预测值 测量值 预测误差 t值 P值Atlas9000 组 0.028 ±0.041 0.012 ±0.058 0.016 ±0.047 1.821 0.079 Pentacam 组 0.022 ±0.046 0.010 ±0.067 0.013 ±0.051 1.321 0.197
2.3.3 预测误差:2组全眼球差预测误差分别为(0.016 ±0.047)、(0.013 ±0.051)μm,2 组差异无统计学意义(t=0.418,P=0.761)。
3 讨论
波前像差技术在眼科的应用促进了对角膜及全眼像差的认识。全眼像差主要由角膜及晶状体像差组成,正常人眼高阶像差较低,其中以球差较为明显[6]。研究发现,年轻人眼的角膜球差为正值,晶状体球差为负值,二者的互补使得全眼的球差处于较低的水平,从而保持良好的视觉质量[7]。随年龄增长,人眼球差发生变化。角膜球差在一生中较稳定,而晶状体球差由负值逐渐转变为正值,失去了对角膜球差的补偿作用,从而导致视觉质量的下降[8]。传统的球面IOL由于各个径线曲率相同,具有正球差,植入眼内后会增加全眼球差,而非球面IOL通过对前表面或后表面进行修饰,使其在不同径线曲率不同,具有零球差或负球差,植入后可减少全眼球差[2]。
目前可供临床应用的非球面IOL有多种,球差为0~0.27 μm。大量研究证实,与球面 IOL相比,非球面IOL植入后可降低全眼球差,提高术后视觉质量[9-11]。通 过 对 696 眼 的 观 察,Beiko 等[12]报 道6.0 mm直径时角膜球差的正常值为(0.274±0.089)μm。Wang等[13]观察了 228 眼的角膜球差,发现角膜球差小于 0.2 μm 的比例为 15.4%,0.2 ~0.4 μm的比例为 77.6%,大于 0.4 μm 的比例为 7%。Bottos等[14]通过观察屈光手术前后角膜球差的变化发现,屈光手术前角膜球差的范围为(+0.03~+0.61)μm,而术后角膜球差范围为(-0.58 ~ +1.02)μm。由此可见,不同患者的角膜球差差异很大,且部分患者尤其是部分屈光手术后患者角膜球差为负值,如果这些患者面临白内障手术时不加选择的植入相同的非球面IOL,势必会导致部分患者术后全眼球差增加。因此有必要根据术前角膜球差个性化植入非球面IOL。目前关于白内障术后的最佳球差值仍有争议。Levy等[3]研究发现全眼球差为 +0.1 μm 者拥有超级视力,推测术后应保留 +0.1 μm球差。Piers等[5]采用自适应光学研究发现,当全眼球差为零时,对比敏感度最佳。Wang等[4]发现大部分术眼在球差为零的情况下,并不能获得最佳的视觉质量,术后最佳球差有较大的变化范围。但可以明确的是,适当的降低术后全眼球差可以提高对比敏感度,改善术后视觉质量[4]。
要想正确选择非球面IOL,获取术后目标球差,准确测量术前角膜球差是必不可少的。Atlas 9000是基于Placido盘设计的计算机辅助角膜地形图仪,具有独特的锥焦系统,可根据角膜前表面与理想表面的差异获取角膜前表面高度及像差数据。该设备每秒可扫描15幅图像,并自动选择4幅最佳图像显示在结果中。Pentacam通过Scheimpflug三维成像系统对眼前节进行360度扫描,可根据角膜前后表面的高度计算得到角膜前后表面及全角膜像差。该设备2 s内可以完成25次扫描,每幅图像包含2740个数据点。二者测量角膜像差的重复性及一致性较高[15]。
采用不同设备引导个性化非球面IOL选择并比较二者的差异,国内外鲜有报道。Packer等[16]采用i-Trace视功能分析仪测量白内障患者术前角膜球差,植入3种不同的非球面IOL,使术前角膜球差与所植入非球面IOL球差之和接近零,结果显示术后全眼球差为(-0.013±0.072)μm,93.3%的眼术后全眼球差在 ±0.1 μm 之内。Solomon[17]采用 OPD-Scan 测量角膜及全眼球差,并采用Packer等[16]的方法选择非球面IOL,研究发现术后全眼球差为(0.019±0.051)μm,全眼球差预测误差为(0.025±0.020)μm,40眼中有37眼术后全眼球差在±0.1 μm之内。以上研究均为根据角膜前表面球差选择非球面IOL,未将角膜后表面球差纳入观察范围。本研究所采用Atlas 9000可测量角膜前表面球差,Pentacam则可同时获取角膜前、后表面及全角膜球差。本研究显示,Atlas 9000组和Pentacam组术后全眼球差预测值分别为(0.028±0.041)μm、(0.022 ±0.046)μm,测量值分别为(0.012±0.058)μm、(0.010 ±0.067)μm,预测值与测量值之间差异无统计学意义。Atlas 9000组术后全眼球差在±0.1 μm 范围内的比例为 86.7%,Pentacam 组为89.7%。表明这两种设备引导个性化非球面IOL植入,术后均能达到预期的结果。
本研究发现,尽管Atlas 9000与Pentacam两个设备测量像差的方法不完全相同,并且所获取的角膜像差数据分别来自于角膜前表面及全角膜,但二者引导个性化非球面IOL选择的一致性较好,2组术后全眼球差测量值无统计学差异。分析原因可能有以下几个方面:(1)角膜后表面对角膜像差的影响较小。Atlas 9000角膜地形图系统可测量角膜前表面像差,而Pentacam眼前节分析系统可以同时测量角膜前后表面像差,并综合前后表面像差获得全角膜像差数据。然而,角膜像差以前表面像差为主,角膜后表面像差值较小,对全角膜像差的影响较小。研究发现角膜后表面像差在全角膜像差中所起的作用仅为2%[18]。本研究结果也证实了以上观点。本研究发现,无论采取角膜前表面还是全角膜球差引导个性化非球面IOL选择,术后都能达到预想的结果。(2)Atlas 9000与Pentacam测量角膜像差的一致性较好。de Jong等[15]对比了包括Atlas及Pentacam在内的4种眼前节分析系统,观察4种仪器测量角膜前表面像差的重复性及一致性。结果表明Atlas与Pentacam测量结果的一致性最好,二者测量所得的角膜前表面球差数据平均差异为0 μm。其中Pentacam测量的重复性最佳。Domenech等[19]研究也发现在5.0 mm瞳孔直径时,Atlas与Pentacam的高阶像差测量结果差异几乎为0 μm。
然而,尽管两种设备引导个性化非球面IOL选择的可预测性较好,但仍有少量预测误差存在。产生预测误差的原因包括手术诱导的角膜球差及IOL的倾斜与偏心。Packer等[16]认为,手术诱导的角膜球差是产生预测误差的主要原因。如果手术诱导的角膜球差为零,则根据角膜球差个性化选择非球面IOL会有更高的准确性。此外,IOL的倾斜和偏心也会对像差造成影响,尤其是在植入负球差非球面IOL的情况下。研究显示负球差非球面IOL偏离视轴0.5~1.0 mm会导致更高或更低的像差[20]。因此,术者应努力提高自己的手术技巧,减少手术诱导的角膜球差,尽量避免IOL的倾斜和偏心,从而减少预测误差,提高个性化选择非球面IOL的准确性。
本研究未观察Atlas 9000与Pentacam测量角膜球差的一致性,只根据其他作者以往研究推断二者一致性较好,也未进行角膜后表面球差的观察,这是本研究的不足之处。此外,本研究未观察患者的视觉质量及生活质量。对视觉质量及生活质量的研究可以指导我们更合理的选择非球面IOL,对明确可以从非球面IOL获益的患者进行个性化的选择,可以真正发挥非球面IOL的作用。
综上所述,采用Atlas 9000角膜地形图系统或Pentacam眼前节分析系统测量术前角膜球差,根据角膜球差个性化选择非球面IOL,术后均可获得预期的结果。角膜后表面球差在整个角膜中所占比重较小,对角膜球差的大小无明显影响。无论采用角膜前表面球差还是全角膜球差引导非球面IOL选择,都不会对术后结果造成明显影响。
1 Vilarrodona L,Barrett GD,Johnson B.High order aberration in pseudophakia with different intraocular lenses.J Cataract Refract Surg,2004,30:571-575.
2 Holladay JT,Piers PA,Koranyi G,et al.A new intraocular lens design to reduce spherical aberration of pseudophakic eyes.J Refract Surg,2002,18:683-691.
3 Levy Y,Segal O,Avni I,et al.Ocular high-order aberrations in eyes with supernormal vision.Am J Ophthalmol,2005,139:225-228.
4 Wang L,Koch DD.Custom optimization of intraocular lens aphericity.J Cataract Refract Surg,2007,33:1713-1720.
5 Piers PA,Manzanera S,Prieto PM,et al.Use of adaptive optics to determine the optimal ocular spherical aberration.J Cataract Refract Surg,2007,339:1721-1726.
6 Bellucci R,Morselli S.Optimizing higher-order aberrations with intraocular lens technology.Curr Opin Ophthalmol,2007,18:67-73.
7 Smolek MK,Klyce SD.Goodness-of prediction of Zernike polynomial fitting to corneal surfaces.J Cataract Refract Surg,2005,31:2350-2355.
8 Wang L,Santaella RM,Booth H,et al.Higher-order aberrations from the internal optics of the eye.J Cataract Refract Surg,2005,31:1512-1519.
9 Morales EL,Rocha KM,Chalita MR,et al.Comparison of optical aberrations and contrast sensitivity between aspheric and spherical intraocular lenses.J Refract Surg,2011,27:723-728.
10 Assaf A,Kotb A.Ocular aberrations and visual performance with an aspheric single-piece intraocular lens:Contralateral comparative study.J Cataract Refract Surg,2010,36:1536-1542.
11 Luo M,Ji J,Zhao C,et al.Clinical study of Acrysof IQ aspheric intraocular lenses.Clin Experiment Ophthalmol,2010,38:358-362.
12 Beiko GH,Haigis W,Steinmueller A.Distribution of corneal spherical aberration in a comprehensive ophthalmology practice and whether keratometry can predict aberration values.J Cataract Refract Surg,2007,33:848-858.
13 Wang L,Dai E,Koch DD,et al.Optical aberrations of the human anterior cornea.J Cataract Refract Surg,2003,29:1514-1521.
14 Bottos KM,Leite MT,Aventura-Isidro M,et al.Corneal asphericity and spherical aberration after refractive surgery.J Cataract Refract Surg,2011,37:1109-1115.
15 de Jong T,Sheehan MT,Dubbelman M,et al.Shape of the anterior cornea:Comparison of height data from 4 corneal topographers.J Cataract Refract Surg,2013,39:1570-1580.
16 Packer M,Fine IH,Hoffman RS.Aspheric intraocular lens selection based on corneal wavefront.J Refract Surg,2009,25:12-20.
17 Solomon JD.Outcomes of corneal spherical aberration-guided cataract surgery measured by the OPD-Scan.J Refract Surg,2010,26:863-869.
18 Artal P,Berrio E,Guirao A,et al.Contribution of the cornea and internal surfaces to the change of ocular aberrations with age.J Opt Soc Am A Opt Image Sci Vis,2002,19:137-143.
19 Domenech B,Mas D,Ronda E,et al.Repeatability and concordance of the Pentacam system.Comparative study of corneal parameters measured with Pentacam and Atlas.Optica Pura Aplicada,2009,42:51-60.
20 Wang L,Koch DD.Effect of decentration of wavefront-corrected intraocular lenses on the higher-order aberrations of the eye.Arch Ophthalmol,2005,123:1226-1230.
