CD14对生殖支原体LAMPs激活NF-κB的影响
2014-04-02曾焱华游晓星伍绍坚吴移谋
何 军,曾焱华,游晓星,伍绍坚,田 巍,刘 君,吴移谋
生殖支原体(Mycoplasmagenitalium,Mg)是由Tully等从非淋菌性尿道炎患者尿道分泌物中分离出的一种支原体,可引起急慢性尿道炎、阴道炎、子宫内膜炎、盆腔炎、输卵管性不孕不育等多种疾病,并且与AIDS患者的发展死亡密切相关[1-3]。由于支原体缺乏细胞壁,其膜表面存在的大量脂质相关膜蛋白((lipid-associated membrane proteins, LAMPs)是其黏附、定植、入侵宿主细胞以及引起宿主细胞炎症反应的物质基础[4]。本研究试探讨CD14在生殖支原体LAMPs激活NF-κB中的作用,从而为Mg的致病机制研究及治疗奠定基础。
1 材料与方法
1.1材料
1.1.1菌株和细胞 Mg-37标准株由南华大学病原生物学研究所保存,人单核细胞株THP-1细胞和宫颈癌细胞株HeLa细胞购自武汉大学中国典型培养物保藏中心。
1.1.2试剂和试剂盒 青霉素、多粘菌素B购自Solarbio;无支原体牛血清和超级新生胎牛血清购自四季青生物工程公司;RPMI-1640和DMEM培养基购自Hyclone;PPLO购自BD公司;NF-κBp65 (Total) ELISA KIT购自Life Technologies公司;细胞核蛋白与细胞浆蛋白抽提试剂盒购自碧云天生物;Lipofectamine 2000购自Invitrogen公司;1%人血清来自正常体检者并经其同意使用。
1.2方法
1.2.1Mg培养及LAMPs的提取 将Mg菌液按1∶40比例接种于PPLO改良培养基中于95%CO2、37℃恒温下培养3~4 d,培养基颜色由玫瑰红色变为清亮的橙色时,表示Mg生长已进入对数期。Mg LAMPs的提取按照参考文献进行[5],BCA法测定蛋白浓度后置于-80℃备用。Mg LAMPs在刺激前用100 μg/mL多粘菌素B处理2 h,去除可能存在的内毒素污染。
1.2.2THP-1细胞培养及LAMPs刺激 THP-1细胞在含10%胎牛血清的1640培养基中,于37 ℃、5%CO2的培养箱中培养。①在THP-1细胞加入1%正常人血清37℃孵育2 h,再用4.0 μg/mL LAMPs刺激8 h;②在THP-1细胞与10 μg/mL CD14抗体37 ℃孵育30 min,再用4.0 μg/mL LAMPs刺激8 h。
1.2.3细胞核蛋白的提取 离心收集THP-1细胞,PBS洗涤一遍,离心后弃上清,加入含PMSF的细胞浆蛋白抽提试剂A 200 μL,剧烈振荡完全悬浮,冰浴15 min后加入细胞浆蛋白抽提试剂B 10 μL,剧烈振荡后冰浴60 s,再振荡悬浮,4℃、14 000 r/min离心5 min后弃上清,再加入含PMSF的细胞核蛋白抽提试剂50 μL,剧烈振荡30 s重悬后冰浴,每隔120 s剧烈振荡30 s,共30 min,4℃、14 000 r/min离心10 min所提取的为细胞核蛋白保存至-80℃待测。
1.2.4NF-κBp65水平的测定 提取细胞核蛋白,采用ELISA法根据NF-κBp65 ELISA试剂盒操作说明书进行,其结果以每mg核蛋白提取物中含NF-κBp65的A450值表示,即A450/mg。
1.2.5共转染及NF-kB活性的测定 ①以pcDNA-CD14,pFLAG-TLR2, pNF-kB-luc及pRL-TK质粒共转染Hela细胞24 h后,再用LAMPs刺激8 h;②LAMPs用10 μg/mL sCD14 37℃共孵育30 min后,再刺激0.1 μg/mL pFLAG-TLR2,0.05 μg/mL pNF-kB-luc,0.005 μg/mL pRL-TK共转染的Hela细胞8 h。分别消化收集HeLa细胞,加入细胞裂解液200 μL,再加入100 μL萤火虫荧光素酶检测试剂,测定pNF-kB-luc的RLU值,再加入Renilla荧光素酶检测工作液100 μL,测定pRL-TK的RLU值,根据pNF-kB-luc/pRL-TK比值计算NF-kB的活化程度。
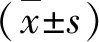
2 结 果
2.1人血清上调LAMPs激活NF-κBp65 前期研究证实Mg LAMPs能诱导THP-1细胞激活NF-κBp65[6]。在与1%人血清孵育2 h后,再以4.0 μg/mL Mg LAMPs刺激THP-1细胞8 h,ELISA结果显示人血清组NF-κBp65水平明显高于同浓度未加人血清组,并且随LAMPs浓度增加而增加,结果见图1。

图1人血清上调LAMPs激活NF-κBp65
Fig.1ActivationofNF-κBp65weresignificantlyup-regulatedinLAMPsbyhumanserum
Compared with no serum group,P<0.05.
2.2CD14中和抗体对NF-κBp65的影响 用10 μg/mL CD14中和抗体与THP-1细胞共孵育30 min,再用4.0 μg/mL LAMPs刺激8 h后,ELISA结果显示CD14中和抗体能明显降低激活的NF-κBp65水平,结果见图2。
2.3mCD14上调LAMPs激活NF-κB 以0.1~2.0 μg/mL pcDNA-CD14与0.1 μg/mL pFLAG-TLR2,0.05 μg/mL pNF-kB-luc,0.005 μg/mL pRL-TK共转染Hela细胞24 h后,再用4.0 μg/mL LAMPs刺激8 h。当pcDNA-CD14质粒浓度为1.0 μg/mL时,结果显示pNF-kB-luc/pRL-TK相对荧光比值最高,结果见图3。
2.4sCD14上调LAMPs激活NF-κB 预先用10 μg/mL sCD14与4.0 μg/mL LAMPs 37℃共孵育30 min,再刺激0.1 μg/mL pFLAG-TLR2,0.05 μg/mL pNF-kB-luc,0.005 μg/mL pRL-TK共转染的Hela细胞,8 h后pNF-kB-luc/pRL-TK相对荧光比值显示sCD14也能上调LAMPs激活NF-κB,结果见图4。
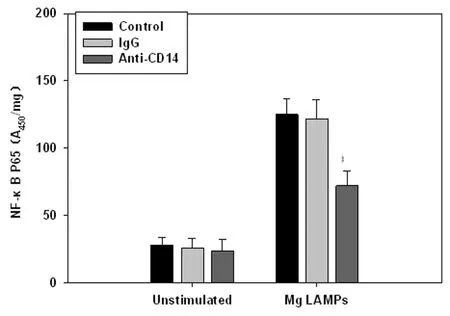
图2CD14中和抗体抑制LAMPs激活NF-κBp65
Fig.2CD14neutralizingantibodyinhibitedtheactivationofNF-κBp65inLAMPsstimulatedTHP-1cells
Compared with IgG group,P<0.05.

图3mCD14上调LAMPs激活NF-κB
Fig.3ActivationofNF-κBweresignificantlyup-regulatedinLAMPsactivatedHelacellsbymCD14
Compared with 0.5 group,P<0.05.

图4sCD14上调LAMPs激活NF-κB
Fig.4ActivationofNF-κBweresignificantlyup-regulatedinLAMPsactivatedHelacellsbysCD14
Compared with Mg LAMPs group,P<0.05.
3 讨 论
支原体广泛存在于自然界,是一类缺乏细胞壁、呈高度多形性、能通过滤菌器、可在无细胞的培养中繁殖的最小原核细胞型微生物。支原体的细胞膜是与宿主细胞相互作用的主要成分,而膜上丰富的LAMPs是影响机体炎症反应的主要蛋白。目前已证实LAMPs能诱导多种细胞分泌一系列炎症因子和诱导细胞凋亡、坏死[7]。由于其生物活性的发挥可能要通过LAMPs中多种蛋白的相互作用,因些对LAMPs的整体研究相对单个膜蛋白来说更有意义。我们前期研究发现Mg LAMPs能激活NF-κB,并且与TLR2有关[6]。NF-κB广泛存在于各种类型的真核细胞中,当机体在遭受外界病原感染时能通过识别相关分子模式引发机体相应的免疫应答反应,NF-κB信号通路诱导活化的重要作用就是通过诱导激活下游的免疫及炎性相关因子的转录表达[8]。我们结果发现,人血清能明显上调LAMPs激活NF-κB,我们推测人血清中sCD14可能在上调中发挥了一定的作用。随后用CD14中和抗体处理THP-1细胞后发现能显著抑制LAMPs激活NF-κB。这些实验表明,CD14在LAMPs激活NF-κB过程中起着重要作用。
CD14是LPS的高亲和性受体,可分为膜CD14(mCD14)和可溶性CD14(sCD14)两种,两者均在细菌性感染过程中具有重要的免疫介导作用[9]。mCD14通过糖基磷脂酰肌醇(GPI)锚定于细胞膜上,主要存在于单核细胞、巨噬细胞、树突细胞等细胞表面。sCD14结构与mCD14相似,但无GPI结构,主要存在于血清、尿液和培养mCD14阳性细胞的上清中。sCD14在血清中正常浓度为2~5 mg/mL,其来源可能是单核细胞上mCD14发生内源性酶促反应脱落或转录合成mCD14时不能PI化直接分泌入血[10]。sCD14的生物学活性与mCD14相似,也能直接与LPS结合,介导LPS所致的NF-κB[11]。Hela缺乏TLRs,但拥有NF-κB信号传导途径,有利于胞外各种刺激诱导的信号通路研究。我们通过共转染和sCD14预处理,结果发现,mCD14和sCD14均上调LAMPs激活NF-κB。
最近研究证实LAMPs的生物活性主要与其脂质成分,脂肽的、脂肪酸链的饱和程度、数量及酰化程度有关[12]。最新研究发现,CD14能结合三酰化脂肽介导免疫反应,但LAMPs中是否存在三酰化蛋白仍存在争议[13]。因此CD14上调LAMPs的具体机制还有待于更深一步研究。
参考文献:
[1]Tully JG, Taylor-Robinson D, Cole RM, et al. A newly discoveredMycoplasmain the human urogenital tract[J]. Lancet, 1981, 1(8233): 1288-1291.
[2]Horner P, Blee KAdams E. Time to manageMycoplasmagenitaliumas an STI: but not with azithromycin 1 g![J]. Curr Opin Infect Dis, 2014, 27(1): 68-74. DOI: 10.1097/QCO.0000000000000030
[3]Cazanave C, Lawson-Ayayi S, Hessamfar M, et al. Prevalence ofMycoplasmagenitaliumamong HIV-infected women, Agence Nationale de Recherches sur le SIDA et les hepatites virales CO3 Aquitaine Cohort, France[J]. Sex Transm Dis, 2013, 40(8): 653-654. DOI: 10.1097/01.OLQ.0000431360.03712.1b
[4]Zhang WB, Baseman JB. Transcriptional regulation of MG_149, an osmoinducible lipoprotein gene fromMycoplasmagenitalium[J]. Mol Microbiol, 2011, 81(2): 327-339. DOI: 10.1111/j.1365-2958.2011.07717.x
[5]Shimizu T, Kida Y, Kuwano K. Triacylated lipoproteins derived fromMycoplasmapneumoniaeactivate nuclear factor-κB through toll-like receptors 1 and 2[J]. Immunol, 2007, 121(4): 473-483.
[6]He J, Zeng YH, You XX, et al. Lipid-associated membrane proteins ofMycoplasmagenitaliumactivate NF-kappaB via toll-like receptor 2[J]. Chin J Microbiol Immunol, 2010, 30 (12): 1137-1140. (in Chinese)
何军,游晓星,曾焱华,等. 生殖支原体LAMPs经TLR2激活NF-κB[J]. 中华微生物学和免疫学杂志,2010, 30(12):1137-1140.
[7]Wu Y, Qiu H, Zeng Y, et al.Mycoplasmagenitaliumlipoproteins induce human monocytic cell expression of proinflammatory cytokines and apoptosis by activating nuclear factor kappaB[J]. Mediators Inflamm, 2008, 195427. DOI: 10.1155/2008/195427
[8]Liang Y, Zhou Y, Shen P. NF-kappaB and its regulation on the immune system[J]. Cell Mol Immunol, 2004, 1(5): 343-350.
[9]Zanoni I, Granucci F. Role of CD14 in host protection against infections and in metabolism regulation[J]. Front Cell Infect Microbiol, 2013, 3: 32. DOI: 10.3389/fcimb.2013.00032
[10]LeBouder E, Rey-Nores JE, Rushmere NK, et al. Soluble forms of Toll-like receptor (TLR)2 capable of modulating TLR2 signaling are present in human plasma and breast milk[J]. J Immunol, 2003, 171(12): 6680-6689.
[11]Kitchens RL, Thompson PA. Modulatory effects of sCD14 and LBP on LPS-host cell interactions[J]. J Endotoxin Res, 2005, 11(4): 225-229.
[12]Shimizu T, Kida Y, Kuwano K. A triacylated lipoprotein fromMycoplasmagenitaliumactivates NF-kappaB through Toll-like receptor 1 (TLR1) and TLR2[J]. Infect Immun, 2008, 76(8): 3672-3678. DOI: 10.1128/IAI.00257-08
[13]Nakata T, Yasuda M, Fujita M, et al. CD14 directly binds to triacylated lipopeptides and facilitates recognition of the lipopeptides by the receptor complex of Toll-like receptors 2 and 1 without binding to the complex[J]. Cell Microbiol, 2006, 8(12): 1899-1909.
