老鸦烟筒花的化学成分及药理作用研究进展
2014-03-29谢国勇陈月华戴轶群秦民坚
刘 慧,谢国勇,陈月华,戴轶群,秦民坚
(中国药科大学 中药资源学教研室,江苏 南京 211198)
老鸦烟筒花(MillingtoniahortensisL.) 为紫葳科(Bignoniaceae)老鸦烟筒花属(MillingtoniaL.f.)植物,单种属,又名姊妹树(思茅),“戛刹拢”(傣语),铜罗汉(临沧),烟筒花(图鉴)。老鸦烟筒花为高大乔木,生长于我国云南西南部地区海拔500~1 200 m平坝地区村寨附近,也广泛分布于越南、泰国、老挝、缅甸、印度、马来西亚及印度尼西亚、斯里兰卡等国,各地多栽培供庭院观赏。
老鸦烟筒花为我国傣族传统用药,根据中华本草傣药卷记载,老鸦烟筒花根及叶入药,具有除风解毒,消肿止痛的功效。主要治疗风寒湿痹证,肢体关节肿痛,屈伸不利;瘫痪不起;产后诸疾;咳喘[1]。而中国植物志记载老鸦烟筒花树皮入药,煎服治皮炎,亦可驱虫解毒[2]。
老鸦烟筒花全株味苦,性凉。研究报道有抗结核,抗菌,杀虫,抗突变,抗癌,抗真菌等活性[3-4]。老鸦烟筒花的花极香,可提香料[5],而且本种树体高大,枝繁叶茂,是良好的园林配置树种,也可作庭园观赏树[6]。老鸦烟筒花也具较高的药用价值,花蕾用于治疗哮喘,鼻窦炎,并有利胆功效,可添加到烟草中治疗吸烟引起的咽喉疾病。烟筒花的树干可润肺补虚,止咳化痰。其树皮的提取物用作黄色染料。烟筒花的叶和根具有抗哮喘和抗菌活性[7]。树皮和叶用于治疗皮肤过敏,并有驱虫解毒、止咳祛痰之效[8]。
1 植物形态
直立乔木,高达20~25 m。树皮粗糙,栓皮状。叶对生,2~3回羽状复叶,长达30 cm左右,小叶幼时有齿,卵形,纸质,长5~7 cm,宽2~4 cm,顶端长渐尖,基部阔楔形至圆形,偏斜,两面近光滑无毛;侧脉4~5对;小叶柄长达1 cm,侧生小叶有时近无柄;通常为全缘。圆锥花絮多花,顶生于下垂的枝上,径达2.5 cm;花萼很小,5裂齿,钟状或杯状,长宽约3 mm,顶端近平截;花冠白色,管极长,约3~5.5 cm,径2~3 mm,花冠裂片5,宽大,卵状披针形,长约1.5 cm,内面边缘密被极细柔毛;雄蕊4,2长2短,着生于花冠喉部,微伸出花冠管外;花柱细长,柱头舌状扁平,2裂,微伸出花冠管外,子房长圆柱形,无柄,有胚珠数列。蒴果细长,线形。种子蝶状,有阔翅。花期10~12月[1]。
2 化学成分
2.1 黄酮类(Flavonoids)及其糖苷类化学成分
老鸦烟筒花的花中含有丰富的黄酮类化合物,这些黄酮类物质在植物的生长、发育、开花、结果以及抗菌防病等方起着重要的作用,也是老鸦烟筒花的主要化学成分。花含高山黄芩素(scutellarein),高山黄芩素-5-半乳糖苷(scutellarein-5-galactoside)[9],滨蓟黄素(cirsimaritin)[10],粗毛豚草素(hispidulin)[11]。叶含粗毛豚草素-7-芸香糖苷(hispidulin-7-rutinoside),有文献报道[12]老鸦烟筒花的花中有一种黄酮类化合物,命名为烟筒花素(hortensin),结构为3,4’-二羟基-6,7-二甲氧基黄酮。后经学者Takeshi Hase修订[13],该化合物为5,7-二羟基-6,4’-二甲氧基黄酮,即柳穿鱼黄素(pectolinarigenin)。黄酮类化合物具有很强的生物活性,如粗毛豚草素具有抗肿瘤,镇咳和祛痰作用;高山黄芩素具有抑制酶活性和幼虫生长的作用;滨蓟黄素具有抗肿瘤,抗菌,解痉的作用。
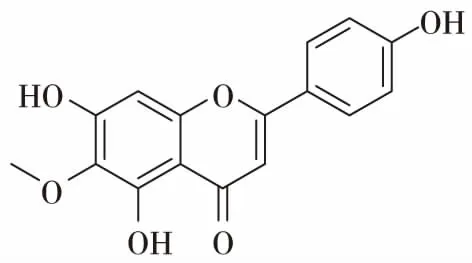
粗毛豚草素(hispidulin)
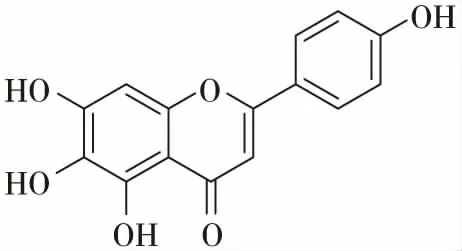
高山黄芩素(scutellarein)
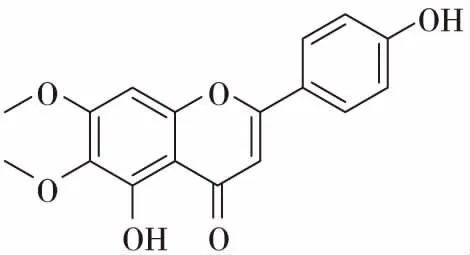
滨蓟黄素(cirsimaritin)
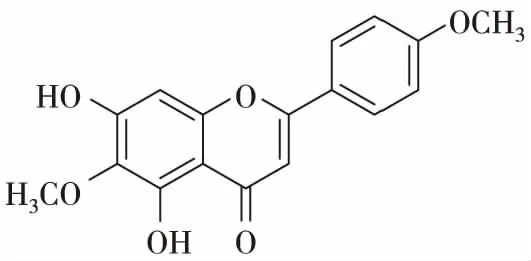
柳穿鱼黄素(pectolinarigenin)
2.2 生物碱类(Alkaloids)及其糖苷类化学成分
Takeshi Hase[14]首次从老鸦烟筒花的花蕾中提取出烟筒花碱苷(millingtonine),该化合物为该植物的特征性成分。通过化学色谱法对其结构进行鉴定,发现烟筒花碱苷是一个独特的外消旋三环皂苷,靠外的两个环与中间的环成反式构型,末端为D-β型糖苷键[15]。
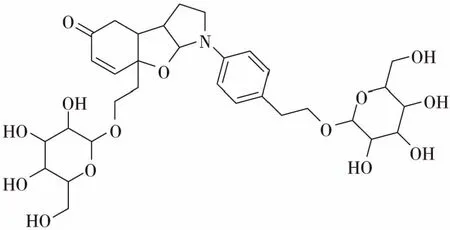
烟筒花碱苷(millingtonine)
2.3 环己乙醇类化合物(cyclohexylethanoids)及其糖苷类化学成分
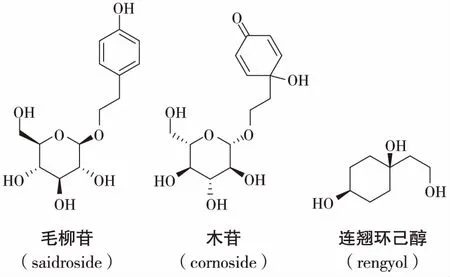
老鸦烟筒花的花中还含有丰富的环己醇类化合物,如梾木苷(cornoside),连翘环己醇酮(rengyolone),连翘环乙醇苷A,B (rengvoside A,B) ,连翘环己醇(rengyol), 异连翘环己醇(isorengyol),8-O-β-D-异连翘环己醇吡喃葡萄糖苷(8-O-β-D-glucopyranosyl isorengyol)等[16],从花中分离得到了反式-1-(2-羟基乙基)环己烷-1,4-二醇(trans-l-(2-hydroxyethyl)cyclohexane-l,4-diol)[17]等。
2.4 苯乙醇苷类化合物(phenylethanoid glycosides)
另外,国外众多学者还从老鸦烟筒花的花芽中分离到了一些苯乙醇苷类化合物,如毛柳苷(saidroside)[18]、2-苯乙基芸香糖苷(2-phenethyl rutinoside)[19]、2-(3,4-二羟基)苯乙基葡萄糖苷(2-(3,4-dihyd-roxyphenyl)-ethyl glucoside)[20]、麦角甾苷(类叶升麻苷,毛蕊花糖苷)(acteoside)[21]等。2-(3,4-二羟基)苯乙基葡萄糖苷为首次从该植物中分离得到。
2.5 苯丙素苷类(phenylpropanoid glucosides)
Nakano[22]等从老鸦烟筒花的花芽中分离得到了2种苯丙素苷类化合物。对-香豆醇葡萄糖苷(p-coumaryl alcohol glucoside)和异丁香油酚葡萄糖苷(isoeugenol glucoside),增添了该植物中化合物的类型。
2.6 三萜类化合物(triterpenes)
Dinda[23]等还从老鸦烟筒花的花芽中分离得到了齐墩果酸(Oleanic acid),熊果酸(Ursolic acid),二十九碳酸(nonacosanoic acid)等三萜类化合物。
2.7 其他类化合物
除以上所述化合物类型外,老鸦烟筒花的根还含三十一烷(hentriacontane)、 1-三十一烷醇(l-hentriacontanol)、泡桐素(paulownin)、拉杷醌醇(lapachol)、β-谷甾醇(β-sitoterol)[24],及β-胡萝卜素(β-carotene)等化合物。其中拉杷醌醇具有抗肿瘤(大白鼠Walker肉瘤和鼠P388瘤),抗疟疾,抗微生物,抗锥体虫等活性;泡桐素具有杀虫作用,对流感病毒有一定的抑制作用。
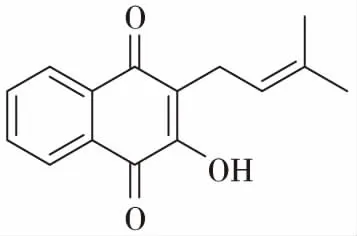
拉杷醌醇(lapachol)

泡桐素(paulownin)
3 药理活性
老鸦烟筒花不仅为我国傣族传统用药,在东南亚国家如泰国及印度等均有悠久的用药历史,当地人用其来治疗哮喘、鼻窦炎,亦用来驱虫解毒。在泰国,人们把花用于香烟制造中,产生的香气可放松人的神经;把花瓣提取的精油用于最近流行的芳香精油按摩治疗中,很受人们的欢迎。
3.1 止喘作用
由于老鸦烟筒花干燥花蕾甲醇提取物对离体小鼠气管有扩张作用,Anulakanapakorn K等便将老鸦烟筒花干燥花蕾甲醇提取物经过萃取分为石油醚、氯仿、正丁醇和水四个部位,其中氯仿部位显示出了最强的支气管扩张活性。通过柱层析等方法分析氯仿部位化学成分,从中分离得到了粗毛豚草素,该化合物也是致使支气管扩张的主要成分。在同样的摩尔量下,粗毛豚草素比氨茶碱活性更高。因此,他们推断老鸦烟筒花具备抗哮喘作用是由于粗毛豚草素的存在[25]。
3.2 抗菌作用
Jetty[26]等研究表明,老鸦烟筒花叶子的提取物对20种不同的细菌株和2种酵母菌具有良好的抗菌活性。用含水乙醇提取其叶子,以现有的抗生素如庆大霉素和制霉菌素为阳性对照品,老鸦烟筒花叶提取物对该实验中所测的所有微生物都有很好的活性,尤其对大肠杆菌和鼠伤寒沙门菌,所有革兰阴性菌的MIC值为6.25 μg/mL。
另有研究表明[27],低浓度的老鸦烟筒花花瓣的精油具有广谱抗菌素作用。蒸馏法提取老鸦烟筒花的花瓣中的精油,并用其做抗菌试验。实验结果表明,该植物花的精油对琼脂上的10种菌种中的6种有抑制其扩散的作用。这6种菌种分别为:4种革兰氏阳性菌:金黄色葡萄球菌(S.aureusATCC 25923),表皮葡萄球菌(S.epidermidisATCC12228),枯草杆菌(B.subtilisATCC6633)和植物乳杆菌(L.plantarumATCC14917)和2种革兰氏阴性菌:大肠杆菌(E.coliATCC25922)和普通变形糖菌(P.vulgarisATCC13315)。其最小抑制量分别为0.5~2 mL/L和1~4 mL/L。以上实验均证实了老鸦烟筒花提取物具有抗菌活性。
3.3 消炎作用
学者从老鸦烟筒花的花中提取得到了粗毛豚草素,经实验证明该化合物有抗炎作用。将粗毛豚草素与1-14C-花生四烯酸和含有5-脂加氧酶的猪白细胞混悬液共同孵育,结果表明粗毛豚草素对5-脂加氧酶有显著抑制作用。当粗毛豚草素的浓度为64 μmol/L时,对5-脂加氧酶的抑制率为65%[1]。这些数据说明老鸦烟筒花的花具备一定的抗炎活性。
3.4 抗癌作用
Tansuwanwong S[28]等研究表明:老鸦烟筒花的水提物可通过诱导细胞凋亡的途径来抑制结肠癌细胞RKO的增殖。用MTT法(单核细胞直接细胞毒性测定)来测定RKO细胞的活性,凋亡细胞用流动细胞计数法和DNA碎片法检测。从实验结果中可发现水提物抑制RKO细胞的生长和增值,凋亡细胞数量与水提物浓度成正比。当用药48 h后DNA碎片数目随着剂量的升高(200、300和400 mg/mL)呈梯度上升。此外,在体外对人体鼻咽癌(KB)细胞有细胞毒性,其ED50为96 μg/mL。
3.5 抗突变作用
通过对沙门氏菌的测试,从老鸦烟筒花中提取的两个黄酮类物质粗毛豚草素和柳穿鱼素在最高剂量100 μg/板的时候具有抗鼠伤寒沙门菌中AFB1诱导的突变的性质,且对菌细胞没有细胞毒性[29]。另外,这两种黄酮类成分,粗毛豚草素和柳穿鱼素可抑制由2-氨基蒽和黄曲霉霉素B1(AFB1)和二甲基亚硝胺引起的突变。说明老鸦烟筒花中的化学成分对间接因素和直接因素引起的突变均能起抑制作用[8]。但是,二者分别在沙门氏菌TA98及TA100中对(2-呋喃)-3-(5-硝基-2-呋喃) 丙烯酰胺和叠氮钠均没有致突变活性。
3.6 抗惊厥作用
Dominique[30]等对粗毛豚草素对中枢神经系统的调节活性进行了研究。老鸦烟筒花中的一个有效成分,粗毛豚草素,是苯二氮卓类(BZD)受体配体,可调制中枢神经系统活性。利用非洲爪蟾卵母细胞表达的重组GABAA/BZD受体,进行粗毛豚草素的药理研究。与地西泮对照,粗毛豚草素调制α1β2γ2S-GABAA受体亚型。在蒙古长爪沙鼠癫痫模型中,动物发作后第7天用10 mg/(kg体重·d)粗毛豚草素和2 mg/(kg体重·d)地西泮处理可降低患癫痫动物数目。通过大鼠原位灌注模型证实了14CS-标记的粗毛豚草素具备渗透性,可穿过化学合成的血-脑屏障。其吸收率为1.14 mL/(min·g),与高穿透力的地西泮接近。该实验结果证明了老鸦烟筒花的有效成分具备抗惊厥作用。
3.7 驱蚊作用
Kaushik[31]等人对老鸦烟筒花的叶提取物的驱虫作用进行了研究。针对Anophelesstephensi,Culexquinquefasciatus和Aedesaegypti这3种蚊子,作者用不同浓度的老鸦烟筒花叶提取物进行驱虫实验,根据艾伯特方程计算致死率,用统计学的方法分析结果的显著性差异。结果表明,老鸦烟筒花叶提取物对这3种蚊属均显示出了良好的驱虫性,致死率均在90%以上。这是首次老鸦烟筒花对蚊科有驱虫活性的报道。研究表明:老鸦烟筒花的叶的提取物对这3种蚊虫有明显的抑制作用,从而一定程度上抑制了疟疾、淋巴丝虫病、乙型脑炎(JE)和登革/登革出血热(DF/DHF)等病的传播。
3.8 驱肠虫作用
Nagaraja[32]等人研究了老鸦烟筒花树皮不同部位提取物对成年地龙Pheretimaposthuma的抗肠虫活性,以驱蛔灵为对照品。在测试的提取物中,甲醇部位显示出了呈剂量依赖性的抗肠虫作用,且比对照品活性更高。氯仿和苯部位提取物在20 mg/mL的浓度下与对照品在60 mg/mL浓度下显示出相似的活性。水部位没有活性。这可能与不同部位中存在的甾类、黄酮及单宁等物质有关。
3.9 治疗糖尿病作用
印度Lohit District of Arunachal Pradesh当地民族用于治疗糖尿病。因此,Tag等人调查了46种印度当地草医用来治疗糖尿病的植物,利用啮齿类动物模型进行试验,并分析大量文献后确定11种植物具有治疗糖尿病的疗效,其中包括老鸦烟筒花。该研究说明了老鸦烟筒花具有抗糖尿病作用,但没有足够的临床证据来说明其有效性[33]。
4 展 望
老鸦烟筒花作为我国云南西双版纳傣族的传统用药,具有丰富的药理活性,在东南亚国家得到了广泛的应用,尤其是印度当地将其用于治疗哮喘、鼻窦炎等疾病用药历史悠久。但国内关于老鸦烟筒花的化学成分和药理作用及其机制方面的报道很少,为了明确老鸦烟筒花药效物质基础,弥补国内对其研究的空白,我们在研究其化学成分和生物活性方面仍需做大量的工作,希望能通过进一步的研究中发现其新的药用价值,使其资源得以充分利用,为人类健康事业作出贡献。
参考文献:
[1] Cha H, Zhan W T.中华本草之傣药卷[M].上海:上海科学技术出版社,1999:271.
[2] 中国科学院中国植物志编辑委员会.中国植物志:第10卷[M].北京:科学出版社,2004:547.
[3] Gamble J S. Flora of the Presidency of Madras[M]. Calcutta: Botanical Survey of India, 1957,9: 699.
[4] Hooker, Dalton J. The Flora of British India[M]. England: L. Reeva and Co,1954,4:376.
[5] 中国科学院昆明动物研究所.云南南部红河地区生物资源科学考察报告种子植物[M].昆明:云南民族出版社,1987:170.
[6] Sun J W.园林树木学[M].上海:上海交通大学出版社,2003,8:253.
[7] Nagaraja M S, Paarakh P M.MilingtoniahortensisLinn.-a review.[J].Pharmacology-online,2011(2):597-602.
[8] Liu S L, Zhao J M.云南德宏州高等植物:下册[M].北京:科学出版社,2009,11:1007.
[9] Sharma R C, Zaman A, Kidwai A R. Chemical examination of Millingtonia hortensis[J]. Phytochemistry,1968,7:1891-1892.
[10] Nair A G R, Shivakumar R. Non-identity of hortensin fromMillingtoniahortensisiswith 3, 4’-Dihydroxy-6, 7-Dimethyl flavone[J].Phytochemistry,1992,31(2):671-673.
[11] Rastogi R P, Mehrotra B N. Compendium of Indian Medicinal Plants[J]. Lucknow:Central Drug Research Institute,1980,3:429.
[12] Bunyapraphatsara N, Blasko G, Cordell G A.. Hortensin, An Unsual Flavone FromMillingtoniahortensisis[J]. Phytochemistry,1989,28:1555-1556.
[13] Hase T, Ohtani K, Kasai R, et al. Revised Structure For Hortensin, A Flavonoid FromMillingtoniahortensisis[J]. Phytochernistry,1995,40:287-290.
[14] Takeshi H, Kazuhiro O, Ryoji K, et al. Millingtonine, An unusual Glucosidal Alkaloid FromMillingtoniahortensis[J]. Phytochemistry,1996,41(1):317-321.
[15] Wegner J, Steven V. Ley, Andreas Kirschning, et al. A Total Synthesis of Millingtonine A[J]. Organic Letters,2012,14(3):696-699.
[16] Takeshi H, Yuka K, Kazuhiro O. Cyclohexylethanoids and Related Glucosides from Millingtonia hortensis[J]. Phytochemistry,1995,39(1):235-241.
[17] Naowsaran K, Skelton B W, Tooptakong U, et al. Constituents ofMillingtoniahortensis: Isolation and Crystal Structure of trans-1-(21-Hydroxyethyl) cyclohexane-1,4-diol[J]. Australian Journal of Chemistry,1989,42(8)1397-1401.
[18] Schwab W, Schreier P. Aryl β-d-glucosides fromCaricapapayafruit[J]. Phytochemistry,1988(27):1813-1816.
[19] Umehara K, Hattori T, Ueno A, et al. Studies on the constituents of leaves ofCitrusunshiuMarcov[J]. Chem Pharm Bull,1988(36):5004.
[20] Kikuchi Masao, Yamauchi Yoko, Sugiyama Masataka. Structural analysis on the constituents of Syringa species. VII. Structures of phenylethanoid glycosides from leaves of Syringa vulgaris Linn[J]. Tohoku Yakka Daigaku Kenkyu Nempo,1988(35):113-118.
[21] Matsumoto M, Koga S, Shoyama Y, et al. Phenolic glycoside composition of leaves and callus cultures ofDigitalispurpurea[J]. Phytochemistry,1987(26):3325-3227.
[22] Nakano K, Nishizawa K, Takemoto I, et al. Flavonol and phenylpropanoid glycosides fromLiliumcordatum[J]. Phytochemistry,1989(28):301-303.
[23] Dinda B, De U C, Bhattaharya A, et al. Chemical constituents ofargyreiaargentea,MillingtoniahortensisandPyrostegiavenusta[J]. Journal of the Indian Chemical Society,2002,79(3):291-229.
[24] Rastogi R P, Mehrotra B N. Compendium of Indian Medicinal Plants[M]. Lucknow:Central Drug Research Institute,1980(3):429.
[25] Anulakanapakorn K, Nuntavan P, Jutamaad S. Phytochemical and Pharmacological studies of the flowers ofMillingtoniahortensisLinn.[J]. Journal of Sciences Soc,1987,13:71-83.
[26] Jetty A, Iyengar D S. Antimicrobial activity ofMillingtoniahortensisleaf extract[J]. Pharm Biol,2000,38(2):157-160.
[27] Sittiwet C. AntiMicrobial Activities ofMillingtoniahortensisLinn. Flowers Essential Oil[J]. Journal of Pharmacology and Toxicology,2009,4(1):41-44.
[28] Tansuwanwong S, Hiroyuki Y, Kohzoh I, et al. Induction of apoptosis in RKO colon cancer cell line by an aqueous extract ofMillingtoniahortensis[J]. Asian Pac J Cancer Prev,2006,7(4):641-644.
[29] Chulasiri M, Bunyapraphatsara N, Moongkarndi P. Mutagenicity and antimutagenicity of hispidulin and hortensin, the flavonoids fromMillingtoniahortensisL.[J]. Emliron Mol Mutagen,1992,20:307-312.
[30] Dominique K, Sand P, Youdim K A, et al. The flavone Hispidulin, a benzodiazepine receptor ligand with positive allosteric properties, traverses the blood brain barrier and exhibits anticonvulsive effects[J]. British Journal of Pharmacology,2004,142(5):811-820.
[31] Kaushik R, Saini P. Larvicidal activity of leaf extract ofMillingtoniahortensisagainst Anopheles. stephensi, Culex quinquefasciatus and Aedes aegypti[J]. Vector Borne Dis,2008,45(1):66-69.
[32] Nagaraja M S, Paarakh P M. In vitro anthelmintic activity of stem bark ofMillingtoniahortensisLinn.[J]. Int J of Pharma and Bio Sciences 2011,2(2):15-19.
[33] Tag H, Kalita P, Dwivedi P, et al. Herbal medicines used in the treatment of diabetes mellitus in Arunachal Himalaya, northeast, India[J]. J Ethnopharmacol,2012,141(3):786-795.
