从教材到教学的研究——以“共价键”为例
2014-03-28卓高峰魏樟庆
卓高峰魏樟庆
(1浙江省乐清市第三中学浙江乐清325600;2浙江省乐清中学浙江乐清325600)
苏教版《化学2》专题1“微观结构与物质多样性”,从原子核外电子排布入手,介绍了元素周期律,引入到微粒间的相互作用,最终从微观结构层次上认识物质的多样性。“共价键”属于微粒间的相互作用力,了解微粒间存在的相互作用力,可以帮助学生认识原子是怎样构成物质,学会从化学键的角度认识化学反应,帮助学生建立物质多样性与微观结构的关系的基本观念。
一、三套教材中共价键内容的编排特点
1.鲁科版《化学2》教材中共价键内容的编排特点
鲁科版《化学2》第2章“化学键与化学反应”,其中第1节“化学键与化学反应”包括两部分内容:化学键与化学反应中的物质变化和化学键与化学反应中的能量变化。教学次序为:化学键→离子键→共价键→离子化合物与共价化合物→化学键与化学反应中的能量变化。
化学反应伴随着物质变化与能量变化,教材通过分析电解水的本质是旧化学键的断裂、新化学键的形成,再分析氢气、氯气生成氯化氢,解释氢原子、氯原子为什么能结合形成氯化氢分子,建立“共价键是原子间通过共用电子对形成的化学键”的基本概念,渗透化学反应与共价键(化学键)之间的关系。
2.人教版《化学2》教材中共价键内容的编排特点
人教版《化学2》第1章“物质结构元素周期律”,其中第3节“化学键”包括两部分内容:离子键和共价键。教学次序为:离子键(离子化合物)→共价键(共价化合物)→化学键→分子间作用力和氢键(科学视野)→化学键与化学反应中能量的变化关系(另一章节)。
元素的原子通过相互作用形成丰富多彩的物质,教材分析H、Cl的原子结构,解释H2、Cl2、HCl的形成,建立“共价键是原子间通过共用电子对所形成的相互作用”的基本概念,最后用化学键的观点解释化学反应。
3.苏教版教材中共价键内容的编排特点
苏教版《化学2》第1章“微观结构与物质的多样性”,其中第2单元“微粒之间的相互作用力”包括三部分内容:离子键、共价键和分子间作用力。教学次序为:化学键→离子键(离子化合物)→共价键(共价化合物)→分子间作用力→氢键(拓展视野)→化学反应中的热量变化(专题2内容)。
构成物质的基本微粒有原子、分子、离子等,这些微粒通过一定的相互作用力彼此结合。由微粒之间的相互作用,导入离子键、共价键、分子间作用力。教材以形成氯化氢为例,两种非金属元素相互化合时,形成共用电子对,共用电子对会受到原子核的吸引,建立“共价键是原子间通过共用电子对所形成的强烈的相互作用”的基本概念,强调物质的微粒性以及微粒之间的相互作用,淡化化学反应与化学键的关系。
二、“共价键”教学案例分析
公开发表的有关“共价键”的教学设计并不多,出现较多的都只是教学片断。姚淑霞老师的教学设计《化学键概念教学的创新尝试》曾发表在《化学教学》2009年第7期,在化学键的教学中,用比较法对“共价键”的教学做了较好的设计。教学思路如下:
(1)创设情境,提出问题。呈现各种各样物质的图片,提出以氯元素为例,氯可以形成哪些物质?
(2)探究氯原子达到稳定结构的可能途径:电子得失、形成共用电子对。
(3)比较法形成离子键和共价键概念。从原子达到稳定结构的可能途径→形成离子键的过程→形成共价键的过程→比较离子键和共价键的形成→深化离子键和共价键的概念。
(4)提出化学键概念。
其中,对共价键概念的形成教学细节如下:
[提出问题]氢原子和氯原子结合形成氯化氢的微观过程是怎样的?怎样用电子式表示氯化氢分子?怎样用电子式表示氢原子和氯原子结合形成氯化氢分子的微观过程?
[引导学生概括]在氢原子和氯原子之间不能发生电子得失。从微观角度看,氢原子和氯原子化合时,它们各拿出一个最外层电子共用,形成一对共用电子对,从而结合在一起。这种相互作用属于共价键。
[师生小结]

?
本案例中选择学生熟悉的氯为例,把离子键的形成和共价键的形成整合成一节课。在一般的教学中,第一课时学习离子键,第二课时再学习共价键。而通过这样整合的教学,能够把离子键的学习成果及时地迁移到共价键的学习中去,易于比较离子键和共价键的异同点,当堂为学生提供主动学习的机会,使教学逻辑更加鲜明,也使教学时间更加节约。
三、“共价键”教学论问题分析
1.两种认知观点
一是认为物质是微粒构成的,微粒之间存在相互作用力。虽然学生在初中的自然科学中对物质的构成微粒有一定的认知基础,但对微粒间的相互作用缺少深层次的理解。苏教版《化学2》举例2个氯原子为什么能结合成1个氯分子,1个氯原子和1个氢原子为什么能结合成1个氯化氢分子,然后将共价键的概念固着在原子核和共用电子对上,当原子形成共价键时,是原子最外层电子发生了重排,建构“共价键是原子间通过共用电子对所形成的强烈的相互作用”的基本观念。
二是认为化学反应是微粒的重组及微粒间相互作用力的变化。鲁科版《化学2》认为化学反应是旧化学键的断裂与新化学键的形成的过程,以电解水为例,电解时基本微粒发生变化,同时化学键也发生变化,构建化学键与化学反应的基本观念。
2.学生认识发展障碍点分析
(1)如何让学生建立“构成物质的微粒及微粒间的相互作用”这一认识
高一学生已经了解了物质是由分子、原子、离子构成的,知道化学反应的本质是分子再分、原子重新组合,但并不清楚分子再分、原子重新组合的原因,并不清楚这些微粒之间是通过怎样的相互作用构成物质的。换言之,学生从宏观组成上已经认识了一些无机物,但从微观角度还不清楚这些物质中存在的微粒形式和相互作用。[4]
对于氯化氢是由什么微粒构成,多数认为氢离子和氯离子(根据氢氯的化合价或从氯化氢在水中能电离出氢离子和氯离子判断)、氢原子和氯原子,不知道它是由氯化氢分子构成。如果对氯化氢的微粒构成不清楚,学生就无法准确理解共价键的作用方式以及共价化合物的形成过程。
(2)如何让学生理解原子对共用电子对的作用
氯化钠晶体中,钠离子与氯离子为什么能牢牢地结合在一起?学生容易从离子键的定义中得出结论:阴阳离子间的静电作用?(容易错误地理解为静电吸引)。但在氯化氢分子中氢原子和氯原子为什么能牢牢地结合在一起?学生从共价键文字表述中很难理解“原子对共用电子对的作用”。是因为没有从微粒的电性思考问题:共用电子对带负电荷、原子核带正电荷,从而有静电作用,产生键能和键长(原子核间的距离)。
学生在学习共价键时,还可能会对共用电子对的理解出现困难,氢和钠都在IA族,最外层都只有一个电子,为什么氢原子不容易失去电子,而是以共用电子对的方式结合形成化合物呢?需要帮助学生解决共价键的形成条件。
四、基于观念建构的教学设计
1.以观念建构为本的教学内容分析
“微粒观”是本节内容的核心观念,物质是微粒构成的,微粒之间存在相互作用力;化学反应是微粒的重组及微粒间相互作用力的变化。知识间的层级关系如下:
2.以观念建构为本的教学设计
以苏教版《化学2》专题1第二单元“共价键”为例(片段)。
[问题引入](1)写出H、Na、Cl三种元素在元素周期表的位置及原子结构示意图。
(2)写出由这3种元素组成的物质及其构成微粒。

?
设计意图:重点考查构成物质的微粒。因为物质的微粒构成是学习化学键的基础,也是能否学好共价键的关键因素。
[讨论1]钠原子与氯原子如何形成氯化钠?钠离子与氯离子为什么能牢牢地结合在一起?
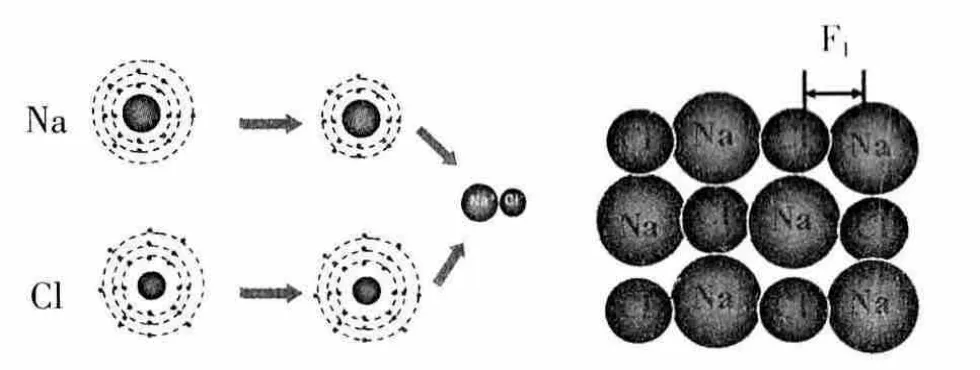
回忆:当钠原子与氯原子相遇时,钠原子容易失去最外层的1个电子,成为带正电的钠离子,而氯原子容易得到1个电子,成为带负电的氯离子,这两个阴、阳离子通过静电作用,形成了氯化钠晶体。图示的作用力F1就是离子键。
设计意图:以氯化钠为例,理解离子键是阴阳离子的静电作用,离子键是一种用力。并将离子键的学习成果及时地迁移到共价键的学习中去,为学习共价键做好方法铺垫。
[讨论2](1)氢原子与氢原子如何形成氢分子?氢分子中两个氢原子为什么能牢牢地结合在一起?
(2)氢原子核带什么电荷,共用电子对带什么电荷?共价键的本质是什么?
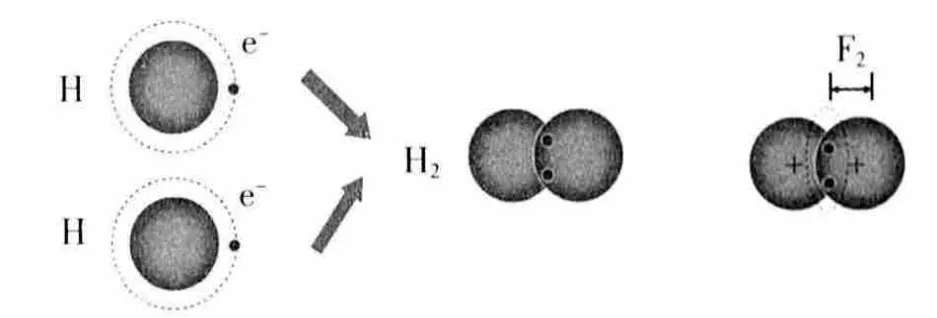
(3)氢原子和氯原子为什么可以形成氯化氢分子?
(4)哪些元素可以形成共价键?成键微粒是什么?它们是如何成键的?
设计意图:以H2为例,深刻理解共价键是带正电的原子核与带负电的共用电子对之间的静电作用,包括原子核与原子核之间的相互作用、电子与电子之间的相互作用,还有原子核与共用电子对之间的相互作用,共价键也是一种作用力。并以H2为例,推广到其它非金属原子形成共价键的过程,从而归纳共价键的本质、成键元素、成键微粒。
[归纳]共价键的形成?
五、讨论及建议
苏教版《化学2》专题1中“共价键”的内容主要包括共价键的概念,共价分子的类型与表示方法,淡化了从微观角度即从化学键角度认识化学反应。教材中以氯化氢分子为例形成共价键概念,在氯化氢的形成过程中,氢原子从哪里来?氯原子从哪里来?化学反应的本质又是什么?未做进一步的阐述,若在教学中立足在生成氯化氢本质的层面略加扩展,就能够帮助学生更好更完整地从微粒观角度理解化学反应。
教材对共价键表示方法的学习,主要是停留在能够用电子式表示共价分子的结构的层面上。虽然通过介绍典型分子(如HCl、Cl2、H2O、NH3、CH4)的电子式、结构式、球棍模型和比例模型,让学生们能够体会到原子为了形成稳定结构,原子间通过共用电子对而形成静电作用的形式。对于自然界中丰富多彩的物质结构形式,这样的认识依旧是具体而零散的,缺乏对原子形成物质的过程中的基本结构形式的整体认识。在教学过程中,如果能将“共价键”教学的立足点在原有的基础上再向原子组合形成宏观物质的行为层面略加扩展,即从典型分子(如HCl、Cl2、H2O、NH3、CH4)的结构解释中抽取出常见原子(C、N、O、H和卤素原子)在形成共价键时的基本成键方式、基本几何构型,更能让学生从微粒观的角度感受到这种结合方式是物质世界中最基本的结构形式。
[1]王磊.普通高中课程标准实验教科书:化学2(必修)[M].北京:山东科技出版社,2006
[2]宋心琦.普通高中课程标准实验教科书:化学2(必修)[M].北京:人民教育出版社,2006
[3]王祖浩.普通高中课程标准实验教科书:化学2(必修)[M].南京:江苏教育出版社,2006
[4]张琦,谷黎芳,韩雪,杨艳红.化学键概念的学生调研及教学策略[J].化学教育,2012,(2):12-15
[5]姚淑霞.化学键概念教学的创新尝试[J].化学教学,2009,(7):51-54
[6]江敏.感受自然界的魅力—“共价键”的教学实践与思考[J].中学化学教学参考,2011,(8):16-20
