当归苯丙氨酸解氨酶基因片段克隆和组织特异性表达分析
2014-03-26雒军王引权温随超李静张金林夏琦
雒军,王引权*,温随超,李静,张金林*,夏琦
(1.甘肃中医学院药学院,甘肃 兰州730000;2.甘肃省高校中(藏)药化学与质量研究省级重点实验室,甘肃 兰州730000;3.兰州大学草地农业科技学院,甘肃 兰州730020)
当归(Angelicasinensis)为伞形科当归属草本植物,以干燥根入药,具有补血活血,调经止痛,润肠通便等功效,为临床常用药[1]。甘肃是当归主产区,年栽培面积和总产量都占全国90%以上,当归适宜栽培在2000~2800 m海拔的高寒阴湿地带[2]。目前对当归栽培模式、当归生理特征、药材品质和产量形成进行了许多研究,王慧珍等[3]报道连作当归比轮作当归的挥发油含量、叶片光合色素含量和光合特性显著降低,进而导致产量和品质下降;王田涛等[4]研究发现当归/大蒜(Alliumsativum)间作能提高当归产量和优等品比率,并能降低当归麻口病发病率;邱黛玉等[5]报道当归种苗的大小影响生长过程中当归茎叶和根部蛋白质、游离氨基酸、可溶性糖含量的变化,进而影响成药期抽苔率,但对当归药效成分生物合成及其代谢调控的分子生物学机理尚未开展过系统研究。
阿魏酸(ferulic acid,FA)是当归药材中含量较高的水溶性活性成分,为《中国药典》规定的当归质量控制指标之一[6]。现代药理研究表明,FA具有明显抗动脉粥样硬化,抗血小板凝集和血栓,清除亚硝酸盐、氧自由基、过氧化亚硝基,抗菌消炎,抗肿瘤,抗突变,增加免疫功能等作用[7]。FA为苯丙烷代谢途径生成的中间产物之一,其主要生物合成途径是由苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)催化L-苯丙氨酸(L-Phe)生成反式-肉桂酸(t-CA),肉桂酸-4-羟基化酶(C4H)催化反式-肉桂酸生成对-香豆酸(p-Coumaric acid),对-香豆酸经香豆酸-3-羟基化酶(C3H)作用生成咖啡酸(caffeic acid),再以甲硫氨酸(S-腺苷-L甲硫氨酸)为甲基供体,在咖啡酸-O-甲基转移酶(COMT)的催化下生成阿魏酸(FA)[8-9]。PAL催化L-苯丙氨酸(L-Phe)生成反式-肉桂酸(t-CA),是苯丙烷代谢的第一步反应,也是其中的关键步骤之一[10]。目前有多种植物的PAL已经得到克隆,在药用植物中有朝鲜当归(Angelicagigas)[11]、皱波天竺葵(Pelargoniucrispum)[12]、金银花(Lonicerajaponica)[13]、黄芩(Scutellariabaicalensis)[14]、紫草(Lithospermumerythrorhizon)[15]、黄芪(Astragalusmembrana-ceus)[16]和丹参(Salviamiltiorrhiza)[17]等,但尚未有当归PAL研究的报道。本研究的重点在于用RT-PCR方法克隆当归代谢相关PAL片段、进行序列分析,并运用实时荧光定量PCR分析其在当归不同组织的特异性表达,为进一步获得当归PAL全长及其阐明FA的生物合成与制定调控策略提供理论基础。
1 材料与方法
1.1 材料
当归植株于2013年8月采自甘肃岷县茶埠镇试验基地(海拔2780m,东经104°06′,北纬34°29′)。田间挖取当归全株,立即装入干冰泡沫箱中,于当日带至实验室后迅速用去离子水冲洗干净,并将根、茎、叶组织分离后用液氮迅速冷冻后,保藏于-80℃超低温冰箱,用作RNA提取材料。大肠杆菌(Escherichiacoli)DH5α菌株由本实验室保存。
采用的分子生物学试剂主要包括:RNA提取试剂十六烷基三甲基溴化铵(CTAB)、LiCl和聚乙烯吡咯烷酮360(PVP-360)为美国Sigma产品,cDNA 合成试剂盒(TaKaRa,大连),Taq DNA Polymerase(Thermo,美国)、PCR产物回收试剂盒(TransGen,北京)、PCR 产物克隆试剂盒(Promega,美国),DNA Marker(TransGen,北京),SYBR Green荧光定量试剂盒(Promega,美国),其他生化试剂均为进口或国产分析纯产品。
1.2 引物设计与合成
通过对GenBank中皱波天竺葵(X81159)、朝鲜当归 (HM114215)、胡萝卜(Daucuscarota)(AB435640)和拟南芥(Arabidopsisthaliana)(NM_001203294)等植物PAL编码基因CDS序列进行同源比对,找出高度保守区段,利用Primer 6.0生物软件设计一对扩增引物(P1,P2),用于扩增当归PAL片段。P1:5′-GCTGAACAGCACAATCAAGATGT-3′,P2:5′-GTTAACAGATTGGAAGAGGAGCAC-3′。
参照克隆并测序的当归PAL片段序列,利用Primer 6.0生物软件设计一对用于PAL荧光定量PCR检测的特异引物(P3,P4),扩增长度为119bp。P3:5′-GTGTCAACGGTGAGCTCCAT-3′,P4:5′-GCATCAATGGGTAGGTTGCG-3′。参照当归Actin片段序列[18],设计一对荧光定量PCR内参基因检测的特异引物(P5,P6),扩增长度为109bp。P5:5′-TGGTATTGTGCTGGATTCTGGT-3′,P6:5′-TGAGATCACCACCAGCAAGG-3′。以上所有引物均由生工生物工程(上海)股份有限公司合成。
1.3 总RNA的提取
当归根、茎及叶组织中总RNA的提取参照文献[19]方法进行,并略作修改。实验中所用玻璃容器、离心管和去离子水在RNA提取前均用焦炭酸二乙酯(DEPC)处理,以变性灭活RNase。具体操作如下:
取1g材料置于含液氮和少量石英砂的研钵中充分研磨成粉末状。取约1/10的粉末转入内含0.9mL 65℃预热的提取缓冲液的离心管中,提取缓冲液成分包括100mmol/L Tris-Cl、2%CTAB(m/V)、2%PVP-360(m/V)、30mmol/L EDTA、1.5mol/L的 NaCl和2% (V/V)的β-巯基乙醇(β-ME)。充分振荡混匀后置于65℃水浴锅孵育20min,期间每5min充分振荡1次。冷却至室温后,加等体积氯仿/异戊醇(24∶1),剧烈振荡30s,11000r/min、4℃离心10min。水相转入另一离心管,加约1/3体积10mol/L的LiCl,混匀后置-20℃冰箱30 min。11000r/min、4℃离心10min,沉淀溶解于0.5mL无RNase的去离子水,加0.5mL水饱和酚抽提一次,再加入等体积氯仿/异戊醇(24∶1)抽提1次,11000r/min、4℃离心10min。水相转入另一离心管,加1/10体积3 mol/L pH 5.4的醋酸钠,再加1体积预冷的异丙醇,置-20℃冰箱30min。11000r/min、4℃离心10min,沉淀悬浮于500μL无RNase的去离子水配制的70%乙醇。11000r/min、4℃离心10min,弃去上清液,沉淀干燥后溶于50μL无RNase的去离子水中。
将提取到的总RNA在使用和保存之前进行检测,使用分光光度计(Thermo BioMate 3,美国),根据吸光度值测定所提总RNA的纯度(A260/A280的值为1.8~2.0,说明RNA无污染)及浓度;并依照测定出的RNA浓度确定下一步实验中合成cDNA所需模板的用量,未使用的RNA保存于-80℃超低温冰箱;采用非变性琼脂糖凝胶电泳方法判断总RNA的完整性。
1.4 RT-PCR扩增
按照试剂盒说明书,以当归叶片总RNA合成cDNA,然后以cDNA为模板进行PCR反应。反应体系:在200μL PCR管中加入下列组分,无菌去离子水35.8μL、MgCl2(25mmol/L)5μL、10×PCR缓冲液5μL、dNTP(2mmol/L)1.2μL、正、反向引物(10μmol/L)1μL、cDNA 0.5μL和Taq DNA polymerase(5U/μL)0.5μL,总体积为50μL。反应程序:95℃预变性3min;95℃变性30s、56℃退火30s、72℃延伸60s,30个循环;最后72℃延伸10min,4℃结束,PCR扩增产物用1.5%琼脂糖凝胶电泳,用凝胶-化学发光成像系统(Bio-Rad CHEMI DOC XRS,美国)检测。目的片段回收和纯化按照回收试剂盒说明书进行。
1.5 阳性克隆的筛选、鉴定及测序
DNA片段与T载体连接体系包括:T4DNA连接酶的2×连接缓冲液5μL、pGEM-T Easy载体0.5μL、纯化的PCR产物1.5μL(值以PCR产物∶载体摩尔比1∶1估算)、T4DNA连接酶0.8μL,无菌去离子水补充至10μL,4℃连接过夜。连接产物全部加入到100μL置于冰上的感受态大肠杆菌DH5α细胞中,冰浴20min;42℃热激50s;冰浴2min。加入900μL平衡至室温的液体LB培养基,摇菌1.5h(37℃,150r/min)。取100 μL菌液涂布于含有氨苄青霉素的LB固体培养基上,37℃培养过夜。次日挑选单菌落,进行菌落PCR检测,阳性克隆接种于含氨苄青霉素的液体培养基培养(37℃,150r/min),培养过夜后装入菌种保藏管送生工生物工程(上海)有限公司测序。
1.6 序列的生物信息学分析
Blast搜索在NCBI网站上进行,序列的比对、翻译和作图等在DNAMAN 6.0生物软件上进行,序列保守区分析在NCBI网站Conserved Domain Database(CDD)中进行。具体分析参照已经发表的关于基因克隆及序列分析文献中方法进行[20-22]。
1.7 PAL在当归植株组织中的特异表达
采用实时荧光定量PCR(Bio-Rad CFX96,美国)测定PAL在当归植株组织中的特异表达。分别称取约0.1 g当归根、茎、叶组织提取总RNA,每个组织重复3次,然后用分光光度计测定浓度,计算并量取总RNA约100 ng。按试剂盒说明书进行cDNA的第一链合成,将cDNA用无菌去离子水稀释至30μL后取1μL cDNA作为荧光定量PCR模板进行荧光定量PCR,每个cDNA模板做3管重复。反应体系:在200μL PCR管中加入无菌去离子水7.4μL、2×qPCR mix 10μL、正、反向引物(10μmol/L)0.8μL、cDNA 1μL,总体积为20μL。反应程序:95℃预变性3min;95℃变性15s、60℃退火30s、72℃延伸30s,40个循环。荧光采集时间在72℃延伸步骤,扩增完成后利用PCR仪自带的程序进行熔点曲线测定。求取3个平行管的平均Ct值,采用2-△△Ct分析方法对PAL进行相对定量表达分析。
1.8 统计与分析
所有数据采用SPSS 16.0进行统计和分析。根、茎、叶间PAL相对表达量差异性利用ANOVA分析,采用LSD检验。
2 结果与分析
2.1 总RNA的提取及检测
采用非变性琼脂糖凝胶电泳法对当归不同组织总RNA进行检测,结果显示,28SrRNA和18SrRNA条带清晰,没有其他杂质条带(图1),说明本试验提取的叶片总RNA的完整性较好;经分光光度计测定A260/A280平均值为1.98,表明总RNA的纯度较高,可用于RT-PCR扩增。
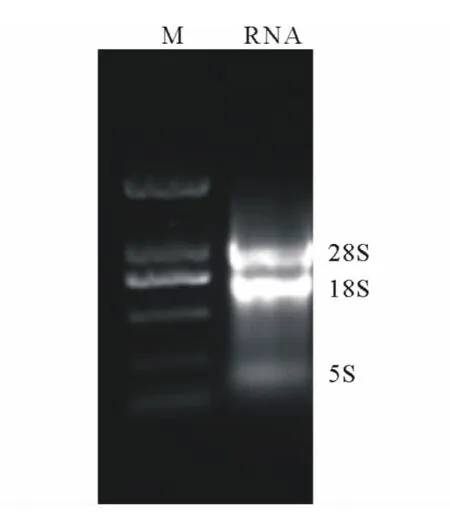
图1 叶片总RNA非变性琼脂糖凝胶电泳Fig.1 Nondenaturing agrose gel electrophoresis of total RNA from leaves
2.2 RT-PCR扩增
以当归叶片总RNA反转录所得到的第一链cDNA为模板,用PAL扩增引物P1和P2进行PCR扩增。经检测,扩增产物约在700bp处有1条亮带(图2),与理论目的片段大小一致,推测为PAL片段,需要进一步测序鉴定。
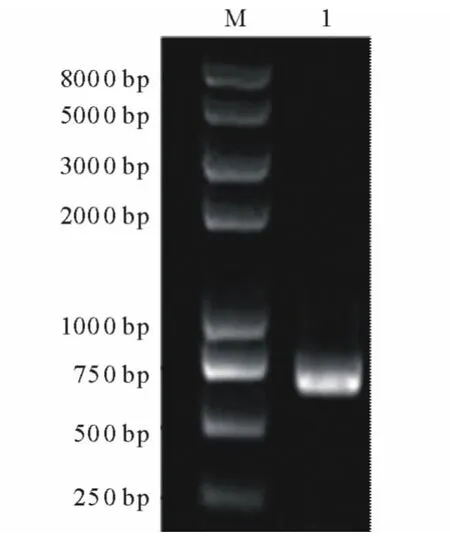
图2 RT-PCR产物琼脂糖凝胶电泳Fig.2 Agrose gel electrophoresis of RT-PCR products
2.3 阳性克隆的筛选、鉴定及测序
将回收纯化的目的片段连接到pGEM-T Easy克隆载体上,转化大肠杆菌DH5α,从转化的平板上随机挑取5个克隆并进行菌落PCR扩增,经检测1号和2号克隆扩增出大小约为700bp的条带(图3),与RT-PCR结果一致,可能为阳性克隆,然后将阳性克隆进行菌液培养并进行测序,测得一段长度为706bp的序列,将该基因序列在NCBI网站的GenBank数据库中注册 (登录号:KJ000258)。
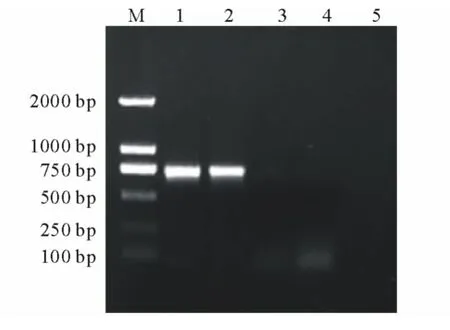
图3 阳性克隆的PCR鉴定Fig.3 PCR identification of positive clones
2.4 序列分析
对克隆得到的基因片段进行序列分析,其编码232个氨基酸(图4)。Blast比对结果显示,该序列与NCBI基因库中6个物种的PAL核苷酸序列的相似性在80%以上,与珊瑚菜(Glehnialittoralis)GlPALB基因的相似性最高,为97%,与朝鲜当归PAL的相似性为88% (表1),表明本研究克隆到的基因片段为当归PAL片段,将其命名为AsPAL。将推测的当归PAL片段氨基酸序列和其他植物PAL氨基酸序列进行多重比较(图5),结果发现完全一致的氨基酸多达179个,占总氨基酸数的77%,与珊瑚菜、皱波天竺葵、胡萝卜、朝鲜当归、野山茶(Camelliasinensis)和金银花氨基酸序列相似性分别达99.14%,98.71%,97.42%,95.28%,86.70%和84.98%,表明克隆片段所编码的肽段为PAL保守区域,并将其命名为As-PAL。进一步对AsPAL进行保守结构域分析,结果显示,其包含裂解酶I类超家族 (Lyase_like Superfamily)保 守 结 构 域 (1-44)、PLN02457 结 构 域 (1-223)、TIGR01226结构域(1-224)和pfam00221结构域(1-71),它们均是苯丙氨酸解氨酶的相关结构域,说明AsPAL为当归PAL的功能区域。
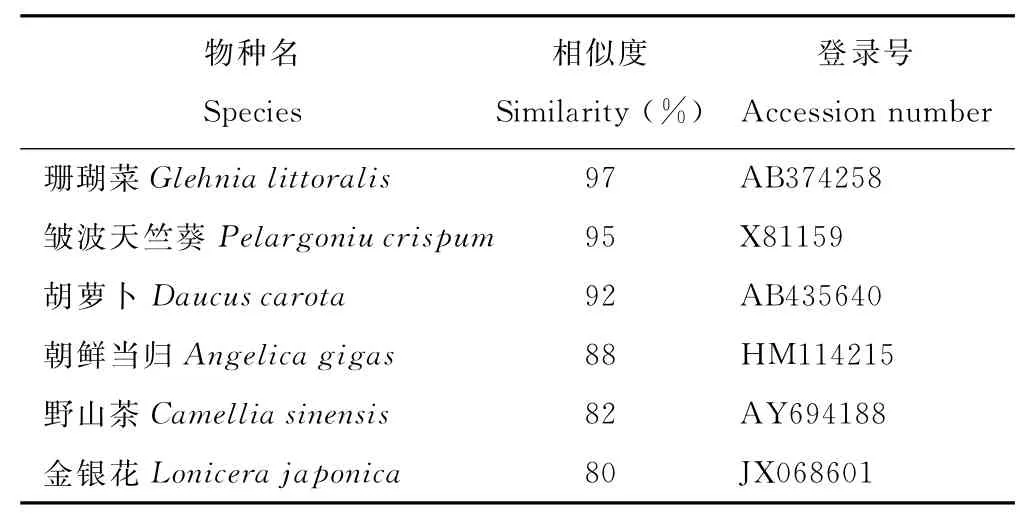
表1 当归与部分植物PAL片段核苷酸序列相似性比对Table 1 Similarity analysis of PALfragment nucleic acid sequences between A.sinensis and other plant species
2.5 PAL在当归植株组织中的特异表达
由总RNA的非变性琼脂糖凝胶电泳结果看出,当归根、茎及叶组织中总RNA的28S条带和18S条带亮度相当(图6),说明反转录总RNA浓度基本相同。实时荧光定量PCR扩增曲线显示,Actin和PAL的扩增效果良好,Ct值在21~28之间循环;熔点曲线分析也表明扩增曲线具有良好的特异性,表现为单一峰,没有非特异性荧光峰,Actin和PAL的熔点曲线峰值分别出现在86℃和85℃。将荧光定量PCR的产物进行琼脂糖凝胶电泳检测,结果显示扩增条带大小约为110bp,与目的大小一致,无引物二聚体条带(图7)。
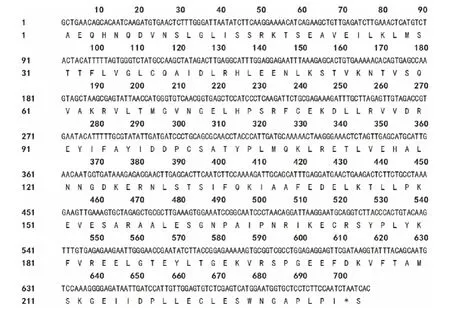
图4 当归PAL片段的核苷酸序列及推测的氨基酸序列Fig.4 Nucleic acid sequence and deduced amino acid sequence of PAL fragment fromA.sinensis

图5 当归与部分植物PAL片段氨基酸序列相似性多重比较Fig.5 Multiple comparisons on amino acid sequence of PALfragment between A.sinensis and other plant species
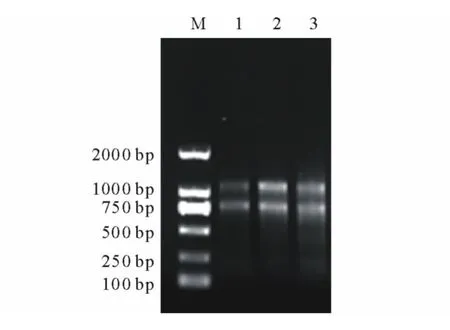
图6 当归根、茎、叶总RNA非变性琼脂糖凝胶电泳Fig.6 Nondenaturing agarose gel electrophoresis of total RNA from root,stem and leaf of A.sinensis
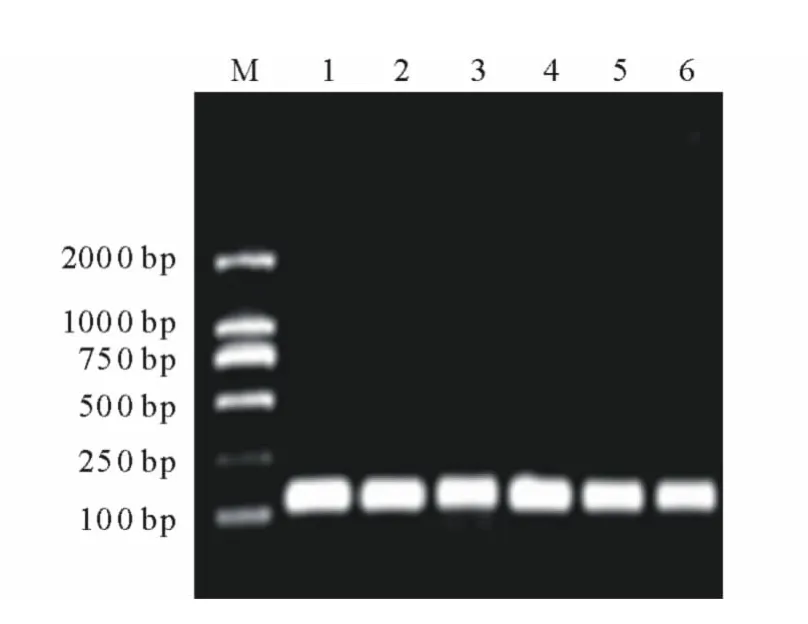
图7 荧光定量PCR产物非变性琼脂糖凝胶电泳Fig.7 Nondenaturing agarose gel electrophoresis of products of fluorescence quantitative RT-PCR
采用2-△△Ct方法分析当归根、茎、叶组织中PAL相对表达量,结果显示PAL在各组织中均有表达,叶片中表达量最高,其次是茎和根,叶片和茎中表达量分别是根表达量的7.5和2.7倍,三者间差异性显著(P<0.05)(图8)。
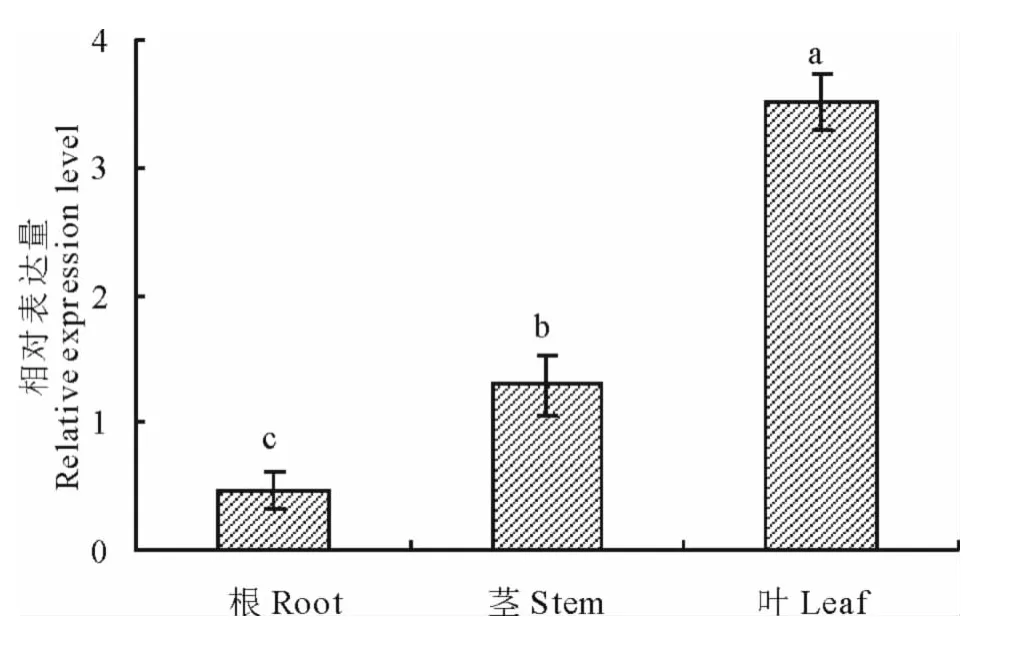
图8 PAL在当归根、茎和叶中的相对表达量Fig.8 Relative expression levels of PALin root,stem and leaf of A.sinensis
3 讨论
苯丙氨酸解氨酶(PAL)催化的反应是苯丙烷类代谢的第一步反应,其将初生代谢产物苯丙氨酸纳入到次生代谢中,成为很多次生代谢产物的前体物质。该酶分布比较广泛,在所有绿色植物、真菌、细菌、酵母以及藻类中都有[23]。本研究虽然仅扩增的是当归PAL3′端的保守区片段,但经与GenBank中的其他物种PAL序列比对发现,AsPAL与朝鲜当归及皱波天竺葵PAL序列同源性非常高,相似性达92%。而与珊瑚菜、皱波天竺葵、胡萝卜、朝鲜当归、野山茶和金银花的同源性也达80%以上,初步推断AsPAL可能是当归PAL酶的cDNA片段。由AsPAL保守结构域分析结果初步证实该序列为PAL的保守区域,可能包含着裂解酶I类超家族(Lyase_I_like Superfamily)保守结构域序列。该超家族有裂解酶I家族、组氨酸裂解酶和苯丙氨酸裂解酶,它们催化类似的β消除反应。这些分析结果预示着AsPAL可能是高等植物PAL家族的新成员,它具有较高的结构和功能保守性,这为进一步从基因的组成成分、理化特性、亚细胞定位、功能结构域等方面更全面而准确地揭示当归阿魏酸生物合成的分子机理奠定了基础。
苯丙氨酸解氨酶在调控代谢途径方面具有复杂的作用,Howles等[24]认为,在转基因烟草(Nicotiana tabacum)中PAL过量表达可提高绿原酸等相关次生代谢产物的含量,而Sewalt等[25]的研究表明,PAL表达抑制的转基因烟草中木质素等相关次生代谢产物含量会减少。本研究首次从当归植株中克隆了PAL,通过非变性琼脂糖凝胶电泳分析,PAL在当归叶组织中表达量显著高于根组织,预示着当归中阿魏酸的生物合成可能是先由叶组织合成,然后由植物传导系统将其输送至根部积累。
本研究曾比对朝鲜当归及皱波天竺葵PAL序列设计简并引物并进行当归PAL全长的扩增,但未能获得有效的扩增结果,这是否与当归PAL在5′端具有自身特异性有关,还需进一步研究。本研究成果为进一步克隆方法获得当归PAL全长,以及对阐明其在当归阿魏酸生物合成途径中的功能奠定了工作基础,同时也对未来通过基因工程手段调控当归阿魏酸含量提供理论依据。
[1] 国家药典委员会.中华人民共和国药典[S].北京:中国医药科技出版社,2010:124-125.
[2] 张新慧,张恩和,王惠珍,等.连作对当归生长的障碍效应及机制研究[J].中国中药杂志,2010,35(10):1231-1234.
[3] 王惠珍,张新慧,李应东,等.轮作与连作当归光合特性和挥发油的比较[J].草业学报,2011,20(1):69-74.
[4] 王田涛,王琦,王惠珍,等.连作条件下间作模式对当归生长特性和产量的影响[J].草业学报,2013,22(2):54-61.
[5] 邱黛玉,蔺海明,方子森,等.种苗大小对当归成药期早期抽薹和生理变化的影响[J].草业学报,2010,19(6):100-105.
[6] 王婕,赵建邦,宋平顺,等.30批当归中阿魏酸、藁本内酯含量测定[J].中国实验方剂学杂志,2011,17(16):70-73.
[7] 欧仕益,包惠燕,蓝志东.阿魏酸及其衍生物的药理作用研究进展[J].中药材,2011,24(3):220-221.
[8] 刘敬,李文建,王春明,等.当归中有效成分阿魏酸的生物合成及调控[J].中草药,2008,39(12):1909-1912.
[9] 章霄云,郭安平,贺立卡,等.木质素生物合成及其基因调控的研究进展[J].分子植物育种,2006,4(3):431-437.
[10] Navarre D A,Payyavula R S,Shakya R,etal.Changes in potato phenylpropanoid metabolism during tuber development[J].Plant Physiology and Biochemistry,2013,65:89-101.
[11] Park N I,Park J H,Park S U.Overexpression of cinnamate 4-hydroxylase gene enhances biosynthesis of decursinol angelate inAngelicagigashairy roots[J].Molecular Biotechnology,2012,50(2):114-120.
[12] Appert C,Logemann E,Hahlbrock K,etal.Structural and catalytic properties of the four phenylalanine ammonia-lyase isoenzymes from parsley(PetroselinumcrispumNym.)[J].European Journal of Biochemistry,1994,225(1):491-499.
[13] Yuan Y,Wang Z,Jiang C,etal.Exploiting genes and functional diversity of chlorogenic acid and luteolin biosyntheses inLonicerajaponicaand their substitutes[J].Gene,2014,534:408-416.
[14] Xu H,Park N I,Li X,etal.Molecular cloning and characterization of phenylalanine ammonia-lyase,cinnamate 4-hydroxylase and genes involved in flavone biosynthesis inScutellariabaicalensis[J].Bioresource Technology,2010,101(24):9715-9722.
[15] Yazaki K,Kataoka M,Honda G,etal.cDNA cloning and gene expression of phenylalanine ammonia-lyase inLithospermum erythrorhizon[J].Bioscience,Biotechnology,and Biochemistry,1997,61(12):1995-2003.
[16] Liu R,Xu S,Li J,etal.Expression profile of a PAL gene fromAstragalusmembranaceusvar.Mongholicus and its crucial role in flux into flavonoid biosynthesis[J].Plant Cell Reports,2006,25(7):705-710.
[17] Hu Y S,Zhang L,Di P,etal.Cloning and induction of phenylalanine ammonia-lyase gene fromSalviamiltiorrhizaand its effect on hydrophilic phenolic acids levels[J].Chinese Journal of Natural Medicines,2009,7(6):449-457.
[18] 吴永娜,胡静,王引权,等.当归肌动蛋白基因片段的克隆及序列分析[J].中草药,2012,43(12):2485-2489.
[19] Pandit S S,Mitra S S,Giri A P,etal.A quick method for isolating RNA from raw and ripe fleshy fruits as well as for coisolating DNA and RNA from polysaccharide and polyphenol-rich leaf tissues[J].Journal of Plant Biology,2007,50(1):60-64.
[20] 孔令芳,张吉宇,刘志鹏,等.无芒隐子草SAMS1基因的克隆及干旱胁迫下的表达分析[J].草业学报,2013,22(1):268-275.
[21] 李剑,张金林,王锁民,等.小花碱茅HKT2;1基因全长cDNA的克隆与生物信息学分析[J].草业学报,2013,22(2):140-149.
[22] 任爱琴,易津,高洪文,等.柠条锦鸡儿CkNCED1基因启动子的克隆及表达分析[J].草业学报,2013,22(2):165-170.
[23] 姜翠翠,陈桂信,潘东明,等.油木奈果实苯丙氨酸解氨酶基因的分离与表达分析[J].西北植物学报,2013,33(3):465-471.
[24] Howles P A,Sewalt V J H,Paiva N L,etal.Overexpression of L-phenylalanine ammonia-lyase in transgenic tobacco plants reveals control points for flux into phenylpropanoid biosynthesis[J].Plant Physiology,1996,112(4):1617-1624.
[25] Sewalt V J H,Ni W,Blount J W,etal.Reduced lignin content and altered lignin composition in transgenic tobacco downregulated in expression ofL-phenylalanine ammonia-lyase or cinnamate 4-hydroxylase[J].Plant Physiology,1997,115(1):41-50.
