光强对马兰形态、生理及黄酮类化合物含量的影响
2014-03-26李中林郭开秀周守标郑和权刘坤
李中林,郭开秀,周守标,郑和权,刘坤
(安徽师范大学生命科学学院,安徽 芜湖241000)
光是影响植物生理生化特性、光合作用和生理代谢的重要生态因子之一,也是影响植物生长发育和分布的重要环境因子之一[1],主要通过光照强度、光照时间以及光质来影响植物的生长发育和形态建成[2]。光对植物的影响不仅体现在作为主要能量来源参与光合作用,还能以环境信号的形式通过光敏色素等的作用参与植物整个生命周期过程中生长发育和生理代谢的调节[3]。植物适应光环境变化的能力很大程度上决定着植物的产量和分布模式,植物对不同的光强会做出不同的反应。光照对植物的生长、发育和演化具有极其重要的作用,并对植物体内的次生代谢物的生物合成和积累产生重要影响。在栽培管理中,通过调整种植密度,或者套种等措施可改变种植对象的光强条件,因此了解光照强度对植物的生长和次生代谢产物的影响具有重要的理论和实践意义[4]。
黄酮类化合物是一组存在于植物体中的天然次级代谢产物,几乎绝大多数植物都能合成,到目前为止,已发现2000多种,常以游离态或糖苷形式存在,少数以游离形式存在[5]。研究表明,黄酮类化合物具有多方面生物活性,包括:抗癌、抗肿瘤、抗心血管疾病、抗炎镇痛、免疫调节、降血糖、治疗骨质疏松、抑菌、抗病毒、抗氧化、抗衰老以及抗辐射等[6-11]。因此,黄酮类化合物已成为国内外医药界研究的热点之一,是具有广泛开发与应用前景的天然药物成分[12],有着广阔的市场前景。
马兰(Kalimerisindica),又名马兰头,属菊科(Compositae)马兰属(Kalimeris)多年生草本植物,嫩茎叶常作蔬菜食用,全草可入药,具有较高的药用价值。马兰广泛分布于我国东部、中部、西部、南部以及东北以南地区[13]。马兰营养成分丰富,富含大量矿质元素、维生素、氨基酸等,是一类兼具营养与保健的野生蔬菜[14-15]。马兰因其清香可口、风味独特、且具有多种营养保健价值,在浙江金华、丽水、温州等地农民开始试种野生马兰,发展马兰生产[14]。目前,国内外有关马兰的研究主要集中在栽培技术[16-17]、蔬菜加工技术[18]、营养成分[19]、化学成分[20-21]和黄酮类化合物提取[22]等方面的研究,而不同光照强度对马兰的生理生态和次生代谢产物的影响研究较少。本文通过人工设置100%,62.29%,35.17%三个梯度的透光率,初步探讨了不同遮阴条件下马兰的形态、生理及黄酮类化合物含量,旨在了解马兰的形态、生理和黄酮类化合物对光照强度的响应,为马兰在蔬菜和药物方面的进一步开发利用提供理论依据。
1 材料与方法
1.1 实验材料
供试材料马兰采自安徽师范大学赭山校区校园内。2008年3月选取健壮,长势一致的马兰植株移栽于5.0 m×1.3m(长×宽)实验地中。试验地属温带大陆性季风气候,日照长,雨水充沛,年平均气温为15~16℃,年日照时数2000h左右,年平均降水量1200mm,主要集中在6、7月,全年的无霜期达219~240d。
1.2 实验方法
在试验地经过一段时间的适应生长后,将实验地均匀分为1.2m×1.0m(长×宽)3小块,于2008年5月26日对马兰植株进行遮光试验,遮光实验前对马兰的生长指标和生理指标进行测定,作为统一的基准值。遮光开始时去除各处理水平长势不同的马兰植株。遮光分为3个处理水平,CK:全光照,无遮阴网(透光率100%);T1:一层遮阴网(透光率为62.29%,即指透过遮阴网进入植株顶部的光照水平,以占全日照的百分率表示,下同);T2:二层遮阴网(透光率为35.17%)。遮光材料为黑色遮光网,用CI-340便携式光合测定仪于晴天11:00,14:00,16:00左右测定各处理组的相对透光率,每时段每组重复测定3次,取平均值。遮光棚高度为75cm。为了防止光照的互相影响,各组间均留出1m的间隔。试验期间各处理组均保持正常一致的管理措施,所选取的植株依次做好序号标记,并记录每株植株的叶片数目、植株高度、叶片长宽和茎秆直径。试验于2008年7月15日结束。
1.3 测定指标及方法
从5月26日开始进行遮阴实验,并分别在遮阴处理的第10,20,30,40和50天进行测量。在同一叶位 (中部叶)测定其生长指标后,采适量的中部新鲜成熟叶片用液氮冷冻测定其生理指标。每次测量时间点尽量相同。
1.3.1 生长指标的测定 马兰植株高度、叶片长和宽分别用直尺和游标卡尺测量。马兰分枝数和叶片的锯齿数采用直接计数法。每次实验测量结果以3~6次重复的平均值表示。
1.3.2 生理指标的测定 所有数据吸光值用UV-3802型双光束紫外可见分光光度计测定,每次实验结果以3次重复的平均值表示。
叶绿素含量(mg/g)测定采用丙酮浸提法[23];丙二醛(malondialdehyde,MDA)含量(mmol/g)测定采用硫代巴比妥酸比色法[23];过氧化物酶(peroxidase,POD)活性的测定采用愈创木酚法[23],将每 min OD(optical density,光密度)增加0.01定义为1个活力单位,单位U/(g·min);超氧化物歧化酶(superoxide dismutase,SOD)活性的测定采用氮蓝四唑(NBT)光还原法[23],将每min OD增加0.01定义为1个活力单位,单位U/(g·min);过氧化氢酶(catalase,CAT)活性测定采用陈利锋等[24]的方法,将每min OD减少0.01定义为1个活力单位,单位U/(g·min);超氧阴离子自由基(O2-·)含量的测定参考Elstner和Heupel[25]的方法;黄酮提取和测定参照郑和权等[22]的方法。
1.4 数据分析
采用Excel 2007和SPSS 13.0软件进行数据处理及统计分析。用One-way ANOVA和差异显著性检验(S-N-K检验,P<0.05)判定试验效应显著与否。结果以“平均值±标准差(means±SD)”表示。
2 结果与分析
2.1 光照强度对马兰地上部分形态特征的影响
2.1.1 光照强度对马兰节间长的影响 由图1可知,3个处理组马兰节间长随着处理时间的延长而升高,CK处理下各时间段节间长始终都高于其他处理下的节间长,且在30d达到最大,另外两组仍在生长,直至50dT2处理组节间长稍微小于CK,但差异不显著(P<0.05)。方差分析表明,T1处理组与CK始终具有显著差异(P<0.05)。光照处理至30,40d时,T1和T2处理与对照相比均存在显著差异(P<0.05)。
2.1.2 光照强度对马兰分枝数的影响 由图2可知,在遮阴处理至第30天马兰出现分枝现象,各组随着处理时间的延长呈现出分枝数增加的趋势;T2处理的分枝数始终大于另外两组。方差分析结果表明,光照处理至30d,T2处理与CK存在显著差异(P<0.05),之后差异不显著;T1处理与CK一直差异不显著(P>0.05)。说明透光率为62.29%时对马兰的分枝能力作用不明显,而透光率为35.17%时能在一定程度上促进马兰的分枝能力。

图1 光照强度对马兰节间长的影响Fig.1 Effect of light intensity on internode-length of K.indica

图2 光强对马兰分枝数的影响Fig.2 Effect of light intensity on branches No.of K.indica
2.1.3 光照强度对马兰株高的影响 由图3表明,马兰在不同的光照强度处理下,随着时间的变化,不同处理组大体上呈现出上升的趋势,但CK一直高于另外两组。方差分析表明,T1处理一直低于CK,且差异显著(P<0.05)。T2处理低于CK,但直到处理50d与CK差异才显著(P<0.05),说明遮光抑制了植株的生长,透光率为62.29%时对马兰株高抑制更明显(P<0.05)。
2.1.4 光照强度对马兰叶形态的影响 由图4~5可知,马兰的叶长和叶宽因光照强度的变化而改变。随着时间的延长,叶片的长度与宽度呈增加趋势,处理至第30天后,长度与宽度基本保持稳定。T2处理的长度和宽度一直大于另外两组。方差分析表明,T1与CK差异不显著(P>0.05),T2与CK在处理20d后差异显著(P<0.05),透光率为35.17%时显著促进了马兰叶片长度和宽度的增加(P<0.05),透光率为62.29%时对马兰叶片长度和宽度的促进作用不明显(P>0.05)。

图3 光照强度对马兰株高的影响Fig.3 Effect of light intensity on height of K.indica
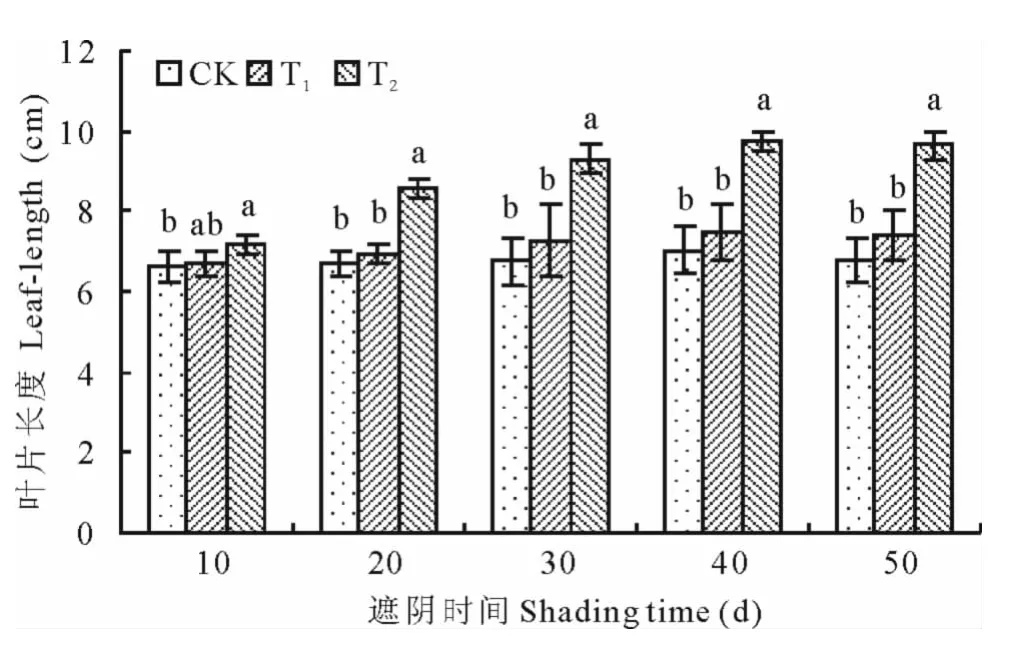
图4 光照强度对马兰叶片长度的影响Fig.4 Effect of light intensity on leaf-length of K.indica
由图6可知,随着处理时间的延长3个处理组的叶片锯齿数增加,T2在处理至第20天锯齿数达到稳定,另外两组则在处理至第30天后达到稳定,比T2处理要晚,且T2处理的锯齿数一直大于另外两组。方差分析表明,T1组在处理至第10,20天时叶片锯齿数显著低于CK(P<0.05),之后锯齿数与CK差别不显著(P>0.05)。T2组在处理至第30,40,50天与CK差异显著(P<0.05),说明透光率为35.17%时显著促进了马兰叶片锯齿数的增加(P<0.05),在前期透光率为62.29%时抑制了马兰叶片锯齿数的增加(P<0.05),后期抑制作用不明显(P>0.05)。
综上,透光率为35.17%时更有利于马兰叶的长度、宽度和锯齿数的增加,透光率为62.29%时对马兰作用不显著。

图5 光照强度对马兰叶片宽度的影响Fig.5 Effect of light intensity on leaf-width of K.indica

图6 光照强度对马兰叶片锯齿数的影响Fig.6 Effect of light intensity on sawtooth No.of K.indica
2.2 光照强度对马兰生理指标的影响
2.2.1 光照强度对马兰叶片叶绿素的影响 如图7所示,在遮阴处理至30d之后,T1处理和CK处理的叶绿素a含量达到稳定状态,且T1和CK处理叶绿素a含量基本相同,但大于T2处理组。方差分析表明,T2处理一直显著小于对照(P<0.05)。T1组在处理至第10,20天显著低于对照(P<0.05)。
由图8所示,3个处理组叶片叶绿素b随着处理时间的延长大体上呈现出先降后升的趋势,CK和T1处理组叶绿素b含量均在处理至第50天达到最大,T2在处理至第20天达到最大。方差分析表明,T2处理组除了在处理至第40天与CK无明显差异外,其他处理时间均明显低于对照(P<0.05)。T1处理组在处理至10,20天时与对照存在显著差异(P<0.05)。
如图9所示,3个处理组叶片叶绿素总含量随着处理时间的延长大体上呈现出先降后升的趋势,CK组在处理至第20天叶绿素总含量达到最大,另外两组均是处理至第50天叶绿素总含量才达到最大。方差分析表明,T2组在处理至第20,30,40,50天与另外两组存在显著差异(P<0.05)。T1组在处理至第10,20天时显著低于对照(P<0.05)。
综上,透光率为35.17%时显著抑制叶片叶绿素a、b和叶绿素总含量(P<0.05);在透光率为62.29%时,遮光处理前期显著抑制(P<0.05),之后抑制作用不显著(P>0.05)。
2.2.2 光照强度对马兰叶片O2-·含量的影响 图10表明,各处理水平O2-·的含量均随遮光时间的延长呈先降后升再降的趋势;各组O2-·的含量在处理至第40天达到最大,且T1组大于另外两组。T1和T2组在处理至第20天时O2-·的含量最少,CK在处理至第30天最少,比另外两组晚。方差分析表明,各组之间一直存在显著差异(P<0.05)。T1组在处理至第10,20,30,50天时O2-·含量显著低于对照(P<0.05),在处理至第40天显著高于对照(P<0.05)。T2组在处理至10,20,30,40d时 O2-·含量显著高于对照(P<0.05),在第50天显著低于对照(P<0.05)。
2.2.3 光照强度对马兰叶片SOD活性的影响 由图11可知,各处理组SOD活性呈先降后升趋势。各组在处理至第30天时SOD活性最低,之后活性开始升高。T1和CK组在处理至第10天时SOD活性最高,而T2是在处理至第50天活性最高。方差分析表明,T1组SOD活性一直显著低于CK组(P<0.05)。T2组在处理至第30天和CK无显著差异(P>0.05),之后活性升高,并显著高于CK(P<0.05)。
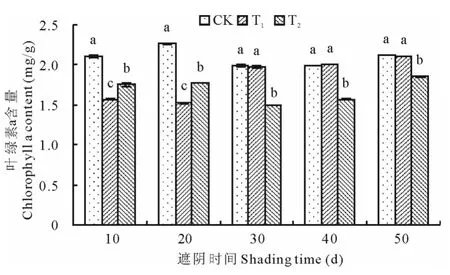
图7 光照强度对马兰叶片叶绿素a含量的影响Fig.7 Effect of light intensity on chlorophyll a content of K.indica

图8 光照强度对马兰叶片叶绿素b含量的影响Fig.8 Effect of light intensity on chlorophyll b content of K.indica

图9 光照强度对马兰叶片叶绿素总含量的影响Fig.9 Effect of light intensity on total chlorophyll content of K.indica
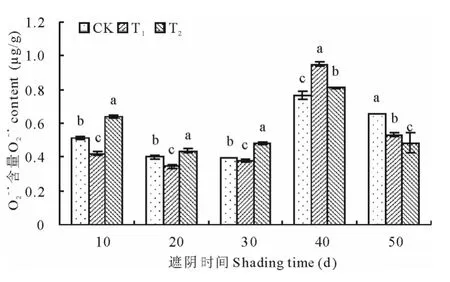
图10 光照强度对马兰叶片O2-·含量的影响Fig.10 Effect of light intensity on O2-·content of K.indica

图11 光照强度对马兰叶片SOD活性的影响Fig.11 Effect of light intensity on SOD activity of K.indica

图12 光照强度对马兰叶片POD活性的影响Fig.12 Effect of light intensity on POD activity of K.indica
2.2.4 光照强度对马兰叶片POD活性的影响 由图12表明,各处理组POD活性呈现先升后降的趋势。T1和CK组在处理至第40天时POD活性升高到最大,T2组则在处理至第30天时达到最大,比另外两组出现最大值早,CK组POD活性最大值高于另外两组。T1和CK组在处理至第10天时POD活性最低,T2组则在处理至第50天时POD活性达到最低。方差分析表明,T1组在处理至第30,40天时POD活性显著低于对照组(P<0.05)。T2组在处理至第20,30,40,50天时POD活性显著低于对照组(P<0.05)。
2.2.5 光照强度对马兰叶片CAT活性的影响 由图13表明,随着处理时间的延长CK组的CAT活性呈先升后降的趋势,T1组呈现先降后升的趋势,T2组呈现下降的趋势。CK组在处理至第20天时CAT活性升高至最大,T1和T2组在处理至第10天时CAT活性最高,此后活性降低。CK组CAT活性在处理至第50天最低,T1和T2组在处理至第40天时CAT活性最低。方差分析表明,3组处理之间差异显著(P<0.05)。T1组在处理至第10,50天时显著高于CK(P<0.05),处理至第20,30,40天时显著低于CK(P<0.05)。T2组在处理至第20,30,40,50天显著低于CK(P<0.05)。
2.2.6 光照强度对马兰叶片MDA含量的影响 由图14可知,各处理组MDA含量随时间变化呈先降后升的趋势。各组在处理至第20天时MDA含量最低,且T2组含量低于另外两组。之后各组MDA含量升高,CK组在处理至第50天时MDA含量升至最高,T1组则是在处理至第10天含量最高,T2组在处理至第40天含量最高。方差分析表明,T2组MDA含量一直显著低于对照(P<0.05),T1则在处理至第40,50天时显著低于对照(P<0.05)。
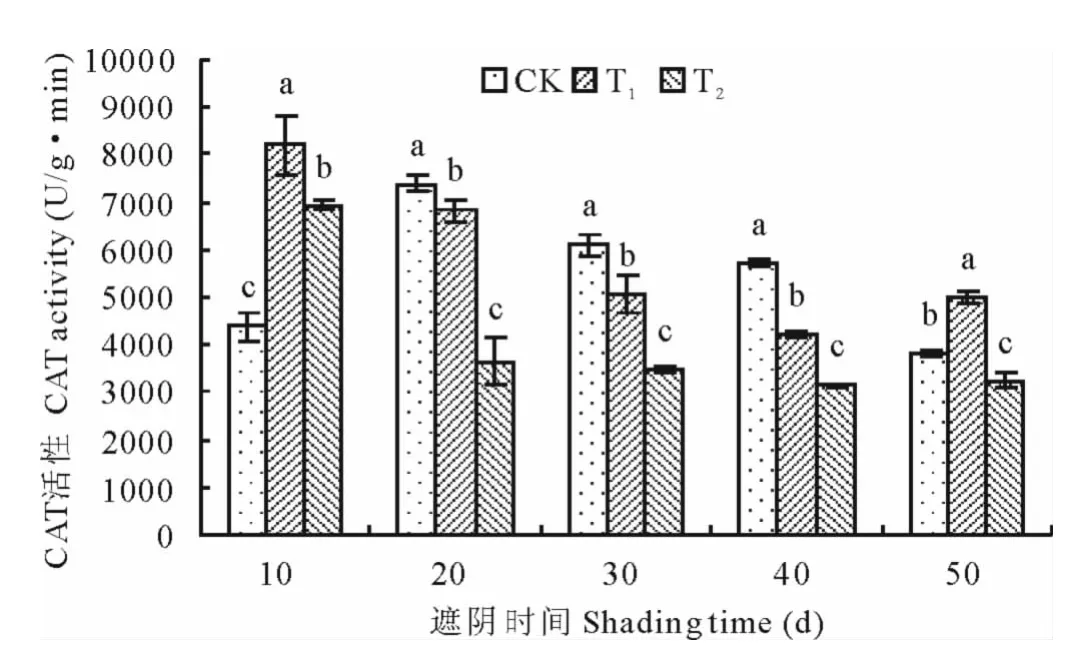
图13 光照强度对马兰叶片CAT活性的影响Fig.13 Effect of light intensity on CAT activity of K.indica

图14 光照强度对马兰叶片MDA含量的影响Fig.14 Effect of light intensity on MDA content of K.indica
2.3 光照强度对马兰不同部位黄酮类化合物含量的影响
由表1可知,同一部位随着光强的减弱,叶中黄酮含量呈下降趋势;茎中含量在T1水平最多,为0.06968 g/g,CK次之,T2含量仅占总量的31.11%;根中黄酮含量却呈上升趋势,T2处理下含量达到最高。在同一光强下,CK组各部位黄酮含量存在明显差异(P<0.05),以叶中含量最多;T1组叶和茎含量无明显差异,但与根中含量差异显著(P<0.05);T2组中各部位黄酮含量均存在显著差异(P<0.05),以根中含量最多,茎次之,叶最少。
3 结论与讨论
通过遮阴实验,马兰的形态、生理及黄酮类化合物含量发生了明显变化,表明光照强度对马兰的形态、生理指标和次生代谢产物的合成产生了影响。随着处理时间的延长,马兰节间长呈增长趋势,但弱光抑制了马兰节间长,在透光率62.29%的遮光处理下显著抑制了马兰节间长度。说明透光率为62.29%时对马兰的分枝能力作用不明显,而透光率为35.17%时能在一定程度上促进马兰的分枝能力,诱导马兰产生更多的分枝。遮光处理抑制了马兰植株的直立生长,在透光率62.29%的遮光处理下对马兰株高产生抑制更明显。透光率35.17%的遮光处理下更有利于马兰叶的长度、宽度和叶锯齿个数的增加,透光率为62.29%时作用不显著。
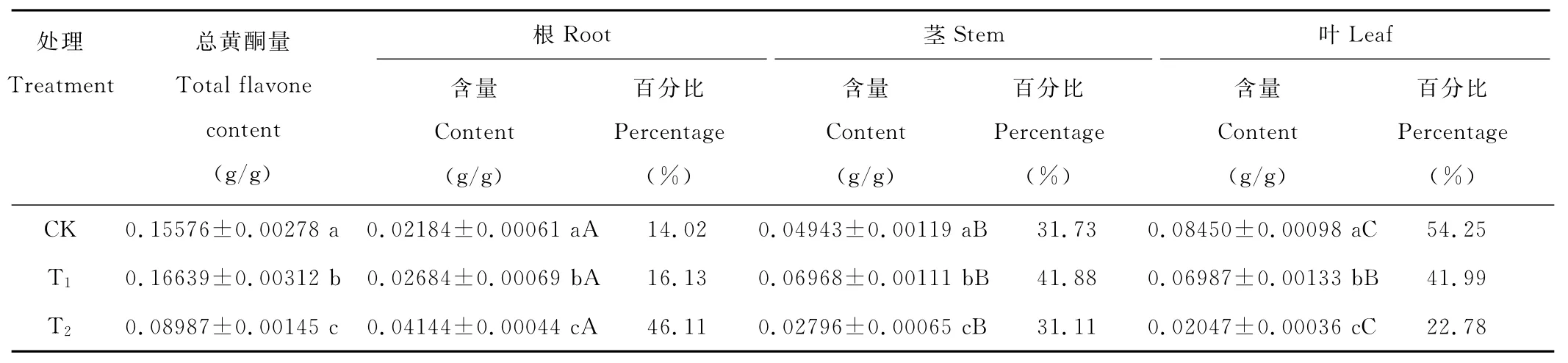
表1 光照强度对马兰不同部位黄酮类化合物含量的影响Table 1 Effect of light intensity on flavone content of K.indica’s different parts
植物的叶绿素直接影响光合作用的强弱,光的强弱对叶绿体光合膜上色素的形成、含量和分布均能产生间接或直接的影响[26-27]。有研究报道,遮光提高了草本植物叶片的叶绿素含量,一定程度上增加了绿色景观效果,随着遮光程度的加大,叶绿素含量呈现显著上升的趋势[28-29]。也有研究表明叶绿素a、叶绿素b和叶绿素含量在不同遮阴条件下均表现为随着遮阴强度的提高逐渐降低[30]。但本实验结果却显示了在实验前期,遮光使得叶绿素a,叶绿素b,叶绿素总量的含量下降,并且CK>T2>T1,与一些研究报道不一致,其原因可能是在实验前期阴雨天气较多,湿度较大,温度较低,导致了自然光照更有利于马兰叶绿素的合成。而在实验后期,随着气温升高,以晴热天气为主,可以看到在透光率62.29%遮光处理下的叶绿素含量显著上升达到对照水平,透光率35.17%的遮光处理下叶片的叶绿素含量也上升,但显著低于另外两组,说明透光率35.17%的遮光处理不利于叶绿素含量的提高。
当植物受胁迫时,体内的活性氧产生和清除机制遭到破坏,从而加快活性氧的积累,SOD是一种诱导酶,不适宜的光照强度都能增加植株体内的氧自由基,在遮光处理中期,3个处理组SOD活性表现为遮光明显低于对照(P<0.05),POD既能催化过氧化氢与其他底物进行氧化反应而被清除,也能催化氧自由基和过氧化氢反应转变为羟自由基而加重过氧化作用。在遮光实验中期,POD活性表现为遮光明显低于对照(P<0.05),又结合CAT在实验中期活性表现为遮光明显低于对照(P<0.05),可能导致过氧化氢增多,羟自由基增多,引起叶片膜脂过氧化加剧,使得MDA含量增加。从整个遮光处理期间还可以看出,植株敏感性最强的POD活性首先上升,和SOD协调一致应对外界逆境,之后马兰叶片内的氧自由基开始下降处于较低水平,SOD活性也下降,但POD活性一直处于较高水平。至处理到40d可能由于气温上升,光照强烈,带动了抗氧化物酶体系,SOD活性上升,继续清除马兰体内的氧自由基。实验结果显示,在活性氧产生速率较低的情况下,保护酶活性也处于较低状态。这与芦站跟等[31]探讨的不同光照下曼地亚红豆杉(Taxusmediacv.Hicksii)保护酶SOD、POD、CAT和活性超氧阴离子产生的速率、MDA含量和细胞膜相对透性之间的关系相一致。
植物次生代谢产物的形成是一个复杂的过程,光照强弱是影响植物次生代谢产物形成及形成量多少的因素之一。朱肖锋等[4]经研究发现光照强度对马蹄金(Dichondrarepens)叶中总黄酮的含量有一定影响,并且马蹄金叶总黄酮含量不是随着光照强度的增加而呈线性增加,而是存在一个最适光照强度,此光强下的马蹄金叶总黄酮含量最高。本研究与上述研究结果基本一致,不同光强下马兰黄酮类化合物的含量不同,它也存在一个最适光照强度,轻度遮光马兰的总黄酮含量最高,而且光强显著影响了马兰各个部位的黄酮合成量。本实验研究中CK与T2组各部位含量差异情况正好相反;光照越弱,地下部分比地上部分的相对含量就会越高。因此,在实际生产过程中,为了保持持续的产量,采集马兰的地上部分进行黄酮类化合物提取更为经济有效。
黄酮类化合物是一种很强的抗氧剂,可有效清除体内的氧自由基[32]。邓斌等[33]对花生壳中黄酮类化合物研究得出,黄酮类化合物有较强的自由基清除能力和一定的抗脂质过氧化能力。李娟和马占强[34]对茵陈蒿(Arte-misiacapillaris)的研究,也得出了与邓斌等[34]一样的结论,黄酮类化合物对超氧阴离子(O2-·)和羟自由基(·OH)均有良好的清除作用,其半抑制率为20.23和80.40μg/mL。本研究可以推测马兰叶内的黄酮类化合物、丙二醛与抗氧化酶防御系统一起产生作用来抵御活性氧的毒害,以维持马兰叶片中氧自由基含量的平衡。而马兰叶片的长度,宽度以及锯齿数却随着遮光程度的增加显现出上升的态势,可能是因为遮光程度的提高使得植株建立起更为强大的活性氧防御体系,抵抗损伤的能力增强,马兰生长旺盛,遮光更有利于叶片的生长和发育。
[1] 蔡仕珍,李西,潘远智,等.不同光照对蝴蝶花光合特性及生长发育研究[J].草业学报,2013,22(2):264-272.
[2] 易克,徐向丽,卢向阳,等.光对烟草生长发育、生理代谢活动及品质形成影响的研究进展[J].化学与生物工程,2013,30(5):11-16.
[3] Li J,Terzaghi W,Deng X W.Genomic basis for light control of plant development[J].Protein Cell,2012,3(2):106-116.
[4] 朱肖锋,周守标,杨集辉,等.不同光照强度对马蹄金叶的特征及总黄酮含量的影响[J].激光生物学报,2009,18(1):62-66.
[5] 刘妮娜,李晓东,张金政,等.玉簪属植物花瓣中类黄酮化合物价值评价[J].草业学报,2013,22(1):234-244.
[6] Havsteen B H.The biochemistry and medical significance of the flavonoids[J].Pharmacology &Therapeutics,2002,96(23):67.
[7] Hollman P C H,Hertog M G L,Katan M B.Analysis and health effects of flavonoids[J].Food Chemistry,1996,57(1):43-46.
[8] Middleton E,Kandaswami C.The impact of plant flavonoids on mammalian biology:implications for immunity,inflammation and cancer[A].In:Harbourne J B.The Flavonoids:Advances in Research since 1986[M].London:Chapman & Hall,1993:619-652.
[9] Day A J,Williamson G.Human metabolism of dietary quercetin glycosides in plant polyphenols[J].Plant Polyphenols 2:Chemistry,Biology,Pharmacology,Ecology,1999,2:415-433.
[10] Hertog M G L,Kromhout D,Aravanis C,etal.Flavonoid intake and long term risk of coronary heart disease and cancer in the Seven Country Study[J].Archives of Internal Medicine,1995,155:381-386.
[11] Huang M T,Ferraro T.Phenolic compounds in food and cancer prevention[A].In:Huang M T.Phenolic Compounds in Food and Their Effects on HealthⅡ,Antioxidants and Cancer Prevention[M].Washington DC:American Chemical Society,1992:8-34.
[12] 李莉,刘成梅,田建文,等.现代提取分析技术在黄酮类化合物中的应用[J].江西食品工业,2006,(4):42-44.
[13] 安徽植物志协作组.安徽植物志 (第4卷)[M].合肥:安徽科学技术出版社,1991:518-521.
[14] 雷学仿,彭珊珊,张奇凤,等.马兰菜中的营养元素[J].广东微量元素科学,1999,6(10):64-66.
[15] 许泳吉.野生植物马兰的营养成分[J].山东化工,2006,35(3):42-43.
[16] 刘跃钧,叶征莺,徐东斌.马兰人工周年栽培技术[J].中国林副特产,2007,(1):34-36.
[17] 李林.野生蔬菜马兰人工栽培技术[J].西北园艺(蔬菜专刊),2009,(4):25-26.
[18] 张跃林.马兰无公害栽培及加工技术[J].上海蔬菜,2006,(4):39-40.
[19] 刘跃钧,李志豪,谢建秋.野生马兰若干营养成分分析[J].福建林业科技,2009,36(1):21-25.
[20] 许文清,龚小见,周欣,等.马兰化学成分研究[J].中草药,2010,41(7):1056-1060.
[21] 钟文武,刘劲松,张聪佴,等.马兰化学成分研究(Ⅱ)[J].广西植物,2012,32(2):261-263.
[22] 郑和权,周守标,朱肖锋,等.马兰总黄酮提取工艺优化及不同部位含量测定[J].食品与发酵工业,2008,34(11):185-189.
[23] 张志良,瞿伟菁.植物生理学实验指导(第3版)[M].北京:高等教育出版社,2003.
[24] 陈利锋,宋玉立,徐雍皋,等.抗感赤霉病小麦品种超氧化物歧化酶和过氧化氢酶的活性比较[J].植物病理学报,1997,27(3):209-213.
[25] Elstner E F,Heupel A.Inhibition of nitrite formation from hydroxylammonium chloride:a simply assay for superoxide dismutase[J].Analytical Biochemistry,1976,70:616-620.
[26] 许春辉,赵福洪,王可玢,等.高光胁迫对水稻籼粳亚种两个品种色素蛋白复合体的影响[J].植物学通报,1994,11(4):8-11.
[27] Leong T Y,Anderson J M.Effect of light quality on the composition and function of thylakoid membranes inAtriplextriangularis[J].Biochemistry Biophys Acta,1984,766:533-541.
[28] 周兴元,曹福亮,陈志明,等.遮阴对几种暖地型草坪草成坪速度及其景观效果的影响[J].草原与草坪,2003,(2):26-29.
[29] 尹淑霞.几种冷季型草坪草耐荫性研究[D].兰州:甘肃农业大学,2000.
[30] 张哲,杨姝,杜桂娟,等.遮阴对三种豆科牧草光合特性和叶绿素荧光参数的影响[J].草业学报,2013,22(5):212-219.
[31] 芦站跟,赵昌琼,周文杰,等.光强对曼地亚红豆杉膜代谢及保护系统的影响[J].重庆大学学报,2003,26(8):89-92.
[32] 肖常厚.中药化学[M].上海:上海科学技术出版社,1997:265.
[33] 邓斌,王存嫦,徐安武.微波辅助提取花生壳黄酮类化合物及其抗氧化性研究[J].中国油脂,2009,34(3):54-57.
[34] 李娟,马占强.茵陈黄酮类化合物体外抗氧化性研究[J].农产品加工,2009,(8):74-76.
