环境pH值和假交替单胞菌对颗石藻的影响
2014-03-25宋丹丹杨锐任继锐莫雅婷文欣
宋丹丹, 杨锐, 2, 任继锐, 莫雅婷, 文欣
(1. 宁波大学 海洋学院应用海洋生物技术教育部重点实验室, 浙江 宁波 315211; 2. 宁波大学 海洋生物工程重点实验室, 浙江 宁波 315211)
颗石藻是一类海生或咸水生光自养型单细胞鞭藻类,属于金藻门(Chrysophyta),颗石藻纲(Coccolithophyceae)[1],是海洋生态系统中基本的初级生产力,也是深海碳酸盐和海洋油气层最重要的碳氢物质来源[2]。颗石藻生活在相对高硝酸盐、低磷酸盐、高光和低微型浮游动物的水体中,几乎分布在世界范围的近海和大洋水域中[3],可固定碳量2×1010~2×1011t,换算成CO2为7333×108t[4],在海洋地球碳循环过程中发挥重要作用。颗石藻可以通过钙化作用在细胞外形成由碳酸钙 (CaCO3)构成的鳞片状颗粒外壳[5-6],这些颗粒被称为颗石粒 (coccolith),成为研究生物矿化机理的重要材料[7]。颗石藻由于对生存环境的酸碱性有很强的自我调节能力,在适宜的碱性条件下,一天内就可以重新恢复活跃的种群生活状态并短期内迅速增殖,因此颗石藻也是大洋和高纬度海洋发生水华的常见类群[7]。

1 材料与方法
1.1 材料与药品
材料:颗石藻(P.carterae)分离自浙江省象山港海水虾塘致害水华,由宁波大学藻种室保存。紫菜附生假交替单孢菌(Pseudoalteromonassp. NPYS3)分离自南通条斑紫菜。
主要药品:酵母粉,蛋白胨,柠檬酸铁,KNO3,K2HPO4,MnSO4,CaCl2,MgCl2,NaHCO3,H3BO4,NaCl,Na2SiO3,KCl,Na2-EDTA,Na2SO4,NaNO3,NaH2PO4,FeCl3·6H2O,CuSO4·5H2O,ZnSO4·7H2O,CoCl2·6H2O,MnCl·4H2O,Na2MoO4·2H2O,维生素B1,维生素B12,生物素,均购自于国药集团化学试剂有限公司。
实验中培养液均采用添加了NMB3#的人工海水[13]。
1.2 实验方法
1.2.1 材料预处理
颗石藻纯化:取少量藻接种于充分灭菌的培养基中活化培养,平板划线,获得单藻落,抗生素处理,培养至密度为1.8×105个/mL备用。
假交替单孢菌的活化及菌悬液的制备:取少量菌种经细菌液体Zobel 2216E培养基[14]活化3次,收集充分活化后的假交替单孢菌,离心(10 000 r/min,5 min)后用无菌生理盐水制备菌悬液,血球计数板计数[15],调整其密度为5.4×108cfu/mL ,置于4℃冰箱备用。
1.2.2 假交替单孢菌培养
取1 mL密度为 5.4×108cfu/mL的菌悬液接种于装有280 mL不同初始pH值(6.5、7.5和8.5)的无菌NMB3#培养液的培养瓶中,每组3个平行,于37℃摇床中培养。定时取样测定其pH值变化。
1.2.3 颗石藻培养
取70 mL备用藻液加入装有280 mL不同初始pH值(6.5、7.5和8.5)的无菌NMB3#培养液的培养瓶中,每组3个平行,置于恒温光照培养箱(GXZ型,宁波江南仪器厂)中培养,培养条件为:25℃,40 μE/m2·s,L∶D=12∶12。每天定时摇藻2次,每4 h检测培养体系的pH值,每12 h检测藻的生长状况。
1.2.4 颗石藻与假交替单孢菌共培养
取70 mL备用藻液和1 mL备用菌悬液一起接种于含280 mL不同初始pH值(6.5、7.5和8.5)的无菌NMB3#培养液的培养瓶中,置于恒温光照培养箱中进行共培养,培养条件同1.2.3。前48 h每4 h取样进行细胞计数、测pH值,48 h后每12 h进行上述指标的测定。于0 h、16 h和156 h利用荧光法检测颗石藻钙化情况。
1.2.5 检测方法
1)细胞计数。取1 mL的藻液于EP管中,加1滴5%的甲醛溶液固定藻样,静置20 min后,利用血球计数板在光学显微镜下进行计数,方法参考[14]。2)pH值的测定。取2 mL培养液于EP管中,用梅特勒SevenEasy pH计-FE20测定培养液pH值。3)荧光法测定钙化情况[16]。取2 mL藻液于EP管中,离心(4000 r/min,5 min),弃上清,加入2 mL缺钙人工海水多次清洗离心,弃上清;加入0.5 mol/L的MES溶液(9.762 g MES加去离子水定容到100 mL,用NaOH调节pH值5.5)1 mL,静置2 h。分别取200 μL上清液和10 μL稀释后的荧光指示剂(按1∶10的比例稀释)加入到Tissue Culture Testplate荧光板中, 25℃静置20 min。用Thermo(AORION)仪测量其荧光值,激发波长488 nm,吸收波长526 nm。计算颗石藻钙化状况。
1.2.6 数据分析
利用SPSS 17.0软件对数据进行One-way Anova和Two-way Anova分析。
2 结果与分析
2.1 不同起始pH值下纯培养和藻菌共培养时颗石藻种群生长情况
2.1.1 纯培养时颗石藻的生长密度变化
在前12 h内,3个pH值下的种群密度均未出现明显增加, 12~108 h颗石藻呈快速增长,进入对数生长期;108 h之后细胞生长达到稳定期。起始pH值7.5体系中颗石藻在前96 h增殖速率较其它两组快;而起始pH值6.5的体系中种群密度相对其它两组增殖的较慢。达到稳定期后,起始pH值8.5、7.5和6.5的体系中,颗石藻的密度依次降低(图1)。
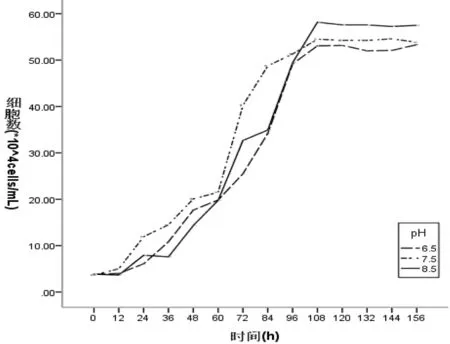
图1 不同起始pH值(6.5、7.5、8.5)条件下156 h内颗石藻种群的生长
One-way Anova分析结果(表1)显示:P<0.01,即不同pH值对颗石藻生长的影响极显著。

表1 颗石藻在不同起始pH值(6.5、7.5、8.5)下生长密度的方差分析
2.1.2 NPyS3-颗石藻共培养时颗石藻生长密度的变化
NPyS3-颗石藻共培养时,颗石藻在不同起始pH值(6.5、7.5和8.5)下的生长规律(图2)与其单独培养的趋势相似,起始pH值8.5的体系中颗石藻生长相对最好,而pH值6.5的菌藻共培养体系中,颗石藻的生长明显比pH值7.5和8.5共培养体系的缓慢;但3种pH值条件下颗石藻的细胞密度均显著降低(P<0.01),分别仅为纯培养的63.7%,61.0%和56.1%。菌藻共同培养体系下,颗石藻前36 h生长趋势缓慢上升,36 h后呈快速增长,进入对数生长期的时间比纯培养推迟了24 h。

图2 不同起始pH值(6.5、7.5、8.5)条件下菌藻共同培养体系中156 h内颗石藻种群的生长
Two-way Anova分析结果(表2)显示,菌:P<0.01,即在菌藻共同培养体系中假交替单孢菌对颗石藻生长的影响是极显著的;pH:P>0.05,即在菌藻共同培养体系中pH对颗石藻生长无显著影响。该数据表明:在菌藻共培养体系中NPyS3对颗石藻生长的影响远远大于低pH对它的影响。

表2 不同起始pH值(6.5、7.5、8.5)和菌对颗石藻生长影响的Two-way Anova分析
2.2 不同起始pH值下各培养体系中pH值变化情况
Psuedoalteromonassp. NPyS3、颗石藻、菌藻共培养体系的pH值变化规律见图3。NPyS3可以向碱性方向调整体系的pH值,培养体系的pH值最终稳定在8.5左右。颗石藻在不同起始pH值的体系中单独培养24 h后,培养体系pH值呈昼夜节律变化,且随着培养时间的延长,pH值周期性振荡幅度增大。与纯培养相比,菌藻共培养体系出现昼夜节律的时间推迟到48 h,这一差异与培养体系进入对数生长期的时间延迟相一致;而且在156 h内,菌藻共培养体系的pH值持续上升,高达10.23;不同培养体系的pH差异极显著(P<0.01)。

图3不同起始pH值条件下培养体系pH变化(A—NPyS3纯培养;B—颗石藻纯培养;C—NPyS3-颗石藻共培养)
Fig 3 The changes of pH value of the cultured medium at different initial pH (6.5, 7.5 and 8.5) values

图4 不同起始pH值(6.5、7.5、8.5)条件下,颗石藻细胞在0 h、16 h、156 h时的钙化情况(A—颗石藻纯培养;B—NPyS3-颗石藻共培养)
2.3 不同起始pH值条件下纯培养和藻菌共培养时颗石藻钙化情况
颗石藻纯培养和NPyS3-颗石藻共培养体系在0 h时,颗石藻钙化程度相似。16 h时,颗石藻纯培养体系中,起始pH为值7.5和8.5的钙化程度相似,而起始pH值为6.5的钙化程度明显低于前两者;NPyS3-颗石藻共培养体系中,颗石藻钙化程度显著低于纯培养(P<0.01), 从pH值8.5、7.5到6.5依次降低。第156 h时,不论纯培养还是共培养体系,pH值8.5体系的颗石藻细胞钙化程度均为最高,pH值6.5体系的最低(图4);而与纯培养相比,菌藻共培养体系中颗石藻的钙化程度受到显著抑制。
One-way Anova分析不同起始pH值下培养的颗石藻种群钙化情况(表3):0.01 表3 不同起始pH值(6.5、7.5、8.5)对颗石藻钙化影响的方差分析 不同起始pH值下菌藻共同培养体系中颗石藻种群钙化情况的Two-way Anova分析结果(表4)显示,菌:0.01 表4 不同起始pH值(6.5、7.5、8.5)和菌对颗石藻钙化影响的方差分析 颗石藻是一种适宜在碱性条件下生活的藻类,其最适pH值9.0左右[5-6]。它的增殖与水域的光照、温度有确定的正相关系,而与氮、磷等营养盐的关系则存在差异,偏低营养和偏高营养的水域中都有易于增殖的种类[12]。表层海水pH值的微小变化就会阻碍某些藻类生物形成碳酸钙的能力,足以使这些生物难以生长[10]。本实验中,颗石藻在酸性环境下可以长时间存活且进行自我调节,但是生长增殖受到显著抑制(P<0.01)。在渡过酸性适应期后,颗石藻呈现长时间连续增殖,这可能与该藻在营养条件、环境因子优化后,短期内可以恢复活跃的种群生活状态并迅速增殖的特征吻合[7, 10]。 已有研究表明,大气中CO2浓度升高影响了海洋中生物的钙化过程[17]。藻类钙化作用依赖于细胞的生理活动,也依赖于海洋环境的稳定性[18]。海洋酸化会直接或间接地影响钙化藻类的生长和钙化,威胁钙化种群的生存[9-10, 19]。本研究显示:低pH值显著抑制颗石藻的钙化作用,无论有无细菌的参与,碱性条件下颗石藻的钙化程度均比酸性条件下的好。该结果与酸性环境不利于颗石藻的钙化,碱性有利于颗石藻的钙化的特征吻合[19, 20]。 藻际细菌与藻类可能因为竞争营养物质而抑制藻类的生长,藻际细菌生长过程中产生的代谢物及中间产物等可能对海洋藻类的光合作用和钙化作用产生抑制作用[21]。假交替单孢菌是海洋藻类外生菌报道中常见种类,假交替单孢菌属中的许多种类能产生胞外酶、胞外毒素、抗生素和胞外多糖、病毒活性等物质[22-24],在同多种海洋生物共生的过程中起到重要作用,并且对水华藻类有着明显的抑制作用[25]。本实验中,藻菌共培养体系中,虽然NPyS3能向碱性方向调整体系pH值,使得藻菌共同培养体系的pH值显著升高达到10以上,但并未因为微环境酸化程度降低而减缓钙化作用的受损。菌的介入使得颗石藻钙化作用受到更强烈的抑制(P<0.01),且菌对藻的抑制,远大于pH值降低对藻的影响。这是否因为假交替单孢菌的代谢产物抑制颗石藻的生长,或者细菌对颗石藻的资源性竞争抑制, 或由于NPyS3的参与,导致环境条件超过了藻类钙化的最适范围,进而抑制藻类生长和钙化;又或者因为细菌本身抑制了藻类对Ca2+的吸收利用,有待进一步实验验证。 综上所述,环境pH值对颗石藻的生长与钙化都产生显著影响,碱性条件比较有利于其增殖和钙化;然而环境中拮抗生物因素对颗石藻生长及钙化的抑制远大于pH值降低等环境因素的影响。 参考文献: [1]Jordan R W, Kleijne A. A classification system for living colithophores[C]. Cambridge: Canbridge University Press, 1994: 83-106. [2]侯 奎, 陈镇东, 陈延成. 颗石藻与海洋、环境关系之探讨[J]. 化工矿产地质, 1999, 21(1): 31-38. [3]Paasche E. A review of the coccolithophoridEmilianiahuxleyi(Prymnesiophyceae), with particular reference to growth, coccolith for mation, and calcification photosynthesis interactions[J]. Phycologia, 2002, 40(6): 503-529. [4]侯 奎, 陈镇东, 陈延成. 颗石藻与环境[J]. 植物资源与环境学报, 2001(1): 51-53. [5]周成旭, 严小军, 骆其君, 等. 低温和高温下颗石藻(Pleurochrysissp.)种群生长特征及生化变化[J]. 生态学报, 2008, 28(6): 2587-2594. [6]Nimer N A, Merrett M J. Calcification rate inEmilianiahuxleyiLohmann in response to light, nitrate and availability of inorganic carbon[J]. New Phytol, 1993, 123(4): 673-677. [7]Henriksen K, Stipp S L S, Young J R, et al. Biological control on calcite crystallization: AFM investigation of coccolith polysaccharide function[J]. American Mineralogist, 2004, 89(11): 1709-1716. [8]Sabine C L, Freelu R A, Gruber N, et al. The oceanic sink for anthropogenic CO2[J]..Science, 2004, 305: 367-371. [9]Balch W M, Kipatrick K A. Calcification rates in the Equatorial Pacific along 140 W[J]. Deep-Sea Research II, 1996, 43(4-6): 971-993. [10]阮祚禧. 海洋酸化对钙化浮游植物颗石藻的影响[D]. 汕头:汕头大学, 2008. [11]Beaufort L, Probert I, de Garidel-Thoron T, et al. Sensitivity of coccolithophores to carbonate chemistry and ocean acidification[J]. Nature, 2011, 476: 80-83. [12]Brown C W, Yoder J A. Coccolithophorid blooms in the global ocean[J]. Journal of Geophysical Research, 1994, 99(C4): 7467-7482. [13]Zhou C X, Ma B, Wang F X, et al. The population growth and variation of nitrate-N and phosphate-P in the mixculture ofPhaeodactylumtricornutumBohl andProrocentrummicans[J]. Marin Science, 2006, 30(12): 58-61. [14]中国科学院微生物研究所细菌分组. 一般细菌常用鉴定方法[M]. 北京: 科学出版社, 1978. [15]黄文芳, 张 松. 微生物实验指导[M]. 北京: 科学出版社, 1996. [16]栾青杉. 冬夏季中国近海今生颗石藻及其钙化作用速率研究[D]. 北京. 中国科学院, 2010. [17]Gao K, Aruga Y, Asada K, et al. Calcification in the articulated coralline alga Corallina pilulifera, with special reference to the effect of elevated CO2 concentration[J]. Marine Biology, 1993, 117:129-132. [18]刘宝宁. 富营养化条件下磷对颗石藻关键生理生态过程的作用及意义[D]. 宁波:宁波大学, 2012. [19]Shiraiwa Y. Physiological regulation of carbon fixation in the photosynthesis and calcification of coccolithophorids[J]. Comparative Biochemistry and Physiology, 2003, 136(4): 775-783. [20]Navid R, Michael A. Increased CO2and the effect of pH on growth and calcification ofPleurochrysiscarteraeandEmilianiahuxleyi(Haptophyta) in semicontinuous cultures[J]. Appl Microbiol Biotechnol, 2011, 90:1399 1407. [21]王少沛, 曹煜成, 李卓佳, 等. 水生环境中细菌与藻的相互关系及其实际应用[J]. 南方水产, 2008, 4: 76-79. [22]席 宇,朱大恒,刘红涛,等. 假交替单胞菌及其胞外活性物质研究进展[J]. 微生物学报, 2005, 32(2): 108-111. [23]丁立建, 何 山, 严小军.海洋交替假单胞菌活性物质的研究[J]. 天然产物研究与开发, 2013, 25(4): 558-561. [24]Skovhus T L, Holmström C, Kjelleberg S, et al. Molecular investigation of the distribution, abundance and diversity of the genusPseudoalteromonasin marine samples[J]. FEMS Microbiology Ecology, 2007, 61(2): 348-361. [25]张 勇,吴 刚,席 宇. 溶藻细菌杀藻物质的研究进展[J]. 微生物学通报, 2004, 31(1): 127-131.

3 讨论
