去乙酰化酶SIRT1基因在猪不同发育阶段卵泡颗粒细胞中的表达规律研究
2014-03-25李碧侠付言峰任守文王金玉
李碧侠,赵 芳,付言峰,任守文,王金玉
(1 江苏省农业科学院 畜牧研究所,江苏 南京 210014;2 扬州大学 动物科学与技术学院,江苏 扬州 225009)
沉默信息调节因子2 (Silent information regulator 2,SIR2)是NAD+依赖的组蛋白去乙酰化酶(Histone deacetylase,HDAC)家庭成员之一,参与了酵母交配型基因、端粒区基因和rDNA沉默,并可抑制rDNA的重组,增加1个拷贝的SIR2基因可延长酵母的寿命,延缓其衰老[1-3]。哺乳动物去乙酰化酶Sirtuins家族有7个成员(SIRT1~SIRT7),其中SIRT1与SIR2的同源性最高,因此受到广泛关注。SIRT1在体内通过对几种控制代谢及内分泌信号的转录因子的去乙酰化作用来调节其活性,从而广泛参与哺乳动物细胞寿命的不同信号通路、糖代谢及胰岛素分泌等多条代谢通路,参与众多基因转录、能量代谢及细胞衰老的调节过程[4-6]。随着对SIRT1基因生理功能研究的深入,人们发现SIRT1基因除了在脂肪代谢、糖代谢、抗氧化等方面发挥作用外,其还通过对生殖激素受体表达的调控参与动物生殖过程[7]。SIRT1基因与黄体生成素、雌激素分泌存在密切相关性,直接或间接参与生殖调控[8]。
目前,关于猪SIRT1基因的研究报道很少,猪作为一个良好的动物模型,在研究能量代谢、生殖激素调控等方面有重要作用。卵泡是卵巢最基本的功能单位,为卵子的发育和成熟提供微环境。卵泡发育是一个以形态变化为特征的不可逆的生长过程,同时伴随着卵泡功能的分化。因此,本研究分析SIRT1基因在猪卵泡发育中的变化规律,探讨了SIRT1基因的表达与卵泡发育的相关性,以期为研究SIRT1基因在猪卵巢卵泡发育、发情排卵中的作用及其生物学特性提供理论依据。
1 材料与方法
1.1 试验样品
试验猪由江苏省农业科学院六合苏钟猪原种场提供,采集新鲜健康的猪卵巢,置于37 ℃生理盐水(添加青霉素和链霉素)中,2 h内带回实验室。
1.2 主要仪器与试剂
动物切片石蜡(熔点 60~62 ℃)购自上海标本模型厂,Trizol试剂盒为Invitrogen公司产品,RNase Inhibitor、dNTP Mixture、Buffer、SYBR Premix ExTaqTM为TaKaRa公司产品, SIRTl抗体购自Santa Cruz公司。主要仪器有:Bio-Rad Iq5型荧光定量PCR仪、SZ-51连续变倍体视显微镜、Leica倒置荧光显微镜及BIO-RAD电泳凝胶成像系统。
1.3 猪卵泡的分离与分类
将采集的卵巢用PBS清洗后,用眼科剪将卵巢剪开,再用镊子在体视镜下人工剥离单个卵泡,根据直径将卵泡分为≤1.5 mm,>1.5~≤3.0 mm,>3.0~≤5.0 mm,>5.0 mm 4个组。
1.4 猪卵泡颗粒细胞SIRT1蛋白表达的免疫组织化学检测
采集新鲜母猪卵巢,用PBS清洗后放入体积分数4%多聚甲醛中固定,6 h后修块1次,共固定24 h,常规方法制备石蜡切片。取石蜡切片,用二甲苯脱蜡3次,每次6 min;水化、抗原热修复,用体积分数 3%甲醇处理1 h,以消除内源性过氧化物酶;加SIRT1抗体(稀释倍数1∶150),室温过夜;加二抗,湿盒内37 ℃反应1 h;加ABC 复合物(稀释倍数 1∶50),37 ℃作用30 min;用PBS稀释的体积分数0.05% DAB+体积分数0.01% H2O2显色2~15 min;流水冲洗 2 min 后用苏木精复染,于显微镜下观察,根据染色情况终止染色。切片重新脱水,用中性树胶封片,在显微镜下观察SIRT1表达情况。棕褐色指示阳性表达,染色的深浅程度指示蛋白表达的强弱。
1.5 猪卵泡颗粒细胞SIRT1 mRNA 表达的qRT-PCR检测
根据GenBank已公布的猪SIRT1基因序列(GenBank号:EU200984.1)设计1对引物,其上游引物为:5′-ATTCTTGTGAAAGTGATGAGGAT-G-3′,下游引物为:5′-ATTGTTCGAGGATCTGTGCC-3′,扩增目的片段长度为130 bp。同时,根据GenBank已公布的猪管家基因GAPDH序列(GenBank号:NC_010447.3) 设计1对引物,其上游引物为:5′-TGAAGGTCGGAGTGAACGGAT-3′,下游引物为:5′-TGGGTGGAATCATACTGGAAC-3′,扩增目的片段长度为148 bp。引物均由上海生工生物工程技术服务有限公司合成。利用Trizol法提取不同直径卵泡颗粒细胞的总RNA,利用紫外分光光度计检测RNA质量和浓度,用10 g/L琼脂糖凝胶电泳鉴定提取RNA的完整性。将RNA进行反转录,所得的cDNA置于-20 ℃保存备用。以合成的cDNA为模板,采用荧光定量PCR方法检测SIRT1基因表达量,PCR反应总体系为25 μL,包括SYBR Premix ExTaqTM12.5 μL,上、下游引物(10 μmol/L)各0.5 μL,去离子水10.5 μL,cDNA模板1 μL。试验同时设无模板试剂对照。PCR反应条件均设置为:94 ℃ 预变性10 s;然后94 ℃ 10 s,58 ℃ 20 s,72 ℃ 15 s,重复35个循环。反应结束后,由标准曲线判断目的基因扩增效果与管家基因扩增效果是否一致。
1.6 猪卵泡颗粒细胞SIRT1 蛋白表达的Western blotting检测
提取不同直径卵泡颗粒细胞总蛋白,采用Bradford法测定蛋白浓度后进行SDS-PAGE电泳,每处理设3个重复。将电泳后的蛋白转移至PVDF膜上,脱脂奶粉封闭2 h,加入适宜浓度的一抗,4 ℃孵育过夜。次日用TBST洗膜3次后加入HRP标记的二抗,室温孵育1.5 h,TBST洗膜3次,然后用化学发光液浸润PVDF膜蛋白面,并以ChemiDoc XRS曝光系统检测蛋白条带亮度。以Tubulin蛋白为内参,用Quantity One(Bio-Rad,USA)软件分析蛋白条带密度值。各组织的SIRT1蛋白光密度值除以Tubulin蛋白光密度值,即获得SIRT1蛋白的相对表达量。
1.7 统计分析
每种处理试验均重复3次,用SPSS 13.0软件进行不同直径卵泡颗粒细胞中SIRT1表达量的差异显著性分析。
2 结果与分析
2.1 猪不同发育阶段卵泡中SIRT1蛋白的表达定位
采用免疫组织化学方法分析SIRT1蛋白在猪不同发育阶段卵泡中的表达定位,结果(图1)发现,SIRT1蛋白在猪原始卵泡(图1-A)中表达量较少;而在初级卵泡(图1-B)、次级卵泡(图1-C)、三级卵泡(图1-D)、优势卵泡(图1-E)中均有较强表达。同时发现SIRT1蛋白表达主要定位于颗粒细胞和卵母细胞中,膜细胞中SIRT1蛋白表达量较少。
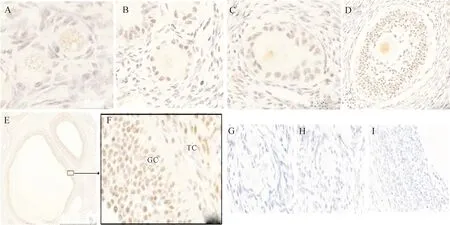
图1 猪不同发育阶段卵泡中SIRT1蛋白的表达定位
2.2 猪不同直径卵泡颗粒细胞中SIRT1 mRNA的表达量
利用qRT-PCR方法分析不同直径大小卵泡颗粒细胞中SIRT1 mRNA的表达量,结果如表1所示。由表1可知,在直径为>1.5~≤3.0 mm的卵泡颗粒细胞中SIRT1 mRNA表达量最高,直径>5.0 mm的卵泡颗粒细胞中SIRT1 mRNA表达量最低;直径≤1.5 mm组和>1.5~≤3.0 mm组卵泡中SIRT1 mRNA表达量均极显著高于直径>3.0~≤5.0 mm和>5.0 mm组(P<0.01),直径>3.0~≤5.0 mm与>5.0 mm组间差异不显著(P>0.05)。

表 1 猪不同直径卵泡颗粒细胞中SIRT1 mRNA的相对表达量
2.3 猪不同直径卵泡颗粒细胞中SIRT1 蛋白的表达量
Western blotting结果(表2)表明,SIRT1蛋白在猪不同直径卵泡颗粒细胞中均有表达,其中在直径为>1.5~≤3.0 mm卵泡中SIRT1蛋白表达量极显著高于其他直径的卵泡(P<0.01),直径>3.0~≤5.0 mm与>5.0 mm卵泡中SIRT1蛋白表达量差异未达到显著水平(P>0.05)。SIRT1蛋白在不同直径大小的卵泡颗粒细胞中表达趋势与SIRT1 mRNA表达趋势一致。
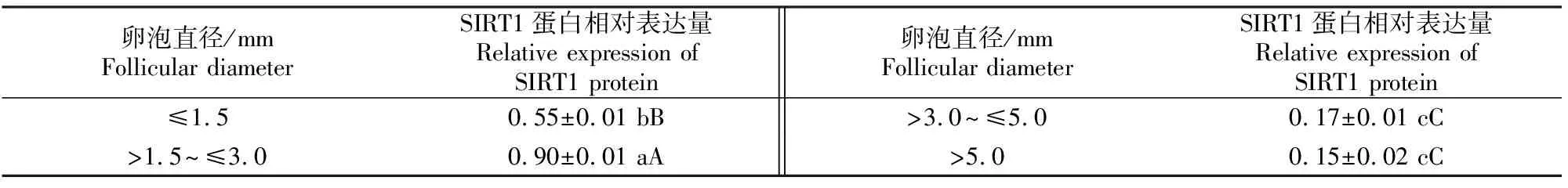
表 2 猪不同直径卵泡颗粒细胞中SIRT1蛋白的相对表达量
3 讨 论
目前,研究已发现SIRT1基因参与哺乳动物脂肪代谢、糖代谢、胰岛素分泌等多条信号通路,调节基因转录、能量代谢及细胞衰老[9-10]。进一步研究发现,人和小鼠的SIRT1基因与卵巢孕酮、雌激素分泌密切相关。SIRT1基因敲除雄性小鼠与促黄体生成素(LH)、促黄体生成素受体(LHR)、促性腺激素释放激素(GnRH)编码基因突变个体表现出相似的表型[11]。SIRT1基因敲除雄性小鼠睾丸支持细胞和间质细胞成熟功能缺失,睾丸内睾酮水平下降,表现出雄性不育[12]。SIRT1基因敲除雌性小鼠卵巢颗粒细胞分泌雌激素水平显著升高[13]。但猪SIRT1基因对生殖调控影响的研究尚未见报道。本研究采用免疫组织化学方法分析猪不同发育阶段卵泡中SIRT1 蛋白的表达与定位,结果显示,随着卵泡的发育,SIRT1 蛋白表达量逐渐增多,其在原始卵泡中表达最弱,在优势卵泡中表达最强。在人的卵巢组织中,用免疫组织化学方法也发现不同发育卵泡颗粒细胞中均存在SIRT1 蛋白的表达[14]。在小鼠卵巢颗粒细胞中也存在SIRT1基因表达,且其表达量可影响颗粒细胞分泌雌激素的能力[15-16]。
本试验为了进一步分析SIRT1基因在猪卵泡颗粒细胞中的表达规律,体外根据卵泡直径将其分为4组,qRT-PCR 和Western blotting结果表明,SIRT1蛋白和SIRT1 mRNA在猪不同直径卵泡颗粒细胞中均有表达,且表达规律一致。随着卵泡直径的变化,SIRT1蛋白和SIRT1 mRNA表达量逐渐增多,在直径>1.5~≤3.0 mm卵泡中表达量最高,在直径>5.0 mm的优势卵泡中表达量最小。根据研究报道,直径>1.5~≤3.0 mm的卵泡多处于腔前卵泡向有腔卵泡的过渡阶段,闭锁率最高[17],具体的原因还需进一步研究。以上结果说明,SIRT1基因的表达量与卵泡发育存在较大的相关性,可能在卵泡发育过程中起着重要作用。
综上所述,猪SIRT1基因在不同发育阶段卵泡颗粒细胞中的表达量具有一定的规律性,其表达量与卵泡发育存在相关性,可能参与卵泡的发育调控,但具体调控机制需进一步研究。
[参考文献]
[1] Howitz K T,Bitterman K J,Cohen H Y,et al.Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan [J].Nature,2003,425(6954):191-196.
[2] Ho C,van der Veer E,Akawi O,et al.SIRT1 markedly extends replicative lifespan if the NAD+salvage pathway is enhanced [J].Febs Lett,2009,583(18):3081-3085.
[3] Vaziri H,Dessain S K,Ng Eaton E,et al.hSIR2 (SIRT1) functions as an NAD2 dependent p53 deacetylase [J].Cell,2001,107(2):149-159.
[4] Tsutomu S,Tadahiro K.Roles of FoxO1 and Sirt1 in the central regulation of food intake [J].Endocrine Journal,2010,57(11):939-946.
[5] Shan T Z,Ren Y,Wu T,et al.Regulatory role of Sirt1 on the gene expression of fatty acid-binding protein 3 in cultured porcine adipocytes [J].Cell Biochem,2009,107(5):984-991.
[6] Takayama K,Ishida K,Matsushita T,et al.SIRT1 regulation of apoptosis of human chondrocytes [J].Arthritis Rheum,2009,60(9):2731-2740.
[7] Yao Y,Li H,Gu Y,et al.Inhibition of SIRT1 deacetylase suppresses estrogen receptor signaling [J].Carcinogenesis,2010,31(3),382-387.
[8] Elangovan S,Ramachandran S,Venkatesan N,et al.SIRT1 is essential for oncogenic signaling by estrogen/estrogen receptor alpha in breast cancer [J].Cancer Res,2011,71(21):6654-6664.
[9] Schenk S,McCurdy C E,Philp A,et al.Sirt1 enhances skeletal muscle insulin sensitivity in mice during caloric restriction [J].J Clin Invest,2011,121(11):4281-4288.
[10] Kong X X,Wang R,Liu X J,et al.Function of SIRT1 in physiology [J].Biochemistry (Mosc),2009,74(7):703-708.
[11] Ullas K S,Katja T,Dirk G de Rooij,et al.The histone deacet-ylase SIRT1 controls male fertility in mice through regulation of hypothalamic-pituitary gonadotropin signaling [J].Biology of Reproduction,2009,80(2):384-391.
[12] Zhang F P,Tomi P,Zhu F,et al.Molecular characterization of postnatal development of testicular steroidogenesis in luteinizing hormone receptor knockout mice [J].Endocrinology,2004,145(3):1453-1463.
[13] Yao Y,Li H,Gu Y S,et al.Inhibition of SIRT1 deacetylase suppresses estrogen receptor signaling [J].Carcinogenesis,2010,31(3):382-387.
[14] Yoshihiro M,Osamu W H,Tetsu Y,et al.Resveratrol promotes expression of SIRT1 and StAR in rat ovarian granulosa cells:An implicative role of SIRT1 in the ovary [J/OL].Reproductive Biology and Endocrinology,2012,10:14.http://www.ncbi.nlm.nih.gov/pubmed/22357324.
[15] Eun J Y,Kim S H,Kyu H,et al.Reciprocal roles of DBC1 and SIRT1 in regulating estrogen receptor a activity and co-activator synergy [J].Nucleic Acids Research,2011,39(16):6932-6943.
[16] Elangovan S,Ramachandran S,Venkatesan N,et al.SIRT1 is essential for oncogenic signaling by estrogen/estrogen receptor α in breast cancer [J].Cancer Res,2011,71(21):6654-6664.
[17] Manabe N,Goto Y,Matsuda-Minehata F,et al.Regulation mechanism of selective atresia in porcine follicles:Regulation of granulosa cell apoptosis during atresia [J].Reprod Dev 2004,50(5):493-514.
