胡杨PeXTH基因的克隆及其转基因烟草的抗镉性分析
2014-03-25韩彦莎鲁彦君陈少良
韩彦莎,鲁彦君,于 瑞,赵 瑞,沈 昕,陈少良
(北京林业大学 生物科学与技术学院, 北京 100083)
近年来,随着化工产业的高度发展及其废弃物的管理不善,土壤重金属污染问题日益严重。镉(Cd)是一种有害的重金属元素,能够经食物链进入人体,直接危害人类健康。Cd2+易被植物吸收,通过降低净光合速率、引发氧化胁迫、干扰营养代谢等生理过程来抑制植物生长,甚至导致植物死亡[1]。如何解决土壤Cd2+污染问题、缓解Cd2+对植物的毒害作用越来越受到人们的关注。为此,许多研究者开始从分子生物学角度,通过导入外源基因来提高不同植物的抗Cd2+能力。Zhu等[2]首次将大肠杆菌中的谷胱甘肽合成酶基因gshII转入印度芥菜(Brassicajuncea)中,发现印度芥菜地上部分的Cd2+含量增加,同时Cd2+耐受性增强。Pomponi等[3]将拟南芥螯肽合成酶基因AtPCS1转入烟草,提高了烟草的抗Cd2+能力。Liu等[4]也报道,过表达金属硫蛋白基因能够有效提高烟草对Cd2+的耐受性。
细胞壁是外界Cd2+进入植物细胞的第一道屏障,也是植物储存Cd2+的关键场所,因此在植物的抗Cd2+过程中起着重要作用[5-6]。Nishizono等[7]报道,蹄盖蕨(Athyriumyokoscense)根部所吸收的Cd2+、Cu2+、Zn2+等有70%~90%积累在根尖的细胞壁中。He等[8]的研究结果也显示,水稻细胞壁结合的Cd占所吸收Cd总量的55%~62%。但迄今为止,对于细胞壁在植物抗Cd2+机制中具体作用的研究仍然为数不多。木葡聚糖内转糖苷酶/水解酶(Xyloglucan endotransglucosylase/hydrolase,XTH) 是植物细胞壁重构过程中的关键酶,它能够通过催化木葡聚糖的断裂和重连来修饰植物细胞壁中纤维素-木葡聚糖的复合结构,从而实现细胞壁的松弛和伸展[9-12]。目前,对XTH基因的功能研究主要集中在植物初生根伸长[13]、开花[14]、果实成熟[15-16]、木材发育[17]等方面。作为细胞壁代谢过程中的关键基因,XTH在植物抗Cd2+机制中的作用至今尚未见报道。胡杨作为一种唯一能够在我国西北干旱盐碱地带形成森林的高大乔木树种,一直以来都是进行木本植物抗逆研究的典型材料。本研究将从胡杨中克隆得到的木葡聚糖内转糖苷酶/水解酶基因PeXTH成功导入烟草,通过比较转基因植株和野生型植株在Cd2+胁迫下的各项生理生化指标,探究PeXTH基因和植株抗Cd2+性之间的关系,为利用胡杨PeXTH基因改良植物新品种提供参考依据。
1 材料与方法
1.1 材 料
克隆基因所用的胡杨苗取自新疆,栽于10 L塑料桶中,培养基质为沙土(土沙质量比为1∶1),在北京林业大学温室中培养,温室中的温度保持在20~25 ℃,光周期为12 h光照/12 h黑暗。转基因所用的烟草品种为Nicotianatabacumcv. Wisconsin 38,由中国科学院遗传与发育研究所胡赞民研究员惠赠。
质粒pGreen0029、菌株EscherichiacoliTop10、AgrobacteriumLBA4404,均由本实验室保存。
1.2 方 法
1.2.1 胡杨PeXTH全长基因的克隆 使用Trizol法提取胡杨叶片总RNA,利用M-MLV逆转录酶(Promega,美国)进行反转录合成cDNA。以胡杨cDNA为模板,根据NCBI网站检索的毛果杨PtXTH全长基因(XM_002318900)序列设计引物,进行PCR扩增。正向引物序列为GGTCCCACCTCCGAGCTTCC(5′-3′);反向引物序列为GACAGGTAATGCAAGGACG(5′-3′)。PCR反应体系为:1 μL cDNA、2 μL dNTP混合物(2.5 mmol/L)、1 U ExTaq聚合酶(Takara,大连)、2.5 μL 10× ExTaq缓冲液、正反向引物(10 μmol/L)各0.5 μL。PCR 反应条件为:95 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min(35个循环);72 ℃ 10 min。扩增产物经1.2%琼脂糖凝胶电泳后,用凝胶回收试剂盒(天根,北京)回收纯化DNA片段。将目的片段连接到pEASY-T1载体(全式金,北京)后,把连接产物转化大肠杆菌Top10感受态细胞,挑取单克隆进行PCR鉴定,选阳性单克隆测序,测序结果在NCBI网站上进行比对。
1.2.2 PeXTH蛋白序列分析 在NCBI网站上通过Blastp检索不同植物中PeXTH的同源蛋白序列。通过在线服务网站SignalP 4.0预测PeXTH蛋白的信号肽。利用Bioedit Sequence Alignment Editor V7.0软件,通过Clustal W方法进行多重氨基酸序列比对。
1.2.3 植物表达载体pGreen0029-PeXTH的构建 通过PCR的方法扩增得到两端分别带有BamHⅠ 和SpeⅠ酶切位点的PeXTH全长基因,正向引物序列为CGCGGATCCATGGCTTCATCGAGTACTG(5′-3′),反向引物序列为GGACTAGTCTAGGACATGCCGCATT(5′-3′)。将扩增产物克隆到中间载体pEASY-T1上,用BamHⅠ和SpeⅠ双酶切中间载体后,将目的片段连接到经同样酶切后的pGreen0029上,获得重组表达载体pGreen0029-PeXTH。将重组表达载体转化大肠杆菌Top10感受态细胞,挑取单克隆测序,并提取重组质粒pGreen0029-PeXTH,用BamHⅠ、SpeⅠ双酶切来鉴定表达载体是否构建成功。
1.2.4 植物表达载体pGreen0029-PeXTH转化农杆菌 利用冻融法[18]将重组表达载体pGreen0029-PeXTH转入农杆菌LBA4404感受态细胞中,然后选取成功转化的农杆菌,通过叶盘法[19]侵染烟草(Nicotianatabacumcv. Wisconsin 38)嫩叶。经300 mg/L卡那霉素筛选,获得阳性转基因烟草株系,并通过Real-Time PCR的方法验证PeXTH基因是否在植株中过表达。烟草在北京林业大学组培室中培养,温度为(25±1) ℃,光照强度为50 μmol/(m2·s),光周期为16 h光照/8 h黑暗,相对湿度为50%~60%。
1.2.5 Real-Time PCR 通过Real-Time PCR的方法检测烟草中PeXTH基因的表达水平。由于胡杨PeXTH基因和烟草NtXTH基因高度同源,所以必须在2个基因序列的非同源区设计引物来保证PCR的特异性,所用引物序列为PeF:AAAGGGTCTGCGTGGGATG(5′-3′);PeR:CGGGAGGAGAAGTGGTTG(5′-3′)。对转基因烟草和野生型烟草的叶和根组织提取总RNA(每个样本设3个重复),利用DNA酶(Promega,美国)进行去DNA处理,然后利用M-MLV逆转录酶(Promega,美国)进行反转录合成cDNA。Real-Time PCR反应使用SYBR Green试剂盒(Bio-Rad,美国),以植物材料的cDNA为模板,在Real-Time PCR仪(Bio-Rad,美国)中扩增。EF1α(基因号:D63396)作为内参基因,所用引物序列为EFF:GCTGTGAGGGACATGCGTCAAA(5′-3′);EFR:GTAGTAGATATCG-CGAGTACCACCA(5′-3′)。PCR 反应条件为:95 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s(35个循环);72 ℃ 10 min。
1.2.6 烟草抗Cd2+表型比较 选取2个T1代转基因烟草株系(L6和L14)以及野生型株系(WT)进行后期的生理试验。将这3个株系的T1代种子用2.5%次氯酸钠消毒后,在含300 mg/L卡那霉素的1/2 MS培养基上萌发。10 d后,将萌发的幼苗转移到新鲜MS培养基上继续培养。20 d后,将组培苗从培养瓶中移出,转入1/4 Hoagland营养液中水培,适应7 d后,再转入分别含有0和100 μmol/L CdCl2的新鲜Hoagland营养液中继续水培。5 d后,观察植株叶和根的生长表型并拍照,然后取下植株的叶和根,测定根长,在65 ℃烘箱中干燥48 h至完全失水,称取干质量,每个样本设3个重复。
1.2.7 相对电导率的测定 以未处理(0)和经100 μmol/L CdCl2处理5 d的野生型(WT)和转基因(L6、L14)烟草为材料,根据Lutts等[20]的方法,取烟草叶片用去离子水清洗3次, 然后用打孔器将叶片打成等面积的小圆片。取20个叶圆片放入含有20 mL去离子水的试管中,期间不停晃动试管,防止叶圆片彼此粘连。1 h后,用DDSJ-308A电导率仪(雷磁,上海)测定溶液电导值(Lt);然后将样品煮沸20 min后测定溶液电导值(L0),相对电导率定义为Lt/L0。每个样本设3个重复。
1.2.8 Cd2+、K+、Ca2+、Mg2+含量的测定 以未处理(0)和经100 μmol/L CdCl2处理15 d的野生型(WT)和转基因(L6、L14)烟草的叶和根为材料,充分烘干研磨过筛后,称取0.2 g干粉于50 mL玻璃试管中,加入5 mL浓硫酸消煮2 h,冷却后用双蒸水定容至50 mL。利用Perkin-Elmer 2280原子吸收光谱仪(PerkinElmer, 美国)测定烟草叶组织中K+、Ca2+、Mg2+的含量;利用AA-240型石墨炉原子吸收光谱仪(瓦里安,美国)测定烟草叶和根组织中的Cd2+含量。每个样本设3个重复。
1.2.9 抗氧化酶活性的测定 酶液提取:以未处理(0)和经100 μmol/L CdCl2处理15 d的野生型(WT)和转基因(L6、L14)新鲜烟草叶片为材料,测定超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)的活性,每个样本设3个重复。称取0.5 g新鲜烟草叶片,置于预冷的研钵中,加入3 mL预冷的磷酸缓冲液(pH 7.0)和少许石英砂在冰上研磨成匀浆,然后定容到10 mL容量瓶,混合均匀后在4 ℃离心机中10 000 r/min离心20 min,上清液即为酶粗提液,用于后续酶活性的测定。
(1)SOD活性测定。SOD活性测定参照Schickler等[21]的方法。反应体系为1.79 mL磷酸钾缓冲液(50 mmol/L,pH 7.8)、0.3 mL甲硫铵酸(130 mmol/L)、0.3 mL氮蓝四唑(NBT,750 μmol/L)、0.3 mL EDTA-Na2(100 μmol/L)、0.3 mL核黄素(20 μmol/L)、10 μL酶粗提液。对照以10 μL磷酸缓冲液替代。取10 mL透光好的试管4支,2支对照管、2支测定管(各管的透光尽量一致),将反应溶液混合均匀后,把1支对照管放在暗处,其他3支置于4 000 lx(30 μmol/(m2·s))日光灯下反应6 min,然后在560 nm比色,记录吸光度,一个SOD单位定义为引起50% NBT光还原所需的酶量。
(2)CAT活性测定。CAT活性测定参照李妮亚[22]的方法。反应体系为2.47 mL磷酸钾缓冲液(50 mmol/L, pH 7.0)、0.5 mL 2% H2O2溶液、30 μL酶粗提液。加入酶液后启动反应,240 nm下吸光度下降的初始直线部分被用于计算酶的活性。
(3)APX活性测定。APX活性测定参照李妮亚[22]的方法。3 mL反应混合液中含50 mmol/L磷酸钾缓冲液(pH 7.0)、0.1 mmol/L EDTA-Na2、0.3 mmol/L ASA、0.06 mmol/L H2O2、30 μL酶粗提液。加H2O2后启动反应,290 nm下吸光度下降的初始直线部分被用于计算酶的活性。
1.2.10 净光合速率和蒸腾速率的测定 以未处理(0)和经100 μmol/L CdCl2处理15 d的野生型(WT)和转基因(L6、L14)烟草为材料,利用LI-6400光合仪(Li-Cor,美国)测定烟草叶片的净光合速率和蒸腾速率。每个样本设3个重复。
2 结果与分析
2.1 胡杨PeXTH全长基因的克隆和PeXTH蛋白的序列分析
以胡杨叶片cDNA为模板,通过RT-PCR的方法克隆得到PeXTH全长cDNA,将其连接到pEASY-T1载体上,再转化到Top10感受态细胞,挑取阳性单克隆测序,并利用NCBI进行序列比对,确证为胡杨PeXTH基因。该基因的开放阅读框长867 bp,含ATG起始密码子和TAG终止密码子,编码由288个氨基酸组成的多肽。
利用NCBI网站的蛋白质序列数据库,通过Blastp程序在杂交山杨(PopulustremulaL.×P.tremuloides)、拟南芥(Arabidopsisthaliana)、蓖麻(Ricinuscommunis)、玉米(Zeamays)、小麦(Triticumaestivum)等植物中找到5个PeXTH的同源蛋白序列,分别是PttXTH16(ABM91073)、AtXTH24(NP_194756)、RcXTH(XP_002526228)、ZmXTH4(NP_001130486)、TaXTH5(AAT94297)。它们和PeXTH的同源性都在68%~99%,体现了PeXTH在进化上的高度保守性。多重氨基酸序列比对结果显示,PeXTH预测蛋白含有2个高度保守的结构域,一个是木葡聚糖内转糖苷酶/水解酶(XTHs)的催化活性域DEIDFEFLG[23],一个是紧跟着催化活性域的N-糖基化位点NLSG;此外,PeXTH还具有由24个氨基酸组成的N端信号肽序列(图1)。
2.2 转基因烟草的获得和鉴定
将重组表达载体pGreen0029-PeXTH经酶切鉴定后导入农杆菌LBA4404中,利用农杆菌介导法转化烟草。经过4周的分化培养,在烟草的叶盘边缘长出抗性再生芽,待再生芽长至1 cm长时转入生根培养基上继续生根,从而获得10株抗性再生苗。提取这10株再生苗的基因组DNA进行PCR检测,得到5个含PeXTH基因的株系,它们的扩增条带与阳性对照大小一致(均为900 bp左右),而野生型烟草株系没有扩增出该条带(图2),初步说明PeXTH基因已成功转入烟草中。
进一步收取这5个转基因株系的T1代种子,并选择其中2个株系(L6和L14)进行后续研究。提取这2个株系叶和根组织中的总RNA,通过Real-Time PCR的方法检测叶和根组织中PeXTH的表达水平,结果见图3。由图3可以看出,L6和L14转基因株系叶组织中的平均PeXTH表达量分别是野生型株系的43和47倍,根组织中的平均PeXTH表达量分别是野生型的44和57倍,说明PeXTH基因已经成功在这2个转基因株系中过表达。

图1 PeXTH和来自不同植物的XTH蛋白的多重序列比对黑色和灰色分别代表氨基酸的一致性和相似性;方框和短实线分别标注的是XTHs的催化活性域DEIDFEFLG和N-糖基化位点NLSG;虚线标注的24个氨基酸是预测的N端信号肽序列
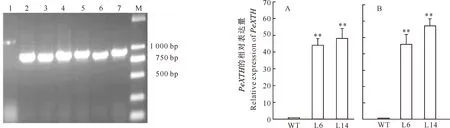
图2 T0代烟草叶片的基因组PCR检测
2.3 转基因烟草的抗镉性
2.3.1 Cd2+胁迫后烟草植株的生长表现 100 μmol/L Cd2+处理5 d后,野生型烟草的生长明显受到抑制,没有新叶长出,老叶发黄变卷(图4-A),根部褐化坏死、侧根稀少(图4-B),而转基因烟草的叶和根都没有明显的受损症状。与野生型烟草相比,Cd2+胁迫后转基因烟草的根长约是野生型烟草的1.5倍(图5-A),根和叶组织的干质量也显著高于野生型(P<0.05)(图5-B)。
2.3.2 Cd2+胁迫对烟草叶片细胞膜透性的影响 Cd2+对植物毒害的一个重要方面就是能够引发细胞膜脂质过氧化,破坏细胞膜结构,从而导致电解质外渗,细胞膜透性增加,相对电导率增大。由图6可以看出,100 μmol/L Cd2+处理5 d后,野生型烟草叶片的相对电导率高达83%,而转基因烟草只有30%左右,表明转基因烟草受Cd2+胁迫的毒害程度要远低于野生型烟草。

图4 转基因和野生型烟草在Cd2+胁迫后的表型比较
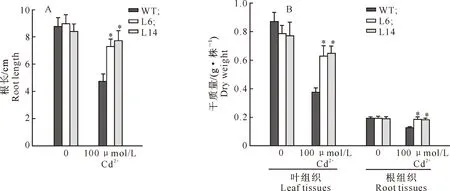
图5 转基因和野生型烟草在Cd2+胁迫后生长情况的比较
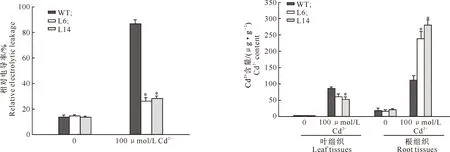
图6 Cd2+胁迫对转基因和野生型烟草叶片相对电导率的影响
2.3.3 Cd2+胁迫后烟草根、叶组织中Cd2+含量的变化 由图7可以看出,100 μmol/L Cd2+处理15 d后,转基因株系(L6和L14)根组织中积累的Cd2+含量分别是野生型株系的2.2倍和2.5倍;而在2个转基因株系的叶组织中,Cd2+含量却只有野生型株系的78.2%和67.5%。可见Cd2+胁迫下,转基因烟草根部积累Cd2+的能力要远高于野生型烟草。
2.3.4 Cd2+胁迫后烟草叶片中营养元素含量的变化 由表1可以看出,100 μmol/L Cd2+处理15 d后,野生型烟草的K+和Ca2+含量都显著降低(P<0.05),分别是对照的76%和55%,Mg2+含量没有显著改变(P<0.05);而转基因烟草K+、Ca2+、Mg2+含量在处理和对照中的变化都不大。

表 1 Cd2+胁迫对转基因和野生型烟草叶片中营养元素含量的影响
2.3.5 Cd2+胁迫后烟草叶片抗氧化酶活性的变化 植物体内的SOD是重要的抗氧化酶,能够有效清除细胞内产生的超氧阴离子,使之歧化成H2O2,过量的H2O2再由CAT和APX进一步清除。由表2可知,Cd2+胁迫不同程度地提高了转基因烟草叶片SOD、CAT、APX的活性。100 μmol/L Cd2+处理15 d后,L6和L14的SOD活性分别比对照增加了20%和36%,而野生型株系的SOD活性却比对照降低了24%;CAT和APX的变化趋势与SOD类似。
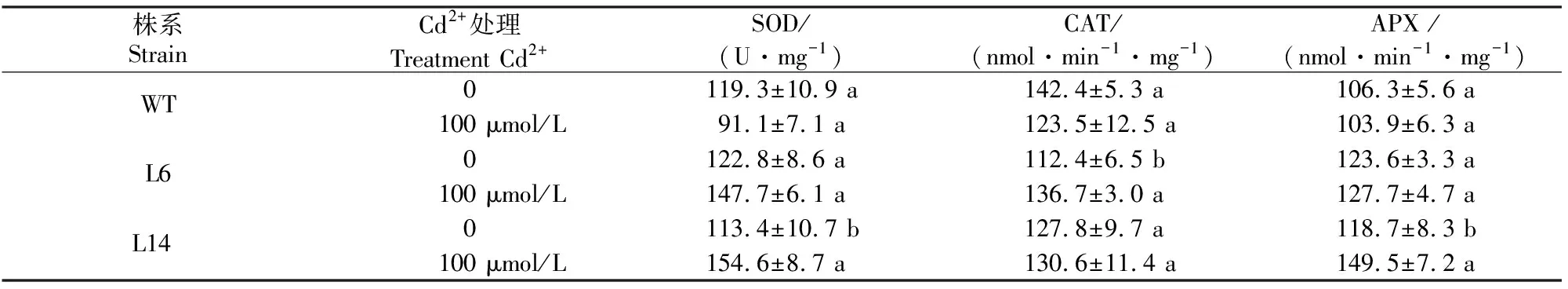
表 2 Cd2+胁迫对转基因和野生型烟草叶组织抗氧化酶活性的影响
2.3.6 Cd2+胁迫后烟草叶片净光合速率和蒸腾速率的变化 Cd2+胁迫能够降低植物的净光合速率和蒸腾速率。Cd2+胁迫对转基因和野生型烟草叶片净光合速率和蒸腾速率的影响见图8。
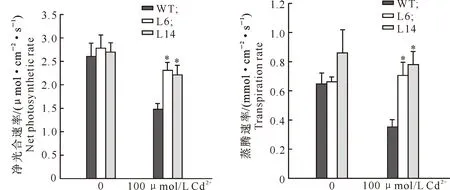
图8 Cd2+胁迫对转基因和野生型烟草叶片净光合速率和蒸腾速率的影响
由图8可以看出,100 μmol/L Cd2+处理15 d后,野生型株系叶片的净光合速率比对照下降了43%,而转基因株系L6和L14只分别比对照下降了17%和19%;此外,Cd2+处理后,野生型烟草的蒸腾速率大幅度降低,而转基因烟草降低的程度很小,L6的蒸腾速率甚至有所提高。
3 讨 论
本研究从胡杨中克隆了一个木葡聚糖内转糖苷酶/水解酶基因PeXTH,对其蛋白序列的比对分析结果显示,该蛋白和同样来自杨属的杂交山杨的XTH蛋白高度同源,并且含有木葡聚糖内转糖苷酶/水解酶的高度保守的结构域DEIDFEFLG和N-糖基化位点NLSG,这些结果都预示着PeXTH具有和其他XTH蛋白类似的结构和酶活性质。
有研究表明,细胞壁的组成成分(如纤维素、半纤维素、果胶)对重金属离子有结合作用。例如小麦(TriticumaestivumL.)细胞壁中的果胶是铝离子结合的主要位点之一[24]。蹄盖蕨(Athyriumyokoscense)根部所吸收的Cd2+、Cu2+、Zn2+等金属离子中有大部分是与纤维素及木质素结合存在的[7]。而木葡聚糖内转糖苷酶/水解酶(XTH)是细胞壁重构过程中的关键酶[9-10],具有改变细胞壁中纤维素、木质素等成分含量的作用[25-26],由此可以推断木葡聚糖内转糖苷酶/水解酶基因(XTHs)很可能通过调节细胞壁中Cd2+结合成分的含量来提高细胞壁对Cd2+的区隔能力,从而降低Cd2+对植物的毒害。为了验证胡杨PeXTH基因在植物抗Cd2+中的作用,本研究将该基因在烟草中过表达,结果显示转PeXTH基因的烟草在Cd2+胁迫后,根长和根叶组织干质量都显著高于野生型烟草,并且没有表现出典型的Cd2+毒害症状,说明转基因烟草的Cd2+耐受性明显增加,而进一步的生理指标测定结果也确证了这一现象。根叶组织Cd2+含量的测定结果显示,Cd2+胁迫下,转基因烟草根部积累Cd2+的能力要远高于野生型烟草。这种现象的发生很可能与PeXTH基因在烟草中的过表达相关。可以推测,转PeXTH基因的烟草很可能通过增加根组织细胞壁对Cd2+的区隔能力而将大量的Cd2+积累在根部,从而避免过多Cd2+向地上部分转运,以保证烟草各项生理机能的正常进行。
Cd2+胁迫使植物体内产生大量活性氧(如超氧阴离子、过氧化氢等),引发膜脂过氧化,损伤细胞膜系统,从而影响植物的正常生长[27]。同时,植物本身也存在着维持体内活性氧平衡的机制。许多研究表明,Cd2+胁迫能够诱导植物SOD、POD、CAT、APX等抗氧化酶活性的增加,从而及时清除体内产生的多余活性氧,维持植物的正常机能[28-29],但这种自我保护能力是有限度的,当细胞所受Cd2+胁迫超过一定范围时,植物就有可能丧失维持活性氧平衡的能力。本研究结果表明,Cd2+胁迫后,野生型烟草叶组织中SOD、CAT、APX的活性降低,相对电导率明显增加,而转基因烟草叶组织中这3种抗氧化酶活性明显提高,相对电导率变化幅度较小,细胞膜没有受到明显破坏。这可能是由于PeXTH基因的过表达使转基因烟草细胞壁结合Cd2+的能力增强,从而相应减小了Cd2+在细胞原生质体中的含量,保证了细胞内部正常活性氧平衡机制的运行;而野生型烟草细胞壁区隔Cd2+的能力较弱,容易造成胞内过强的Cd2+胁迫,超出自身的活性氧防御能力,从而使植株受到重度损伤。
除了破坏组织和细胞的活性氧平衡之外,Cd2+还能够竞争性结合植物营养阳离子的转运蛋白,从而影响营养元素的吸收[30]。本研究结果发现,Cd2+处理明显降低了野生型烟草叶组织中K+和Ca2+的含量,而对转基因烟草中这2种离子的影响不是很大。这可能是由于转基因烟草细胞壁较强的Cd2+区隔能力使得Cd2+向胞质内的转运减少,从而降低了对K+、Ca2+的转运竞争,保证了细胞对这2种营养阳离子的正常吸收。此外,Cd2+胁迫能够降低植物叶片PSⅡ活性[31]和光合色素含量[32],从而影响植物正常的光合速率。本研究结果表明,Cd2+处理后,转基因烟草叶片的净光合速率和蒸腾速率都显著高于野生型,进一步说明PeXTH基因的过表达使得转基因烟草的抗Cd2+性增强。
综上所述,本文从胡杨中克隆得到一个木葡聚糖内转糖苷酶/水解酶基因PeXTH,初步证明了该基因能够将大量Cd2+区隔在根组织中,减少Cd2+向地上部分的转运,从而增强烟草对Cd2+的抗性,但具体的分子和生理机制还有待深入研究,比如PeXTH基因在烟草组织细胞壁区隔Cd2+中所发挥的具体作用,以及该基因在Cd2+胁迫下所参与的信号传递等,这些问题的阐明将对植物抗Cd2+机制的研究产生十分重要的意义。
[参考文献]
[1] Sanitadi Toppi L,Gabbrielli R.Response to cadmium in higher plants [J].Environmental and Experimental Botany,1999,41(2):105-130.
[2] Zhu Y L,Pilon-Smits E A H,Jouanin L,et al.Overexpression of glutathione synthetase in Indian mustard enhances cadmium accumulation and tolerance [J].Plant Physiology,1999,119(1):73-80.
[3] Pomponi M,Censi V,Di Girolamo V,et al.Overexpression of Arabidopsis phytochelatin synthase in tobacco plants enhances Cd2+tolerance and accumulation but not translocation to the shoot [J].Planta,2006,223(2):180-190.
[4] Liu J R,Suh M C,Choi D.Phytoremediation of cadmium contamination:Overexpression of metallotionein in transgenic tobacco plants [J].Bundesgesundheitsbl-Gesundheitsforsch-Gesundheitsschutz,2000,43(2):126-130.
[5] Carrier P,Baryla A,Havaux M.Cadmium distribution and microlocalization in oilseed rape (Brassicanapus) after long-term growth on cadmium-contaminated soil [J].Planta,2003,216(6):939-950.
[6] Lozano-Rodríguez E,Hernández L,Bonay P,et al.Distribution of cadmium in shoot and root tissues of maize and pea plants:Physiological disturbances [J].Journal of Experimental Botany,1997,48(1):123-128.
[7] Nishizono H,Ichikawa H,Suziki S,et al.The role of the root cell wall in the heavy metal tolerance ofAthyriumyokoscense[J].Plant and Soil,1987,101(1):15-20.
[8] He J Y,Zhu C,Ren Y F,et al.Uptake,subcellular distribution,and chemical form of cadmium in wild-type and mutant rice [J].Pedosphere,2008,18(3):127.
[9] Fry S C,Smith R C,Renwick K F,et al.Xyloglucan endotransglycosylase,a new wall-loosening enzyme activity from plants [J].Biochemical Journal,1992,282(3):821-828.
[10] Nishitani K,Tominaga R.Endo-xyloglucan transferase,a novel class of glycosyltransferase that catalyzes transfer of a segment of xyloglucan molecule to another xyloglucan molecule [J].The Journal of Biological Chemistry,1992,267(29):21058-21064.
[11] Rose J K C,Braam J,Fry S C,et al.The XTH family of enzymes involved in xyloglucan endotransglucosylation and endohydrolysis:Current perspectives and a new unifying nomenclature [J].Plant and Cell Physiology,2002,43(12):1421-1435.
[12] Vissenberg K,Fry S C,Pauly M,et al.XTH acts at the microfibril-matrix interface during cell elongation [J].Journal of Experimental Botany,2005,56(412):673-683.
[13] Osato Y,Yokoyama R,Nishitani K.A principal role for AtXTH18 inArabidopsisthalianaroot growth:A functional analysis using RNAi plants [J].Journal of Plant Research,2006,119(2):153-162.
[14] Harada T,Torii Y,Morita S,et al.Cloning,characterization,and expression of xyloglucan endotransglucosylase/hydrolase and expansin genes associated with petal growth and development during carnation flower opening [J].Journal of Experimental Botany,2011,62(2):815-823.
[15] Saladié M,Rose J K C,Cosgrove D J,et al.Characterization of a new xyloglucan endotransglucosylase/hydrolase(XTH) from ripening tomato fruit and implications for the diverse modes of enzymic action [J].The Plant Journal,2006,47(2):282-295.
[16] Miedes E,Lorences E P.Xyloglucan endotransglucosylase/hydrolases (XTHs) during tomato fruit growth and ripening [J].Journal of Plant Physiology,2009,166(5):489-498.
[17] Nishikubo N,Takahashi J,Roos A A,et al.Xyloglucan endo-transglycosylase-mediated xyloglucan rearrangements in developing wood of hybrid aspen [J].Plant Physiology,2011,155(1):399-413.
[18] An G.Binary Ti vectors for plant transformation and promoter analysis [J].Methods in Enzymology,1987,153:292-305.
[19] Horsch R B,Fry J E,Hoffmann N L,et al.A simple and general method for transferring genes into plants [J].Science,1985,227(4691):1229-1231.
[20] Lutts S,Kinet J M,Bouharmont J.NaCl-induced senescence in leaves of rice (OryzasativaL.) cultivars differing in salinity resistance [J].Annuals of Botany,1996,78(3):389-398.
[21] Schickler H,Caspi H.Response of antioxidative enzymes to nickel and cadmium stress in hyperaccumulator plants of the genus Alyssum [J].Physiologia Plantarum,1999,105(1):39-44.
[22] 李妮亚.两种红树幼苗离子平衡及活性氧调控与耐盐性研究 [D].北京:北京林业大学,2008.
Li N Y.Regulation of ionic and reactive oxygen species homeostasis in seedlings of two mangrove and the relevance to salinity [D].Beijing:Beijing Forestry University,2008.(in Chinese)
[23] Campbell P,Braam J.Co- and/or post-translational modifications are critical for TCH4 XET activity [J].The Plant Journal,1998,15(4):553-561.
[24] Zheng S J,Lin X Y,Yang J L,et al.The kinetics of aluminum adsorption and desorption by root cell walls of an aluminum resistant wheat (TriticumaestivumL.) cultivar [J].Plant and Soil,2004,261:85-90.
[25] Genovesi V,Fornalé S,Fry S C,et al.ZmXTH1,a new xyloglucan endotransglucosylase/hydrolase in maize,affects cell wall structure and composition inArabidopsisthaliana[J].Journal of Experimental Botany,2008,59(4):875-889.
[26] Alexandersson E,Becker J V W,Jacobson D,et al.Constitutive expression of a grapevine polygalacturonase-inhibiting protein affects gene expression and cell wall properties in uninfected tobacco [J].BMC Research Notes,2011,4:493.
[27] Smeets K,Cuypers A,Lambrechts A,et al.Induction of oxidative stress and antioxidative mechanisms inPhaseolusvulgarisafter Cd application [J].Plant Physiology and Biochemistry,2005,43(5):437-444.
[28] Fornazier R F,Ferreira R R,Vitória A P,et al.Effect of cadmium on antioxidant enzyme activities in sugar cane [J].Biologia Plantarum,2002,45(1):91-97.
[29] Wu F,Zhang G,Dominy P.Four barley genotypes respond differently to cadmium:Lipid peroxidation and activities of antioxidant capacity [J].Environmental and Experimental Botany,2003,50(1):67-78.
[30] Perfus-Barbeoch L,Leonhardt N,Vavasseur A,et al.Heavy metal toxicity:Cadmium permeates through calcium channels and disturbs the plant water status [J].The Plant Journal,2002,32(4):539-548.
[31] Baszyńki T,Wajda L,Król M,et al.Photosynthetic activities of cadmium-treated tomato plants [J].Physiologia Plantatum,1980,48(3):365-370.
[32] Siedlecka A,Krupa Z.Interaction between cadmium and iron and its effects on photosynthetic capacity of primary leaves ofPhaseolusvulgaris[J].Plant Physiology and Biochemistry,1996,34(6):833-841.
