伤寒沙门菌线性质粒pBSSB1的p17基因的生物学功能分析
2014-03-21朱云霞吴佳龚明玉侯书宁张绮思陈敏洁张海方
朱云霞吴佳龚明玉侯书宁张绮思陈敏洁张海方,2
(1.江苏大学 基础医学与医学技术学院 医学生物化学系,镇江 212013;2.苏州大学 附属第二医院 检验科,苏州 215004)
伤寒沙门菌线性质粒pBSSB1的p17基因的生物学功能分析
朱云霞1吴佳1龚明玉1侯书宁1张绮思1陈敏洁1张海方1,2
(1.江苏大学 基础医学与医学技术学院 医学生物化学系,镇江 212013;2.苏州大学 附属第二医院 检验科,苏州 215004)
H:z66阳性伤寒沙门菌含有一特有的介导鞭毛单向相变换的线性质粒pBSSB1,其上第17号基因(p17)编码一未知功能蛋白(P17)。利用λ-Red系统制备p17基因缺陷变异株,测定变异株和野生株的生长曲线,比较其生长差异,同时通过半固体LB培养基进行动力试验比较其动力差异。利用PCR技术扩增获得p17基因,构建其重组表达载体pET28a(+)-p17,通过镍柱纯化目的蛋白P17-His6,纯化后蛋白作为抗原免疫兔子以制备多克隆抗体。结果显示,制备了p17基因缺陷变异株,变异株的生长明显迟缓于野生株(P<0.05),变异株的动力明显减弱。构建了重组表达载体pET28a(+)-p17,纯化获得了高纯度的目的蛋白P17-His6并制得相应的多克隆抗体。
伤寒沙门菌 线性质粒 pBSSB1 p17
伤寒沙门菌是一种重要的人类病原菌,且已成为原核生物基因表达调控研究的模式菌之一[1,2]。pBSSB1是H∶z66阳性伤寒沙门菌所特有的一线性质粒,该质粒是肠杆菌科中目前为止发现的首个线
性质粒,其介导了H∶z66阳性伤寒沙门菌鞭毛的单向相变换[3-6]。pBSSB1全长27 kb,共编码33个基因,其中包括二相鞭毛素编码基因fljBz66和fljA样基因[3,7,8]。Baker等[3]报道pBSSB1可能的双向复制起始点位于该质粒编码的第17号基因(p17)的上游。基因p17经生物信息学分析和预测,其编码蛋白P17含有特征性同源序列,该序列存在于参与调控DNA复制等生物学功能的DNA结合蛋白如ParA和Soj等蛋白中[9]。另外,蛋白P17具有与RepABC质粒编码的RepA蛋白同源的ATP酶结构域[10]。但目前为止,关于基因p17的确切生物学功能还不甚清楚。
本研究通过制备p17基因缺陷变异株,测定缺陷株和野生株的生长曲线,对p17基因可能的生物学功能进行初步探讨;另外,通过原核表达蛋白P17,并制备其相应的多克隆抗体,利用免疫印迹技术检测抗体的特异性以及p17基因的表达情况,旨为深入研究p17基因的生物学功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒 伤寒沙门菌GIFU10007由日本岐阜大学医学院微生物室惠赠;质粒pKD46(温度敏感型,含有受阿拉伯糖启动子调控的gam,bet和exo基因,Apr)由北京军事医学科学院微生物流行病研究所惠赠;质粒pET28a(+)、E. coli DH5α、E. coli BL21(DE3)等均由本室保存。
1.1.2 主要试剂和仪器 DNA聚合酶pfu、DNA聚合酶rTaq、限制性核酸内切酶Nco I、Xho I、T4 DNA连接酶均购自宝生物工程有限公司(大连,TaKaRa),质粒提取试剂购自Axygen公司。其他试剂均为进口或国产分析纯。Gene Pulsero Ⅱ电转化仪(Bio-Rad),核酸紫外检测仪(Eppendorf Biophotometer),PCR仪(AB I 2720),蛋白电泳仪(Bio-Rad),凝胶成像系统(Gene Genius BIO IMAGING SYSTEM),蛋白电泳仪(Bio-Rad),离心机,超声破碎仪。
1.2 方法
1.2.1 引物设计 根据线性质粒pBSSB1的序列和pET28a(+)的序列信息,设计基因p17缺陷株制备、缺陷株验证及构建p17编码蛋白P17的重组表达载体pET28a(+)-p17等引物。制备p17基因缺陷株引物设计:p17基因的ORF全长641 bp,分别设计两对引物L1-Kl/R1-Kr和L2/R2,扩增含有长度为79 bp的p17ORF上下游同源臂的卡那霉素抗性基因片段,用来敲除p17全部的ORF。p17缺陷株验证引物V-L/V-R设计:V-L来自基因序列中上游同源臂外侧一段16 bp的序列,V-R来自卡那霉素抗性基因中一段16 bp的序列。重组表达载体pET28a(+)-p17引物设计:在p17基因上下游设计引物PA/PB,在5'端分别加上Nco I及Xho I酶切位点用以酶切后连接pET28a(+)载体。引物均由上海生工生物技术服务有限公司合成,序列如表1所示 。
表1 引物序列
1.2.2 感受态细胞的制备及Red重组功能的诱导 将编码Red重组系统的质粒pKD46电转至伤寒沙门菌GIFU10007中,筛选阳性克隆,作为下一步转化的宿主菌,即007-pKD46。挑取007-pKD46单菌落接种于2 mL LB培养基中37℃、250 r/min振摇过夜;然后1∶100转接至20 mL等渗LB培养基中,
37℃、250 r/min振荡培养至对数早期(OD600:0.4);加入L-阿拉伯糖(终浓度为1 mmol/L),诱导1 h后冰上静置30 min,离心弃上清;沉淀用预冷的灭菌水漂洗3次,再用4 mL预冷的10%甘油洗1次,最后用80 μL预冷的10%甘油悬浮,每40 μL分装于EP管中放于冰上备用。
1.2.3 基因p17缺陷株的制备 在参考文献[11]的基础上稍作改动,主要步骤如下:以环状质粒pET28a(Kanr)为模板,用特异性引物L1-Kl/R1-Kr扩增出带有p17基因上下游同源臂的卡那霉素抗性基因片段F1。然后以第1轮PCR产物为模板,用L2/R2做引物扩增出延长了同源臂的片段F2。用酚-氯仿抽提纯化PCR产物F2。将007-pKD46的感受态细胞、电极杯和PCR产物均放于冰上,保持低温状态。打开电转仪,调节参数:电阻200 Ω,电容25 μF,电压2.0 kV。取2 μg PCR产物F2加入40 μL感受态细胞中,轻轻混匀,转入电极杯中,迅速放到电转仪上,启动电击。听到“滴”声后,取出电极杯,加入1 mL 37℃预温的LB液体培养基轻轻混匀,转移至EP管中,置于37℃金属浴1 h。然后25℃、4 000 r/min,离心10 min,弃去900 μL上清液,将剩余液体重悬细菌后涂布于含有卡那霉素的LB平板37℃过夜,挑取长出的若干菌落通过验证引物V-L/V-R进行PCR筛选,阳性转化子最后经测序确认,即为p17基因缺陷株,命名为Δp17。
1.2.4 生长曲线测定 分别挑取伤寒沙门菌GIFU10007和Δp17单菌落于2 mL LB培养基中,37℃、250 r/min振荡培养过夜;过夜细菌以1∶100转接于新鲜等渗(pH 7.0)LB培养液中(野生株和缺陷株的OD600值一致),37℃、250 r/min振荡培养,每隔1 h用分光光度计检测OD600值并记录,直至12 h。试验经3次生物学重复后,以OD600值为纵坐标,培养时间为横坐标制作生长曲线,比较野生株和p17缺陷株的生长情况。
1.2.5 动力试验 分别挑取伤寒沙门菌GIFU10007和Δp17单菌落进行四区划线,用灭菌后的牙签挑取划线后的大小均匀的野生株和Δp17单菌落接种于0.3%的半固体LB培养板上,置于37℃培养箱中培养18 h后观察结果。
1.2.6 重组载体的构建与鉴定 参考文献[12]的方法,用DNA胶回收试剂盒回收PCR 产物,NcoⅠ和Xho Ⅰ同时双酶切PCR回收产物和表达载体pET28a(+),酶切产物用酚/氯仿抽提、乙醇沉淀纯化后,用T4 DNA连接酶4℃过夜连接,连接产物用热激法转化至大肠杆菌DH5α。挑取若干连接产物转化菌单菌落,分别增菌于含有卡那霉素的LB平板上,37℃培养6 h后,收集上述菌体于30 μL 双蒸水中,加等体积的酚/氯仿漩涡震荡,离心取上清15 μL上样,1 %琼脂糖凝胶电泳观察质粒大小,筛选可疑的阳性克隆质粒。提取可疑的阳性克隆质粒,采用双酶切和PCR方法鉴定阳性克隆,再通过DNA测序分析最终确认。阳性克隆质粒热激法转化至E. coli BL21(DE3)。
1.2.7 P17蛋白的表达 挑取新鲜的含重组质粒pET28a(+)-p17的大肠杆菌BL21(DE3)单菌落及含空质粒pET28a(+)的对照大肠杆菌BL21(DE3)单菌落分别置于2 mL LB 培养液中(卡那霉素终浓度50 μg/mL),37℃振摇过夜,次日以1∶100加入20 mL LB 培养液中37℃振摇2-3 h后长至OD600nm为0.5-0.8,加入IPTG 至终浓度分别为0.1 mmol/L,于20℃继续振摇5 h进行诱导,离心取沉淀,4℃超声破碎后离心取上清液进行SDS-PAGE。
1.2.8 P17蛋白的纯化 在上述表达的优化条件下用1 000 mL LB培养基大批量诱导培养,离心收集菌体后,用PBS(pH7.2)洗涤3次,按照每克菌(湿重)加入15 mL 过柱缓冲液的比例重悬菌体,超声破碎后离心收集上清液。以15 mL/h流速上样于Ni柱中之后用20 倍柱体积的洗涤缓冲液冲洗Ni柱,移除未结合的蛋白;用洗脱缓冲液洗脱结合于Ni柱的蛋白。收集洗脱液,加入到处理后的透析袋中进行透析,透析后的蛋白取出离心取上清,并进行SDS-PAGE。
1.2.9 兔抗P17蛋白的多克隆抗体的制备 首次免疫取上述纯化获得的目的蛋白P17与弗氏完全佐剂1∶1乳化,按每只兔50 μg/mL抗原剂量,于背部皮下多点注射共计1 mL的方式进行免疫,之后每隔1周用弗氏不完全佐剂与纯化获得的目的蛋白P17以1∶1乳化,共免疫5次,末次免疫1周后颈动脉取血制备抗血清。抗血清经初步纯化后获得兔抗P17蛋白的多克隆抗体,分装后于-80℃保存备用。用抗体与伤寒沙门菌GIFU10007全菌蛋白进行Western-
blotting以检测抗体的特异性,具体方法见参考文献[12]。
1.2.10 统计学分析 数据分析采用 SPSS 16.0 统计软件。多组间均数比较采用单因素方差分析,以 P <0.05 为差异有统计学意义。
2 结果
2.1 伤寒沙门菌pBSSB1-17基因缺陷变异株的制备
如图1所示,PCR扩增得到1 165 bp的F1片段,以F1片段为模板,PCR扩增获得含同源臂的1 243 bp的片段F2;将F2片段电击转化入含有pKD46的伤寒沙门菌野生株感受态细胞中,在含卡那霉素(终浓度为50 μg/mL)的LB平板筛选到了阳性克隆,用V-L/V-R作引物通过PCR验证8个阳性克隆,均获得了272 bp的DNA片段,与预期结果一致,证明p17基因缺陷株制备成功,命名为Δp17。
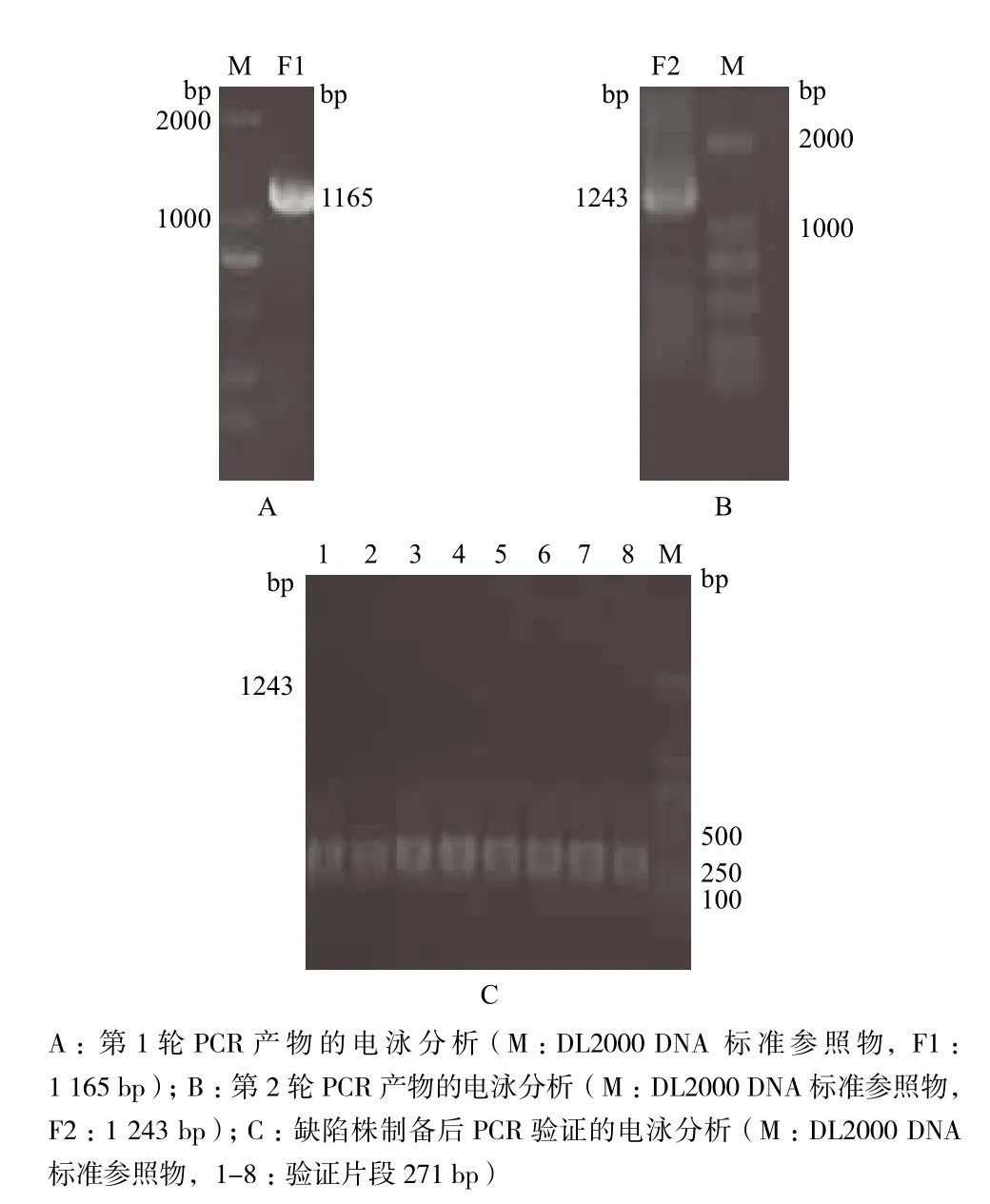
图1 伤寒沙门菌pBSSB1的p17基因缺陷变异株的制备
2.2 p17基因缺陷株生长特性分析
p17基因缺陷株和伤寒沙门菌GIFU10007野生株在普通培养条件下的生长曲线如图2所示,结果表明Δp17的生长能力明显迟缓于野生株(P<0.05),提示p17基因可能参与调控细菌的生长。
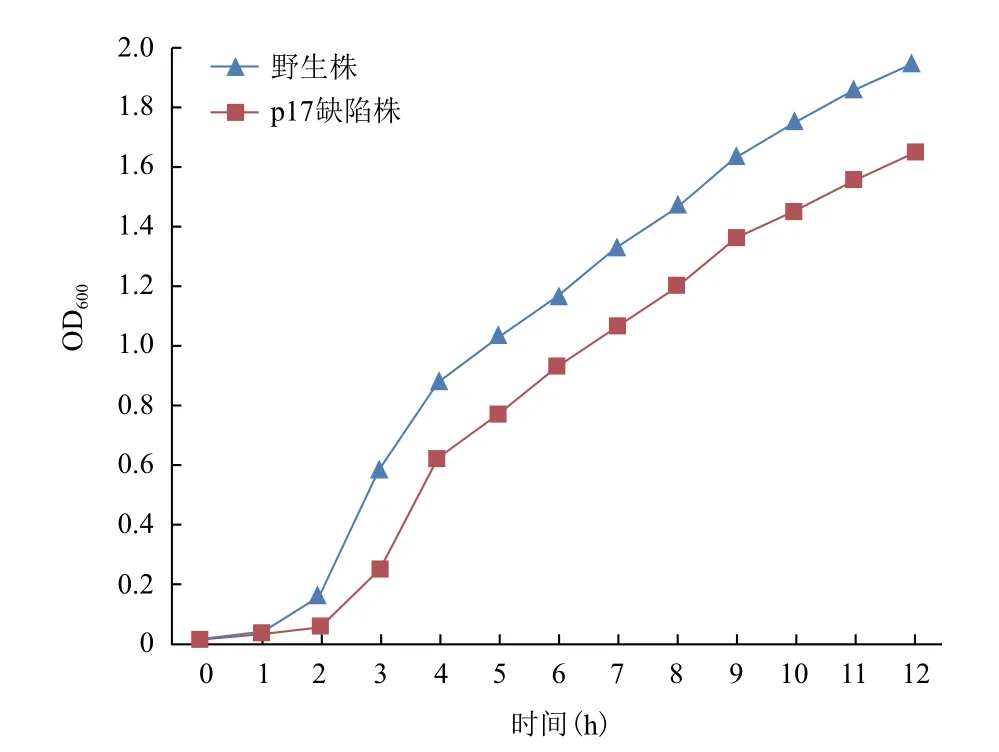
图2 伤寒沙门菌GIFU10007野生株和p17基因缺陷株的生长曲线
2.3 野生株和缺陷株的动力比较
伤寒沙门菌GIFU10007野生株和p17基因缺陷株在0.3%的半固体培养基上的动力比较如图3所示,p17基因缺失后其动力明显减弱,说明p17基因参与调控细菌的动力。

图3 伤寒沙门菌GIFU10007野生株和p17基因缺陷株的动力图
2.4 伤寒沙门菌P17蛋白表达载体的构建
如图4所示,PCR扩增获得了与预期大小相符的646 bp的p17基因片段。该片段经NcoⅠ和XhoⅠ双酶切后克隆到表达载体pET28a(+)上,将重组质粒pET28a(+)-p17转化至大肠杆菌DH5α得到了阳性克隆 。提取阳性克隆的质粒,经Nco I和Xho Ⅰ双酶切获得约646 bp的片段,大小与PCR 产物一致,证明P17蛋白表达载体构建成功。

图4 重组表达载体ET28a(+)-p17的鉴定
2.5 P17-His6重组蛋白的表达与纯化
在最佳的条件即20℃,IPTG终浓度为0.1 mmol/L进行诱导5 h,上清经Ni柱纯化获得P17-His6蛋白,结果如图5所示。
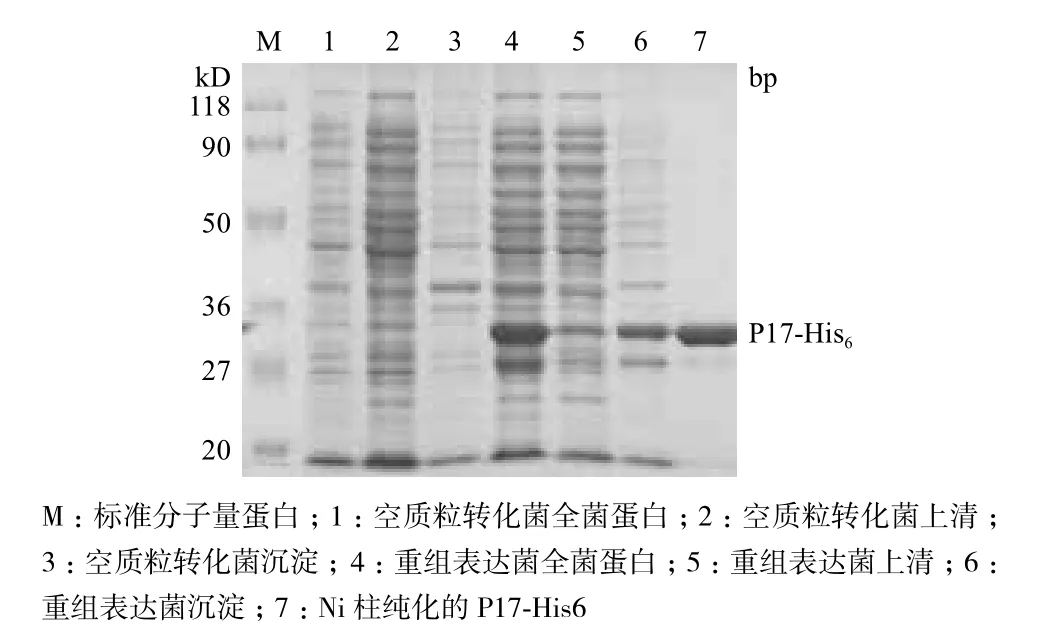
图5 重组蛋白P17-His6的表达与纯化
2.6 兔抗P17-His6多克隆抗体的鉴定及应用
将重组蛋白P17-His6免疫兔子制备了兔抗P17的多克隆抗血清,纯化后的多克隆抗体与伤寒沙门菌GIFU10007野生株和p17基因缺陷株的全菌蛋白经Western blotting鉴定,如图6所示,在缺陷株中未鉴定到p17基因的编码蛋白P17,说明所制备的抗体与抗原反应的特异性良好,同时也说明p17基因在正常生长条件下有一定的表达,提示该基因具有一定的生物学功能。
3 讨论
质粒是指细菌、酵母菌和放线菌等生物中染色体以外的DNA分子,它们能为宿主提供抗药性等一些额外的功能[13]。绝大多数的细菌质粒都是闭合环状DNA分子,1979年在娄彻霉菌中发现了第一例原核生物线性质粒,该发现纠正了所有细菌质粒都是环状结构这一传统观点[14]。

图6 抗体特异性的免疫印迹鉴定
线性质粒pBSSB1介导H∶z66阳性伤寒沙门菌的鞭毛单向相变换,该质粒全长27 kb,共编码33个基因,其表达特性已由本实验室报道,特别是其中二相鞭毛素编码基因fljBz66和fljA样基因功能已明确[3-8,15,16]。另外,我们发现 Fis蛋白可以影响pBSSB1的稳定性[17]。通过对其序列比对分析和GC含量偏移分析发现,紧邻基因p17的上游可能是该质粒的一个双向复制起始位点。基因p17编码蛋白(P17),具有ParA和Soj蛋白的高度同源结构域序列。研究表明,ParA和Soj蛋白参与许多质粒、噬菌体和细菌基因组染色体DNA的复制和分配[9]。另外,P17具有与RepABC质粒编码的RepA蛋白同源的ATP酶结构域,在17号基因的编码区上游含有GANTC序列,该序列是RepABC质粒编码的repABC操纵子所具有的特征性序列[10]。另外,Zhang等[18]在研究链霉菌属线性质粒pFRL1时发现编码的rlr基因可以帮助启动该质粒的复制,由于rlr基因也紧邻线性质粒pFRL1的复制起始区,我们推测线性质粒pBSSB1编码的17号基因可能和链霉菌线性质粒pFRL1的rlr基因具有类似的功能。但是,P17蛋白在伤寒沙门菌中发挥作用的分子机制还有待于深入研究。
4 结论
本研究首次制备了伤寒沙门菌pBSSB1的p17基因缺陷株,发现缺陷株的生长明显迟缓于野生株,且p17基因缺失后细菌的动力明显减弱,这提示基因p17可能具有调控细菌的生长和动力等功能;另外,克隆表达了基因p17,纯化获得了重组蛋白P17-His6及其多克隆抗体,为进一步深入研究基因p17的生物学功能及其作用机制奠定了坚实的基础。
[1]Everest P, Wain J, Roberts M, et al. The molecular mechanisms of severe typhoid fever[J]. Trends Microbiol, 2001, 9(7):316-
320.
[2]张海方. 沙门菌黏附和侵袭肠黏膜细胞的分子基础[J]. 生命的化学, 2011, 31(1):124-127.
[3]Baker S, Hardy J, Sanderson KE, et al. A novel linear plasmid mediates flagellar variation in Salmonella typhi[J]. PLoS Pathog, 2007, 3(5):e59.
[4]Baker S, Holt K, Whitehead S, et al. A linear plasmid truncation induces unidirectional flagellar phase change in H:z66 positive Salmonella typhi[J]. Mol Microbiol, 2007, 66(5):1207-1218.
[5]张海方, 黄新祥, 张晓磊, 等. 抗H:z66抗体诱导z66+伤寒沙门菌鞭毛相变换特点的探讨[J]. 苏州大学学报:医学版, 2010, 30(6):1171-1175.
[6]张海方. 沙门菌鞭毛基因表达的相变换研究进展[J]. 安徽农业科学, 2010, 38(34):19254-19255, 19265.
[7]Zou X, Huang X, Xu S, et al. Identification of fljA located on a linear plasmid as a repressor gene of fliC in Salmonella enterica serovar Typhi[J]. Microbiol Immunol, 2009, 53(4):191-197.
[8]Xu S, Zou X, Sheng X et al. Expression of fljB:z66 on a novel linear plasmid of Salmonella enterica serovar Typhi is dependent on FliA and FlhDC and regulated by OmpR[J]. Braz J Microbiol, 2010, 41(3):729-740.
[9]Hester CM, Lutkenhaus J. Soj(ParA)DNA binding is mediated by conserved arginines and is essential for plasmid segregation[J]. Proc Natl Acad Sci USA, 1999, 96(1):73-78.
[10]Pinto UM, Pappas KM, Winans SC. The ABCs of plasmid replication and segregation[J]. Nat Rev Microbiol, 2012, 10(11):755-765.
[11]詹莉芳, 张晓磊, 翁晓琴, 等.OxyR蛋白不同应激条件下伤寒沙门菌生存能力的影响[J]. 江苏大学学报:医学版. 2013, 23(2):93-98.
[12]张海方, 高宇琳, 黄新祥, 等. 伤寒沙门菌鞭毛素基因fljB:z66的克隆表达及其多克隆抗体的制备[J]. 江苏大学学报:医学版, 2009, 19(5):376-379.
[13]朱云霞, 赵昕, 张绮思, 张海方. 细菌线性质粒的复制研究[J]. 生物技术通报, 2014(5):32-36.
[14]Hayakawa T, Otake N, Yonehara H, et al. Isolation and characterization of plasmids from Streptomyces[J]. J Antibiot, 1979, 32(12):1348-1350.
[15]Xu S, Zhang H, Sheng X, et al. Transcriptional expression of fljB:z66, a flagellin gene located on a novel linear plasmid of Salmonella enterica serovar Typhi under environmental stresses[J]. New Microbiol, 2008, 31(2):241-247.
[16]Zhao X, Zhu Y, Zhang H, et al. Transcriptional expression of 6 genes located on pBSSB1 of Salmonella enterica serovar Typhi in different growth phases and environmental stresses[J]. Curr Microbiol, 2014, 69(3):252-257.
[17]Zhang H, Ni B, Zhao X, et al. Fis is essential for the stability of linear plasmid pBSSB1 and affects the motility of Salmonella enterica serovar Typhi[J]. PLoS One, 2012, 7:e37462.
[18]Zhang R, Peng S, Qin Z. Two internal origins of replication in Streptomyces linear plasmid pFRL1[J]. Appl Environ Microbiol, 2010, 76(17):5676-5683.
(责任编辑 李楠)
A Preliminary Study on the Biological Function of a Gene p17 Located on a Linear Plasmid pBSSB1 of Salmonella enterica serovar Typhi
Zhu Yunxia1Wu Jia1Gong Mingyu1Hou Shuning1Zhang Qisi1Chen Minjie1Zhang Haifang1,2
(1. Department of Biochemistry and Molecular Biology,School of Medical Science and Laboratory Medicine,Jiangsu University,Zhenjiang 212013;2. Department of Clinical Laboratory,the Second Affiliated Hospital of Soochow University,Suzhou 215004)
pBSSB1 is a linear plasmid which mediates the flagellar phase variation in H:z66 positive Salmonella enterica serovar Typhi(S. Typhi). The gene named p17 is located on pBSSB1 and it encodes the protein P17 whose function is unknown. The p17 deleted mutant of S. Typhi was prepared through the λ-Red recombination system. The growth curves of wild type and p17 mutant strain were detected to compare their growth ability. The motility of wild type and p17 mutant strains was compared through the experiments on the semi-solid LB plates. The specific primers were designed to amplify the gene p17 by PCR. The amplicon was inserted into the expression vector pET28a(+)to construct recombinant vector pET28a(+)-p17, which was then transferred to E. coli BL21(DE3)to be expressed. The recombinant protein P17-His6was purified with Ni-TED packed column and was used as immunogen to prepare the rabbit anti-P17 polyclonal antibody. The results showed that p17 deleted mutant of S. Typhi was constructed successfully. It was showed that the growth of p17 mutant strain was significantly slower compared with the wild type strain(P<0.05). The motility of p17 mutant strain was decreased obviously compared to the wild type strain. The gene p17 of S. Typhi was inserted into the vector pET-28a(+)and was expressed in E. coli BL21(DE3). The rabbit anti-P17 polyclonal antibody was prepared.
Salmonella enterica serovar Typhi Linear plasmid pBSSB1 p17
2014-02-25
国家自然科学基金项目(31000076),中国博士后科学基金项目(2013M531278),江苏省博士后科研资助计划项目(1202011B),江苏大学大学生科研立项资助项目(12A123,13A239)
朱云霞,女,硕士研究生,研究方向:病原菌分子致病机制;E-mail:zhuyunxia3032@163.com
张海方,男,博士,副教授,研究方向:分子细菌学;E-mail:haifangzhang@sina.com
