无脊椎动物胰岛素样蛋白(Insulin-like/related peptides)研究进展
——以昆虫为例
2014-03-21张龙辉王国栋
张龙辉 王国栋
(集美大学水产学院,厦门 361021)
无脊椎动物胰岛素样蛋白(Insulin-like/related peptides)研究进展
——以昆虫为例
张龙辉 王国栋
(集美大学水产学院,厦门 361021)
胰岛素样蛋白(Insulin-like/related peptides,ILPs)是无脊椎动物中胰岛素的同源基因。以昆虫为例,概述了ILPs的结构、表达以及相关通路特别是胰岛素信号通路(Insulin signaling pathway),并总结了其在调控机体生长、发育、新陈代谢、繁殖和免疫等生命过程中的作用。
昆虫 胰岛素样蛋白 胰岛素信号通路 调控功能
胰岛素自1922年被发现以来,被认为是血糖水平的主要调控因子。鱼类、哺乳类等脊椎动物中,胰岛素结构和功能保守。无脊椎动物,如线虫、软体动物和昆虫中,存在与脊椎动物胰岛素序列相似的蛋白,通常命名为胰岛素样蛋白(Insulin-like peptide,ILP)或胰岛素相关蛋白(Insulin-raleted peptide,IRP)。胰岛素样蛋白(Insulin-like/related peptides,ILPs)由胰岛素受体(Insulin receptor,IR)结合,进入信号蛋白网络,启动胰岛素信号通路(Insulin signaling pathway,ISP)、丝裂源活化蛋白激酶(Mitogen activated protein kinase,MAPK)通路信号、雷帕霉素靶蛋白(Target of rapamycin pathway,TOR)信号通路,调控生长、发育、新陈代谢、繁殖及免疫等生命过程。
无脊椎动物胰岛素样蛋白自发现至今,被广泛研究,特别是对昆虫ILPs的研究全面而深入。昆虫ILP蛋白结构保守,其加工修饰、分泌、所参与的信号通路等与脊椎动物比较相似。其他无脊椎动物的ILP的化学性质、基因结构、分泌调控、生理功能等,相关信号通路及其作用机制的研究缺乏系统性,尚需充实。本研究以模式生物果蝇为例,结合其他无脊椎动物,综述无脊椎动物胰岛素样蛋白的研究进展,以期为线虫、贝类等无脊椎生物胰岛素样蛋白及相关通路的研究提供参考。
1 无脊椎动物中的胰岛素样蛋白
1984 年,Nagasawa等[1]在家蚕(Bombyx mori)中发现的家蚕素(Bombyxin),这是在无脊椎动物中首次发现ILP。随后,在B. mori中相继发现38
种ILPs[2]。核酸测序技术与生物信息学结合运用,在12种果蝇、20个不同种类的昆虫、4种软体动物和2种后口动物等38个物种中发现了211个ILPs[2-4]。节肢动物、尾索动物和软体动物等的ILPs的进化分析表明,节肢动物与软体动物有共同的原口类祖先[2]。另外,在杂色鲍(Haliotis diversicolor)、耳鲍(Haliotis asinina)[5]、三角涡虫(Schmidtea mediterranea)[6]、椎实螺(Lymnaea stagnalis)及线虫(Caenorhabditis elegans)等生物中也相继发现多种胰岛素样蛋白。
1.1 ILPs结构特点
无脊椎动物ILPs是一类由多种特定基因编码,分泌后成为蛋白激素、神经递质和生长因子等。在结构上,这些蛋白与脊椎动物的胰岛素类似,包括NH2-端分泌信号肽(Signal peptide,SP)、B chain、不保守的C chain和A chain。其生物活性依赖链接B chain 与A chain 的两个二硫键及A chain 内部的一个二硫键,并且,B chain、A chain 中半胱氨酸的位置非常保守[7,8]。
图1为无脊椎动物ILPs蛋白和基因结构示意图。DILP1-7中包含3个二硫键——链接B chain 和A chain的2个及A chain内部的1个DILP2,3,4,5与人胰岛素一样,包含SP、B chain、C chain及A chain,且功能域顺序、大小相近;DILP1,7的B chain NH2-端较人胰岛素长;而DILP6 的C chain短,且包含在B chain中,与人IGF的C chain同源。图1-C为果蝇DILP1-7、蝗虫胰岛素样蛋白(Locusta migratoria insulin-like peptide,LIRP)、家蚕Bombyxin A1/E1/G1/A2、樗蚕(Samia cynthia)S.cynthia A2、线虫C. elegans IRP(Insulin-related peptide)、椎实螺MIP与人胰岛素(Human insulin)、人IGFs(Human IGF-I/II)B chain(C-1)、A chain(C-2)序列同源比对结果,半胱氨酸(黑体)数量及位置高度保守。
1.2 昆虫ILPs表达和分泌
同其他蛋白类激素一样,昆虫ILPs在中央神经分泌细胞(Medial neurosecretory cells,MNCs)、中肠表达、脂质体[10,11],且主要在MNCs表达[12]。通常,蛋白类激素是由同一个基因翻译为长的前体蛋白,“特异性”水解后后成为不同形式的蛋白,而ILPs则是多个不同基因编码多个不同的蛋白[2]。ILPs在MNCs合成加工后释直接放到与心侧体(Corpora cardiaca,CC)动脉、中肠相连的神经血管[13],其释放受脑部调控,在血清中水解,或与受体结合后降解[2]。作为蛋白类激素,成熟ILPs在细胞中合成、储存并分泌,因此ILPs的转录本和蛋白含量无显著相关性[13]。
值得注意的是,MNCs是在胚胎形成时由1对神经母细胞发育分化形成[14],位于神经外皮层;与其相邻的成神经细胞发育分化为CC,位于神经外皮层,形成环腺的一部分,合成脂动激素(AKH)。这种“布局”与脊椎动物脑中下丘脑-肾上腺轴类似[14]。脊椎动物的IGF和松弛肽(Relaxin)在脑中表达并发挥作用[15],而胰岛素在胰岛合成分泌后转运至肠分泌细胞中发挥作用,胰岛细胞的形成和功能受转录因子PAX6调控;果蝇中MNCs的分化受Eyeless同系物的调控[16]。表明昆虫ILPs与哺乳动物胰岛素功能及其分泌组织存在一定的保守性。
果蝇DILP1-5均在MNCs中表达。此外,DILP3在幼虫和成体中肠中也有表达,DILP2、4、5、6在胚胎或幼虫消化道中表达,DILP5也在卵泡和马氏管中表达。不同发育阶段MNCs中不同DILP的表达水平不同,并且受内外因子调控而补偿表达,这表明存在不同的启动因子/加强因子调控DILPs的表达[17]。DILP6、7的组织表达模式不同于DILP1-5。DILP6来自脂质体,其结构、来源、功能与IGF相似[13],DILP7在头腹部神经节的8对细胞中表达,为神经递质[18],DILP8由成虫芽合成分泌,调控生长发育及发育的稳定性[3,4]。
在蚊子、家蚕及蜜蜂(Apis mellifera)等昆虫中有类似发现。在蚂蚁中,ILPs在MNCs、中肠等组织中表达,且某些ILPs在脂质体或中肠特异表达,也可能是IGF的同源基因[19]。蜜蜂(A. mellifera)中有2个ILPs,在脑中有不同的转录水平,其他组织中不表达[20];家蚕(B. mori)蛹的血淋巴中分离到来自脂质体的IGF-like 蛋白[21]。
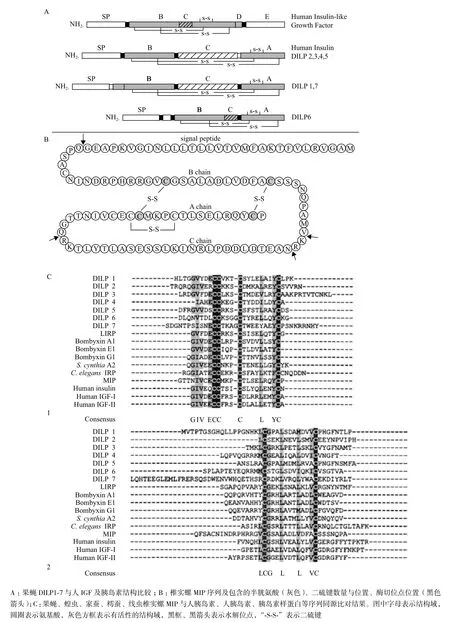
图1 无脊椎动物ILPs与人胰岛素、IGFs的蛋白结构比较和基因同源比对[5,8,9]
在分泌前,与哺乳动物胰岛β细胞中分泌胰岛素类似,昆虫ILPs与其相应的加工酶一同“打包”成分泌囊泡,并被加工修饰[22]。脊椎动物前胰岛素的B chain和A chain由二硫键连接后,C chain被两
个激素原转化酶和一个羧肽酶切除[23]。在果蝇中,编码激素原转化酶PC2同系物的基因在神经系统到消化道的神经分泌细胞中表达,并与助手基因7B2共表达[24]。PC2的表达是果蝇发育,特别是CC中AKH加工与行使功能是必需的[25],但尚不知其在ILPs加工过程中的作用。尽管如此,这也表明昆虫中分泌蛋白(ILPs)的酶加工,与哺乳类的胰岛素类似。
进入血液的ILPs在血清中被水解,或由结合蛋白(Binding protein,BPs)“保护”转运至受体[26],受体二聚体化,形成复合体,引发一系列蛋白的磷酸化,激活信号通路,而后被降解,受体回到细胞膜表面。
2 胰岛素信号通路
除埃及伊蚊(Aedes aegypti)ILP3外,昆虫ILPs只有一个受体——胰岛素受体(Insulin receptor,IR)[27]。IR为二聚体膜蛋白,包含2个膜外α亚基、2个二硫键链接的膜内β酪氨酸激酶亚基。昆虫与哺乳动物细胞中,ILPs(Insulin)与IR结合,激活典型的ISP或TOR通路。
在昆虫ISP通路中,多种ILPs蛋白异形体与唯一的受体蛋白结合,因此较哺乳类的ISP通路复杂得多[12]。ILPs与IR结合后,胰岛素信号启动,导致一系列蛋白的磷酸化,进而激活ISP通路或MAPK通路的分支及其相关通路,如PI3K通路,果蝇中MAPK通路和PI3K通路交叉串联。此外,ISP通路的一个分支,能激活TOR信号通路。它们共同调控新陈代谢、细胞存活、组织分化、寿命、生育能力。
图2为昆虫中ILPs激活的ISP通路和TOR通路。ILPs在脑MNCs合成并释放到血淋巴中。ILPs与IR的膜外α亚基结合,引起β亚基构象变化和酪氨酸残基的磷酸化,激活胰岛素信号。激活状态的IR磷酸化胰岛素适配蛋白(Insulin receptor substrate,IRS),为磷脂酰肌醇3-激酶PI3K(p60)提供结合位点。p60与IRS结合激活PI3K催化亚基p110,p110将细胞膜锚定的磷脂酰肌醇二磷酸(PIP2)磷酸化,将其转化为磷脂酰肌醇三磷酸(PIP3)。磷酸肌醇激酶依赖的蛋白激酶1(PDK1)和Akt激酶,在细胞膜分别与PIP3结合。PDK1磷酸化Akt,激活Akt与p70 S6 核糖体激酶(S6K)。TOR复合物2(TOR-C2)上的TOR的雷帕霉素不敏感分子伴侣(Rictor)将Akt磷酸化,全面激活整个通路。激活态的Akt是许多下游蛋白的链接枢纽,包括糖元合成激酶3(GSK-3),结节性硬化复合物(Tuberous sclerosis complex,TSC1/2)——一种负调控TOR通路的调控因子和FOXO转录因子。被Akt激活后,FOXO不能进入到细胞核,抑制转录,使真核转录因子4E结合蛋白(Eukaryotic translation factor 4E-binding protein,4E-BP)、烯醇丙酮酸磷酸羟激酶(Phosphoenolpyruvate carboxykinase,4E-BP)和超氧化物岐化酶(Supper-oxide dismutase,SOD)不能转录。ISP通路的抑制因子磷酸酶(Phosphatase)和张力蛋白PTEN同源物将PIP3和PIP2去磷酸化,ISP通路恢复到待激活状态。TOR通路既可以由上游氨基酸激活,也可由Akt激活。TOR激酶可以形成2种复合体,TOR-C1和TOR-C2。雷帕霉素敏感分子伴侣(Ractor)与TOR-C1结合,而Rictor与TOR-C2结合。TOR-C1磷酸化S6K,抑制4E-BP,启动转录。
3 ILPs的调控功能
果蝇的ILPs通过激活ISP通路和TOR通路,调控生长、发育、新陈代谢、繁殖及免疫等生命过程。在C. elegans基因组中发现39种胰岛素样蛋白,命名为INS1-39。INSs与insulin/IGF-1受体DAF-2结合,激活并参与胰岛素/胰岛素样生长因子信号(Insulin/insulin-like growth factor 1 signaling,IIS)通路,调控机体的衰老、寿命及免疫等生命活动[28]。在椎实螺中发现7个ILPs[29],结构同哺乳动物胰岛素相似,在神经系统、肠中表达,被认为是神经肽,调控生长发育、产卵等生命活动。三角涡虫中由ILP启动的胰岛素信号,调控成虫个体大小、组织内稳态及干细胞分化[6]。
目前对ILPs功能的研究主要集中以下8个方面,以果蝇为例分别介绍如下。
3.1 调控生长发育
昆虫个体生长和胚胎后期分化是由多个信号通路调控的,参与这些通路的激素有保幼激素(Juvenile hormone,JH)、蜕皮甾醇激素(Ecdysteroid,ECD)
和神经肽,也包括ILPs。对果蝇的研究表明,生长、发育是由ILP激活的ISP通路和营养感应的TOR通路共同调控的[30]。重组突变DILP1-5,果蝇可育,但生长缓慢,个体小;除DILP6、8外,单个DILP突变后,果蝇正常生长,成体体重正常,而DILP6突变后的个体最小;敲除DILP6会致死,而敲除其他DILPs的果蝇能发育到成体,表明脂质体表达的DILP6和MNCs表达DILPs是功能冗余性的[16]。调控幼虫生长发育的激素,同时调控其组织分化。研究表明,ILP直接诱导不同的组织,促进组织细胞生长、迁移[31,32]由于TOR通路能够激活ISP通路的下游分子,因此敲除或过表达TOR通路中的相关基因有类似现象。

图2 昆虫胰岛素样蛋白激活的ISP 通路和TOR 通路[11]
3.2 调控蜕化类固醇激素的合成
蜕皮激素是昆虫发育、蜕皮和变态的主要调控因子。ILPs调控昆虫幼虫/蛹前胸腺分泌ECD。在幼虫阶段,前胸腺(Prothoracic glands,GP)合成的膳食胆固醇ECDs,释放到血淋巴,运输至靶组织。若干神经肽促进或抑制昆虫ECD的合成,如最早发现的促胸腺激素(Prothoracicotropic hormone,PTTH),以及最近发现的PTTH的受体Torson[33]。无脊椎动物中最早发现的ILP(亦叫做小PTTH)和Bombyxin,促进樗蚕蛹的蜕皮和ECD合成。胎牛胰岛素也促进家蚕末龄幼虫前胸腺ECD分泌[34]。2种合成的樗蚕ILPs调控蛹至成虫阶段的蜕皮[35]。人工合成的ILP(bombyxin-II)刺激节肢动物Rhodnius prolixus ECD的合成[36]。
此外,果蝇中ISP还能够调控JH的合成[37],但尚缺少ISP直接调控保幼激素(Juvenile hormone,JH)合成的证据。
在不同温度下,取质量为m=0.01 g 磁性纤维素加入体积10 mL初始浓度不同的pH为7的亚甲基蓝溶液中振荡吸附,吸附时间为2 h,结果如图5所示。由图5可知,磁性纤维素对低浓度亚甲基蓝溶液,磁性纤维素随着亚甲基蓝溶液浓度的增大吸附容量也迅速增大,而在高浓度阶段,吸附容量随着亚甲基蓝溶液浓度的增加而缓慢增加且趋于平稳,表明吸附已经达到饱和状态。从图5可知,随着温度的增加,磁性纤维素对亚甲基蓝溶液吸附容量减小。静态实验中吸附温度宜调为293 K。
3.3 调控生殖
通常较大个体的生殖能力较强。JH、ECDs、神经肽(包括ILPs)调控昆虫的生长和发育,进而调控其生殖[38]。除双翅类外,JH是雌性昆虫非常
重要的促性腺激素,它能激活脂质体和卵巢分泌卵黄蛋白原(Vitellogenin,VG)和卵黄蛋白(Yolk polypeptides,YP)[39]。双翅类的卵巢是流通的ECDs主要来源,卵母细胞周围的卵泡合成ECDs,补充变态时退化的PG功能[40]。在JH作为促性腺激素的昆虫中,ECDs也是VG合成的终止因子[41]。
果蝇和蚊子中,JH是脂质体和卵巢发育必需的激素。单一或组合敲除果蝇胰岛素样肽(Drosphila insulin-libe peptides,DILPs)后,与野生型相比,仅敲除DILP6(IGF同系物),或同时敲除DILP2-3-5后,果蝇终生产卵量显著下降(分别下降46%和69%)[17]。果蝇卵细胞的成熟与哪个DILPs相关及其机制尚不清楚,但JH和ISP通路都调控卵细胞形成、YP的合成与吸收。IRS突变的雌果蝇,体型小且不育,而JH、ECD水平正常[42]。异常的ISP通路影响果蝇的营养状况及滞育,进而影响其繁殖和寿命,甚至交配和求偶行为[43];YPs在脂质体和卵泡中的合成依赖ISP通路和ECD信号[12]。表明昆虫ISP通路与其繁殖非常相关。TOR通路通过ISP依赖、ISP非依赖途径也影响卵的成熟[44]。
此外,ISP通路可强化繁殖相关的表型和形态多样性(输卵管数量进化多样性),并与卵巢、干细胞的形成发育有较大关系[45,46]。
3.4 新陈代谢
昆虫摄取的营养物质和能量被直接消耗,或储备以供生长、发育和繁殖需要。蜕皮、滞育、蛹甚至成虫阶段,饥饿或缺少食物的昆虫体内,能量会重新分配和调动,以延长存活时间。有两类神经肽及其参与的信号通路调节昆虫中的能量储备和能量调动:ILPs(胰岛素)诱导细胞吸收葡萄糖并转化为糖元,从分解代谢参与到脂质合成和蛋白代谢[27];AKH(脂动激素)是胰岛素的拮抗物质,通过G蛋白伴侣受体和cAMP/三磷酸肌醇信号通路,激活糖代谢、脯氨酸代谢和脂质储备[47]。脂质体是昆虫主要的代谢调节、营养储备部位,对ILP/TOR通路和AKH信号敏感。中肠、绛色细胞也对以上通路敏感,并且通过尚未知的机制调控脂质体中能量代谢与分配[44]。DILP1-5单独或共同调节糖类、脂类代谢[17]。
人工合成的ILPs直接影响昆虫新陈代谢。Bombyxin-II注射到颈部结扎幼虫中,海藻糖和糖元水平下降,显著加速储备糖类的消耗[48]。人工合成的Ae. aegypti ILP3注射削去头部并投喂白糖的雌Ae. aegypti中,促进海藻糖消耗及糖元与脂肪的储备,且存在剂量依赖[49]。胰岛素降解酶(Insulin-degrading enzyme,IDE)是非常保守的胰岛素降解酶。果蝇中该基因的同源物质在整个生活史及细胞系中表达。相同条件下,果蝇的IDE可降解哺乳类的胰岛素[50],且敲除IDE后,果蝇海藻糖(Trenalose)水平提高,抑制生长[51]。但是,DILP、ISP通路相关基因对营养摄取情况的响应并不一致[52]。
滞育(Diapause)是动物受不利环境条件的诱导产生的,由内分泌系统调控的,新陈代谢和发育静止的一种类型,它常发生于一定的发育阶段。脊椎动物IGF同源基因DILP在末龄幼虫期表达激增,变态期下降,若缺失DILP6发育阻滞[53];双翅类中,ISP通路异常使成虫滞育[54]。鳞翅目Sa. Cynthia[55]和 Pieris brassicae[56]的蛹,注射哺乳动物胰岛素后滞育终止并恢复发育。敲除果蝇PI3K(Dp110)后,果蝇滞育率高,而在神经系统中过表达Dp110,滞育率下降。秋季雌尖音库蚊(Culex pipiens)滞育,脂肪大量储备,卵巢停止发育;而干扰未滞育雌蚊子的IR,其卵巢也停止发育;即将滞育的雌蚊子中ILP1和ILP5表达量比雄性低,且敲除ILP1,未滞育雌蚊子卵巢停止发育[57]。这些研究表明,未激活的ISP通路可引发滞育,激活后滞育终止或缓解。这与未滞育昆虫中,ISP通路促进合成代谢的理论相悖,但在线虫(Caenorhabditis)中是一致的。
3.6 摄食与营养
中枢神经系统中表达的各种ILPs可激活不同神经信号通路的ISP通路,调控营养摄取行为。抑制果蝇DILPs表达或抑制ISP通路后,果蝇摄食量增加,且能耐受食物中的有害化学物质,而在饥饿果蝇中抑制或过表达DILP或ISP通路,摄食行为都会减弱[58]。ISP通路的突变使果蝇对酒精的耐受性提高[59],表明DILPs和ISP通路与上瘾行为相关。食物缺少条件下,或通过PI3K/Akt等通路“屏蔽”ISP通路,果蝇表皮色素沉降下降,而TOR通路则刺激
表皮色素的沉降[60]。
3.7 免疫功能
昆虫的先天免疫系统识别病原体,产生抗原,避免感染。果蝇感染海鱼分枝杆菌(Mycobacterium marinum)后,Akt、GSK-3及合成代谢相关基因表达下调,血糖升高,脂肪和糖元含量降低,与FOXO突变个体相比寿命缩短[61]。突变IRS抑制ISP通路,使果蝇对革兰氏阳/阴性菌抵抗力增强,寿命延长[62]。饥饿果蝇的ISP信号减弱,即使无病原感染,抗菌肽(Antimicrobi peptide,AMP)表达上调,表明其免疫能力提高[63]。综上所述,果蝇受感染后,ISP通路受到抑制,储备能量以提高免疫能力。脂质体是果蝇主要的免疫组织和能量储存组织。Diangelo等[64]发现,在突变体果蝇脂质体中激活Toll受体,AMP表达上调,而Akt磷酸化率降低,甘油三酸酯含量降低;dFOXO调控抗菌肽的表达,能量代谢失衡对免疫系统极为不利[65],进一步表明,ISP通路与免疫是直接相关的。蚊子、蜻蜓等昆虫的ISP通路也与免疫相关[66]。
3.8 衰老和寿命
对果蝇、蚊子等昆虫ISP通路在神经系统、脂质体、中肠等组织的功能的同时发现,ISP通路调控果蝇的衰老和寿命。下调果蝇神经系统DILP2[17]、脂质体等组织中IRS(chico)、SH2B(Lnk)[67]表达,果蝇寿命延长;过表达果蝇神经系统、脂质体中ISP通路的拮抗基因,果蝇寿命延长[68,69]。但目前ISP通路调控衰老和寿命的机制需进一步的研究。模式变化,机体内稳态及先天免疫相应改变。
昆虫、线虫,甚至贝类等无脊椎动物基因组测序越来越普遍,非模式生物遗传学技术的不断发展,以及ILP人工合成和生物化学技术的发展,将极大促进ILP信号通路的研究。
4 结语
无脊椎动物ILPs结构、功能及所参与的信号通路,甚至分泌、作用器官,同脊椎动物胰岛素非常相似,表明胰岛素、胰岛素信号是非常保守的。有趣的是,无脊椎动物中,多个ILPs与唯一的IR结合,调控不同组织的生理活动,并与其他通路“合作”调控个体行为,使个体顺利完成生长、发育和繁殖。ILPs通过ISP通路调控ECD和JH的分泌,可直接或与其他通路“合作”调控发育和繁殖;营养摄食、能量消耗/储备,以正反馈调节方式显著影响ISP通路和TOR通路,并调节不同组织中的基因表达和生物化学过程;病原感染使ISP通路相关基因表达
[1]Nagasawa H, Kataoka H, Isogai A, et al. Amino-terminal amino acid sequence of the silkworm prothoracicotropic hormone:homology with insulin[J]. Science, 1984, 226(4680):1344-1345.
[2]Antonova Y, Arik AJ, Moore W, et al. Insulin-like peptides:structure, signaling, and function[OL]//Gibert LI. Insect Endocrinology. Elsevier Academic Press, 2012:63-92.
[3]Garelli A, Gontijo AM, Miguela V, et al. Imaginal discs secrete insulin-like peptide 8 to mediate plasticity of growth and maturation[J]. Science, 2012, 336(6081):579-582.
[4]Colombani J, Andersen DS, Léopold P. Secreted peptide Dilp8 coordinates Drosophila tissue growth with developmental timing[J]. Science, 2012, 336(6081):582-585.
[5]York PS, Cummins SF, Lucas T, et al. Differential expression of neuropeptides correlates with growth rate in cultivated Haliotis asinina(Vetigastropoda:Mollusca)[J]. Aquaculture, 2012, 334:159-168.
[6]Miller CM, Newmark PA. An insulin-like peptide regulates size and adult stem cells in planarians[J]. International Journal of Developmental Biology, 2012, 56(1):75-82.
[7]Claeys I, Simonet G, Poels J, et al. Insulin-related peptides and their conserved signal transduction pathway[J]. Peptides, 2002, 23(4):807-816.
[8]Brogiolo W, Stocker H, Ikeya T, et al. An evolutionarily conserved function of the Drosophila insulin receptor and insulin-like peptides in growth control[J]. Current Biology, 2001, 11(4):213-221.
[9]Smit A, Vreugdenhil E, Ebberink R, et al. Growth-controlling molluscan neurons produce the precursor of an insulin-related peptide[J]. Nature, 1988, 331:535-538.
[10]Veenstra JA, Sellami A. Regulatory peptides in fruit fly midgut[J]. Cell and Tissue Research, 2008, 334(3):499-516.
[11]Veenstra JA. Peptidergic paracrine and endocrine cells in the midgut of the fruit fly maggot[J]. Cell and Tissue Research,
2009, 336(2):309-323.
[12]Antonova-Koch Y, Riehle M A, Arik AJ, et al. Insulin-like peptides[OL]//Abba JK. Handbook of Biologically Active Peptides. Elsevier Academic Press, 2013:267-275.
[13]Géminard C, Rulifson EJ, Léopold P. Remote control of insulin secretion by fat cells in Drosophila[J]. Cell Metabolism, 2009, 10(3):199-207.
[14]Wang S, Tulina N, Carlin DL, et al. The origin of islet-like cells in Drosophila identifies parallels to the vertebrate endocrine axis[J]. Proceedings of the National Academy of Sciences, 2007, 104(50):19873-19878.
[15]Callander G, Bathgate R. Relaxin family peptide systems and the central nervous system[J]. Cellular and Molecular Life Sciences, 2010, 67(14):2327-2341.
[16]Clements J, Hens K, Francis C, et al. Conserved role for the Drosophila Pax6 homolog eyeless in differentiation and function of insulin-producing neurons[J]. Proceedings of the National Academy of Sciences, 2008, 105(42):16183-16188.
[17]Grönke S, Clarke DF, Broughton S, et al. Molecular evolution and functional characterization of Drosophila insulin-like peptides[J]. PLoS Genetics, 2010, 6(2):e1000857.
[18]Yang Ch, Belawat P, Hafen E, et al. Drosophila egg-laying site selection as a system to study simple decision-making processes[J]. Science, 2008, 319(5870):1679-1683.
[19]Badisco L, Claeys I, Van Hiel M, et al. Purification and characterization of an insulin-related peptide in the desert locust, Schistocerca gregaria:immunolocalization, cDNA cloning, transcript profiling and interaction with neuroparsin[J]. Journal of Molecular Endocrinology, 2008, 40(3):137-150.
[20]Ament SA, Corona M, Pollock HS, et al. Insulin signaling is involved in the regulation of worker division of labor in honey bee colonies[J]. Proceedings of the National Academy of Sciences, 2008, 105(11):4226-4231.
[21]Okamoto N, Yamanaka N, Satake H, et al. An ecdysteroid-inducible insulin-like growth factor-like peptide regulates adult development of the silkmoth Bombyx mori[J]. FEBS Journal, 2009, 276(5):1221-1232.
[22]Hernández-Sánchez C, Mansilla A, De La Rosa E, et al. Proinsulin in development:new roles for an ancient prohormone[J]. Diabetologia, 2006, 49(6):1142-1150.
[23]Steiner D, Park SY, Støy J, et al. A brief perspective on insulin production[J]. Diabetes, Obesity and Metabolism, 2009, 11(s4):189-196.
[24]Rayburn LY, Rhea J, Jocoy SR, et al. The proprotein convertase amontillado(amon)is required during Drosophilam pupal development[J]. Developmental Biology, 2009, 333(1):48-56.
[25]Rhea JM, Wegener C, Bender M. The proprotein convertase encoded by amontillado(amon)is required in Drosophila corpora cardiaca endocrine cells producing the glucose regulatory hormone AKH[J]. PLoS Genetics, 2010, 6(5):e1000967.
[26]Sajid W, Kulahin N, Schluckebier G, et al. Structural and biological properties of the Drosophila insulin-like peptide 5 show evolutionary conservation[J]. Journal of Biological Chemistry, 2011, 286(1):661-673.
[27]Wen Z, Gulia M, Clark KD, et al. Two insulin-like peptide family members from the mosquito Aedes aegypti exhibit differential biological and receptor binding activities[J]. Molecular and Cellular Endocrinology, 2010, 328(1):47-55.
[28]Kaletsky R, Murphy CT. The role of insulin/IGF-like signaling in C. elegans longevity and aging[J]. Disease Models & Mechanisms, 2010, 3(7-8):415-419.
[29]Smit A, Spijker S, Van Minnen J, et al. Expression and characterization of molluscan insulin-related peptide VII from the mollusc Lymnaea stagnalis[J]. Neuroscience, 1996, 70(2):589-596.
[30]Shakhmantsir I, Massad NL, Kennell JA. Regulation of cuticle pigmentation in Drosophila by the nutrient sensing insulin and TOR signaling pathways[J]. Developmental Dynamics, 2013, 243(3):393-401.
[31]Nakahara Y, Matsumoto H, Kanamori Y, et al. Insulin signaling is involved in hematopoietic regulation in an insect hematopoietic organ[J]. Journal of Insect Physiology, 2006, 52(1):105-111.
[32]Nijhout HF, Grunert LW. Bombyxin is a growth factor for wing imaginal disks in Lepidoptera[J]. Proceedings of the National Academy of Sciences, 2002, 99(24):15446-15450.
[33]Rewitz KF, Yamanaka N, Gilbert LI, et al. The insect neuropeptide PTTH activates receptor tyrosine kinase torso to initiate metamorphosis[J]. Science, 2009, 326(5958):1403-1405.
[34]Gu SH, Lin JL, Lin PL, et al. Insulin stimulates ecdysteroidogenesis by prothoracic glands in the silkworm, Bombyx mori[J]. Insect
Biochemistry and Molecular Biology, 2009, 39(3):171-179.
[35]Nagata K, Maruyama K, Kojima K, et al. Prothoracicotropic activity of SBRPs, the insulin-like peptides of the saturniid silkworm Samia cynthia ricini[J]. Biochemical and Biophysical Research Communications, 1999, 266(2):575-578.
[36]Satake SI, Masumura M, Ishizaki H, et al. Bombyxin, an insulinrelated peptide of insects, reduces the major storage carbohydrates in the silkworm Bombyx mori[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 1997, 118(2):349-357.
[37]Belgacem YH, Martin JR. Hmgcr in the corpus allatum controls sexual dimorphism of locomotor activity and body size via the insulin pathway in Drosophila[J]. PLoS One, 2007, 2(1):e187.
[38]Raikhel A. Vitellogenesis of disease vectors, from physiology to genes[OL]//Biology of Disease Vectors. Elsevier Academic Press, 2005:329-346.
[39]Tufail M, Takeda M. Molecular characteristics of insect vitellogenins[J]. Journal of Insect Physiology, 2008, 54(12):1447-1458.
[40]Rees DA, Giles P, Lewis MD, et al. Adenosine regulates thrombomodulin and endothelial protein C receptor expression in folliculostellate cells of the pituitary gland[J]. Purinergic Signalling, 2010, 6(1):19-29.
[41]Hatle JD, Juliano SA, Borst DW. Hemolymph ecdysteroids do not affect vitellogenesis in the lubber grasshopper[J]. Archives of Insect Biochemistry and Physiology, 2003, 52(1):45-57.
[42]Richard DS, Rybczynski R, Wilson TG, et al. Insulin signaling is necessary for vitellogenesis in Drosophila melanogaster independent of the roles of juvenile hormone and ecdysteroids:female sterility of the chico insulin signaling mutation is autonomous to the ovary[J]. Journal of Insect Physiology, 2005, 51(4):455-464.
[43]Wigby S, Slack C, Grönke S, et al. Insulin signalling regulates remating in female Drosophila[J]. Proceedings of the Royal Society B:Biological Sciences, 2011, 278(1704):424-431.
[44]Gutiérrez A, Nieto J, Pozo F, et al. Effect of insulin/IGF-I like peptides on glucose metabolism in the white shrimp Penaeus vannamei[J]. General and Comparative Endocrinology, 2007, 153(1):170-175.
[45]Green DA, Extavour CG. Insulin signalling underlies both plasticity and divergence of a reproductive trait in Drosophila[J]. Proceedings of the Royal Society B:Biological Sciences, 2014, 281(1779):20132673.
[46]Gancz D, Gilboa L. Insulin and target of rapamycin signaling orchestrate the development of ovarian niche-stem cell units in Drosophila[J]. Development, 2013, 140(20):4145-4154.
[47]Gäde G. Regulation of intermediary metabolism and water balance of insects by neuropeptides[J]. Annual Reviews in Entomology, 2004, 49(1):93-113.
[48]Satake SI, Nagata K, Kataoka H, et al. Bombyxin secretion in the adult silkmoth Bombyx mori:sex-specificity and its correlation with metabolism[J]. Journal of Insect Physiology, 1999, 45(10):939-945.
[49]Stoppelli MP, Garcia JV, Decker SJ, et al. Developmental regulation of an insulin-degrading enzyme from Drosophila melanogaster[J]. Proceedings of the National Academy of Sciences, 1988, 85(10):3469-3473.
[50]Garcia JV, Fenton BW, Rosner MR. Isolation and characterization of an insulin-degrading enzyme from Drosophila melanogaster[J]. Biochemistry, 1988, 27(12):4237-4244.
[51]Galagovsky D, Katz MJ, Acevedo JM, et al. The Drosophila insulin degrading enzyme restricts growth by modulating the PI3K pathway in a cell autonomous manner[J]. Molecular Biology of the Cell, 2014, 25(6):916-924.
[52]Liu Y, Zhou S, Ma L, et al. Transcriptional regulation of the insulin signaling pathway genes by starvation and 20-hydroxyecdysone in the Bombyx fat body[J]. Journal of Insect Physiology, 2010, 56(10):1436-1444.
[53]Okamoto N, Yamanaka N, Yagi Y, et al. A fat body-derived IGF-like peptide regulates postfeeding growth in Drosophila[J]. Developmental Cell, 2009, 17(6):885-891.
[54]Sim C, Denlinger DL. Insulin signaling and the regulation of insect diapause[J]. Frontiers in Physiology, 2013, 4:189.
[55]Bokovec AB, Gelman DB. Insect neurochemistry and neurophysiology[OL]//Wang ZS, Zheng WH, Guo F.Effect of Bombyx 4KPTTH and bovine insulin on testis development of indian silkworm, Philosamia cynthia ricini. US:Humana Press, 1986:335-338.
[56]Arpagaus M. Vertebrate insulin induces diapause termination in Pieris brassicae pupae[J]. Roux's Archives of Developmental Biology, 1987, 196(8):527-530.
[57]Williams KD, Sokolowski MB. Evolution:how fruit flies adapt to
seasonal stresses[J]. Current Biology, 2009, 19(2):R63-R64.
[58]Wu Q, Zhang Y, Xu J, et al. Regulation of hunger-driven behaviors by neural ribosomal S6 kinase in Drosophila[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(37):13289-13294.
[59]Corl AB, Rodan AR, Heberlein U. Insulin signaling in the nervous system regulates ethanol intoxication in Drosophila melanogaster[J]. Nature Neuroscience, 2004, 8(1):18-19.
[60]Shakhmantsir I, Massad NL, Kennell JA. Regulation of cuticle pigmentation in drosophila by the nutrient sensing insulin and TOR signaling pathways[J]. Developmental Dynamics, 2014, 243(3):393-401.
[61]Dionne MS, Pham LN, Shirasu-Hiza M, et al. Akt and foxo dysregulation contribute to infection-induced wasting in Drosophila[J]. Current Biology, 2006, 16(20):1977-1985.
[62]Libert S, Chao Y, Zwiener J, et al. Realized immune response is enhanced in long-lived puc and chico mutants but is unaffected by dietary restriction[J]. Molecular Immunology, 2008, 45(3):810-817.
[63]Becker T, Loch G, Beyer M, et al. FOXO-dependent regulation of innate immune homeostasis[J]. Nature, 2010, 463(7279):369-373.
[64]Diangelo JR, Bland ML, Bambina S, et al. The immune response attenuates growth and nutrient storage in Drosophila by reducing insulin signaling[J]. Proceedings of the National Academy of Sciences, 2009, 106(49):20853-20858.
[65]Loch G, Jentgens E, Bülow M, et al. Metabolism and innate immunity:FOXO regulation of antimicrobial peptides in Drosophila[J]. Innate Immunity :Resistance and Disease-Romoting Principks, 2013, 4:103-111.
[66]Corby-Harris V, Drexler A, de Jong LW, et al. Activation of Akt signaling reduces the prevalence and intensity of malaria parasite infection and lifespan in Anopheles stephensi mosquitoes[J]. PLoS Pathogens, 2010, 6(7):e1001003.
[67]Slack C, Werz C, Wieser D, et al. Regulation of lifespan, metabolism, and stress responses by the Drosophila SH2B protein, Lnk[J]. PLoS Genetics, 2010, 6(3):e1000881.
[68]Hwangbo DS, Gersham B, Tu MP, et al. Drosophila dFOXO controls lifespan and regulates insulin signalling in brain and fat body[J]. Nature, 2004, 429(6991):562-566.
[69]Tatar M, Post S, Yu K. Nutrient control of Drosophila longevity[J]. Trends in Endocrinology & Metabolism, 2014:S1043-2760(14)00042.
(责任编辑 狄艳红)
Insulin-like Peptides in Invertebrates and Their Signaling Pathways—Take Insects,for Example
Zhang Longhui Wang Guodong
(Fisheries College of Jimei University,Xiamen 361021)
Insulin-like/related peptides(ILPs)of invertebrate are homologous of vertebrate insulin. This article rewiewed the structure, expression, signalling pathway of ILPs. The functions of ILPs were also summarized in regulating growth, development, metabolism, reproduction and immunity.
Insects Insulin-like peptides Insulin signaling pathway Regulation of multipul processes
2014-02-03
国家自然科学基金项目(41006105,4176152)
张龙辉,女,硕士研究生,研究方向:水生生物的遗传与育种;E-mail:zhlonghui@163.com
王国栋,男,博士,副教授,研究方向:水产动物功能基因和繁殖生物学;E-mail:gdwang@jmu.edu.cn
