ICU患者分离的耐亚胺培南鲍曼不动杆菌同源性及耐药机制
2014-03-21罗湘蓉李恒翠袁军刘心梅牟霞胡方芳黄盛文
罗湘蓉,李恒翠,袁军,刘心梅,牟霞,胡方芳,黄盛文
(1.贵州省人民医院中心实验室,贵阳550002;2.遵义医学院检验系2009级,贵州遵义563000;3.贵州省人民医院检验科,贵阳550002;4.贵州省人民医院院感科,贵阳550002)
ICU患者分离的耐亚胺培南鲍曼不动杆菌同源性及耐药机制
罗湘蓉1,李恒翠2,袁军1,刘心梅3,牟霞4,胡方芳1,黄盛文3
(1.贵州省人民医院中心实验室,贵阳550002;2.遵义医学院检验系2009级,贵州遵义563000;3.贵州省人民医院检验科,贵阳550002;4.贵州省人民医院院感科,贵阳550002)
目的了解ICU患者分离的耐亚胺培南鲍曼不动杆菌(IRAB)的同源性和耐药机制。方法收集临床标本分离的35株IRAB,采用肠杆菌科基因组内重复序列聚合酶链反应(ERIC⁃PCR)进行基因同源性分析;采用EDTA协同实验进行金属β⁃内酰胺酶(MBLs)的表型检测;采用多重PCR技术扩增IRAB的OXA⁃23、OXA⁃24、OXA⁃51、OXA⁃58基因及Imp、Vim、Sim基因。结果35株IRAB经ERIC⁃PCR基因分型,分为A、B型,其中31株为A型,4株为B型。所有菌株均携带有OXA⁃23和OXA⁃51基因。MBLs的表型及基因型检测均为阴性。结论该院ICU流行的IRAB主要由克隆株传播所致,耐药机制主要为产生OXA⁃23基因。
重症监护病房;亚胺培南;鲍曼不动杆菌;同源性;耐药机制
鲍曼不动杆菌是医院感染的重要病原菌,极易引起院内感染爆发流行。亚胺培南等碳青霉烯类抗生素通常作为治疗重症鲍曼不动杆菌感染的首选药物,但由于该类抗生素的广泛应用,对其耐药的鲍曼不动杆菌不断增加,给临床治疗和院内感染控制带来极大困难。人们对其分子流行病学和耐药机制尚不完全清楚。而且各个医院由于用药习惯不同、环境不同,耐亚胺培南鲍曼不动杆菌(imi⁃penem⁃resistantAcinetobacter baumannii,IRAB)的耐药性、传播的基因型、耐药机制存在差异。本研究收集了2012年8至12月从贵州省人民医院外科ICU、呼吸内科ICU、神经内科ICU分离的IRAB 35株,并分析其同源性、碳氢霉烯酶基因型的产生情况。
1 材料与方法
1.1 菌株来源
2012年8至12月从贵州省人民医院外科ICU、呼吸内科ICU、神经内科ICU的临床标本中分离35株IRAB,其中31株来自痰标本,其余4株分别来自脑脊液、导管尖端、肺泡灌洗液、渗出液,均为非重复菌株。菌株的分离培养严格按照《全国临床检验操作规程》进行,采用PHOENIX全自动微生物分析仪进行菌株鉴定、药敏。质控菌株:大肠埃希菌ATCC 25922和铜绿假单胞菌ATCC 27853,购自卫生部临床检验中心。OXA⁃23阳性鲍曼不动杆菌为本实验室保存。
1.2 主要仪器及试剂
PHOENIX全自动微生物分析仪及其配套试剂购自美国BD公司;CapitalBio PCR仪购自杭州博日科技有限公司;DYY⁃6C型电泳仪购自北京市六一仪器厂;BOXEF凝胶电泳成像系统购自美国基因公司;水解酪蛋白琼脂平板购自广州迪景公司;亚胺培南药敏纸片购自英国Oxoid公司;乙二胺四乙酸(EDTA)购自重庆化学试剂厂;PCR试剂、引物购自上海生工生物工程有限公司;PCR试剂盒、多重PCR试剂盒、Marker购自大连宝生物有限公司。
1.3 DNA的提取
煮沸法提取DNA,操作过程[1]如下:取过夜培养的菌落4~5个悬于250 μL蒸馏水,95℃水浴15 min,冰浴冷却5 min后10 000 r/min离心10 min,取上清液放于灭菌的EP管中,-20℃保存待用。
1.4 同源性分析
采用肠杆菌科基因组内重复序列聚合酶链反应(enterobacterial repetitive intergenic consensus PCR,ERIC⁃PCR),引物序列:5′⁃AAGTAAGTGACTG GGGTGAGCG⁃3′[1]。反应体系[2]:体积25 μL,引物1 μL;dNTP 1.75 μL;taq酶0.25 μL;DNA模板1 μL; 10×PCR buffer 2.5 μL;蒸馏水18.5 μL。PCR扩增程序:94℃预变性5 min,94℃变性1 min,42℃退火1 min,72℃延伸2 min,35个循环后72℃延伸10 min。1.8%的琼脂糖凝胶电泳1.5 h。凝胶成像系统下面观察结果并拍照。结果判断标准:不论条带密度,只要条带数目与位置相同则为同一型。
1.5 MBLs表型检测
采用EDTA协同实验,参照文献[3]并作改良,挑取菌落配制0.5麦氏单位菌液,均匀涂布于MH平板上,放置10 min吸干水分,贴上亚胺培南药敏纸片和空白纸片,2纸片之间相距1.2 cm,空白纸片上加10 μL的0.5 mol/L EDTA溶液;放置35℃孵育过夜观察结果。若亚胺培南抑菌圈在靠近EDTA的一侧增大,为EDTA协同实验阳性,也就是该菌MBLs表型筛查阳性,否则为阴性。
1.6 多重PCR扩增OXA、MBLs基因[4,5]
采用多重PCR,PCR反应体系:体积50 μL,Multi⁃plex PCR Mix2 25 μL,Primer Mix(引物序列见表1)各加1 μL;Multiplex PCR Mix1 0.25 μL,DNA模板2 μL,灭菌蒸馏水补足50 μL;PCR反应条件:94℃预变性5 min,94℃变性25 s,52℃退火40 s,72℃延伸50 s,35个循环后72℃延伸6 min。1.8%的琼脂糖凝胶电泳42 min。使用凝胶成像系统观察结果并拍照。
2 结果
2.1 同源性分析
35株IRAB分为2型,其中31株为A型,占88.6%;另外4株为B型,占11.4%。见图1。

表1 OXA、MBLs基因引物序列Tab.1 Primer sequences of OXA and MBLs genes
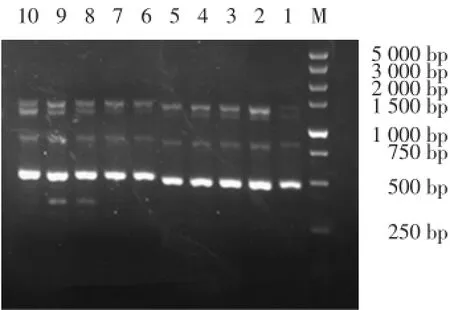
图1 部分ERIC⁃PCR扩增产物电泳图Fig.1 Representative electropherogram of ERIC⁃PCR products
2.2 IRAB分型与科室分布
A型分布为外科ICU 14株,呼吸内科ICU 13株,神经内科ICU 4株;B型分布为外科ICU 1株,呼吸内科ICU 3株。
2.3 MBLs表型检测
35株IRAB的MBLs表型检测均为阴性。
2.4 多重PCR扩增结果
35株IRAB均检测出OXA⁃23、OXA⁃51(图2);未检测出OXA⁃24、OXA⁃58;未检测出Imp、Vim和Sim基因。

图2 部分OXA基因PCR扩增产物电泳图Fig.2 Representative PCR electropherogram of OXA genes
3 讨论
基因分型的方法比较多。本研究采用的ERIC⁃PCR,采用的引物是ERIC序列;ERIC序列是指革兰阴性杆菌中存在的一段重复序列(约126 bp的片段),这段序列散在分布于基因中,遗传稳定,在不同种属间有拷贝数和位置变化。ERIC⁃PCR操作简单、结果清晰、稳定,具备不要求模板序列已知而直接进行扩增的优点[1,2]。
耐药菌株不断增加,与克隆株在病房内及病房间的传播有很大关系[1,2,6,8]。本研究采用ERIC⁃PCR对35株IRAB进行同源性分析,结果显示:该院35株IRAB分为2型,其中A型(88.6%)为主要的流行型别,在外科ICU、呼吸内科ICU、神经内科ICU均有分布;B型(11.4%)为次要流行型别,分布在外科ICU、呼吸内科ICU。说明该院3个ICU病房在调查期内存在IRAB的克隆传播。克隆株在科室间、科室内传播很可能是IRAB增加的主要原因;造成克隆株播散的原因可能与没有严格进行消毒隔离、无菌操作及患者的抵抗力低下等有关;因此加强控制感染的传播至关重要。ICU的患者病情严重,免疫力低下,医护人员更应该注意手卫生,重视医疗器械的消毒,尽量减少侵入性医疗操作次数,增强患者的抵抗力,及时发现并隔离感染患者。
鲍曼不动杆菌对碳氢霉烯类抗生素的耐药机制主要是产生碳氢霉烯酶,碳氢霉烯酶能水解碳青霉烯类药物,介导碳青霉烯类药物耐药。碳氢霉烯酶包括Ambler分类中的A、B、D 3类酶,在不动杆菌中发现的碳氢霉烯酶主要为B类和D类酶。D类为苯唑西林酶(OXA酶),B类为MBLs,属于Bush分群的第3组。D类酶按照氨基酸的同源性可分为8组,在鲍曼不动杆菌中报道的主要是OXA⁃23、OXA⁃24、OXA⁃51和OXA⁃58这4组。本研究中35株IRAB,均检出OXA⁃23和OXA⁃51。其中OXA⁃23是质粒介导的碳氢霉烯酶,检出率100%,高于报道的72.5%[6]和92.7%[7],与晏群等[8]报道的100%一致。OXA⁃51是染色体介导的鲍曼不动杆菌的固有基因,敏感和耐药的鲍曼不动杆菌均携带该基因,OXA⁃51与碳氢霉烯类抗生素的结合能力、水解能力弱,但在抗生素选择压力下,该基因被过度表达可导致碳氢霉烯类抗生素的耐药[9]。因此该院ICU中IRAB的主要耐药机制为产生OXA⁃23基因,与文献结果一致[6~8],OXA⁃23基因合并其他耐药机制的情况,如外膜通透性降低和外排系统,还有待进一步研究。
总之,在调查期间我院ICU存在IRAB的克隆播散,主要耐药机制为产生OXA⁃23基因。
[1]Jeong SH,Bae IK,Park KO.Outbreaks of imipenem⁃resistantAci⁃netobacter baumanniiproducing carbapenemases in Korea[J].J Mi⁃crobiol,2006,44(4):423-431.
[2]罗湘蓉,王海霞,牟霞,等.耐亚胺培南鲍氏不动杆菌的耐药性与同源性分析[J].中华医院感染学杂志,2013,23(14):3305-3307.
[3]雷金娥,袁莉,李和平,等.耐碳青霉烯类鲍曼不动杆菌金属β⁃内酰胺酶的研究[J].现代中西医结合杂志,2009,18(27):3280-3281.
[4]Woodford N,Ellington MJ,Coelho JM,et al.Multiplex PCR for genes encoding prevalent OXA carbapenemases inAcinetobacterspp[J].Int J Antimicrob Agents,2006,27(4):351-353.
[5]Ellington MJ,Kistler J,Livermore DM,et al.Multiplex PCR for rap⁃id detection of genes encoding acquired metallo⁃β⁃lactamases[J].J Antimicrob Chemother,2007,59(2):321-322.
[6]张晓兵,刘星,龚雅利,等.碳青霉烯类耐药鲍曼不动杆菌分子流行病学及耐药机制的研究[J].第三军医大学学报,2011,33(5):502-505.
[7]李文青,吴伟元,卢月梅,等.碳青霉烯不敏感鲍曼不动杆菌耐药性与碳青霉烯酶耐药基因检测[J].实用预防医学,2013,20(5):549-551.
[8]晏群,邓爽,李虹玲,等.鲍曼不动杆菌的同源性及碳青霉烯酶基因分析[J].中南大学学报(医学版),2012,37(11):1163-1170.
[9]Evans BA,Amyes SG.OXA⁃lactamases[J].Clin Microbiol Rev,2014,27(2):241-263.
(编辑 陈姜)
Study on the Homology and Resistance Mechanism of Iminepem⁃resistantAcinetobacter baumanniiIsolated from ICU Patients
LUO Xiang⁃rong1,LI Heng⁃cui2,YUAN Jun1,LIU Xin⁃mei3,MU Xia4,HU Fang⁃fang1,HUANG Sheng⁃wen3
(1.Central Laboratory,People′s Hospital of Guizhou Province,Guiyang 550002,China;2.Department of Laboratory 2009,Zunyi Medical College,Zunyi563000,Chi⁃na;3.Department of Laboratory,People′s Hospital of Guizhou Province,Guiyang 550002,China;4.Department of Hospital Infection,People′s Hospital of Guizhou Province,Guiyang 550002,China)
ObjectiveTo investigate the homology and resistance mechanism of iminepem⁃resistantAcinetobacter baumannii(IRAB)isolated from ICU patients.MethodsA total of 35 strains of IRAB from ICU clinical specimens were collected,and the homology of these strains was ana⁃lyzed by enterobacterial repetitive intergenic consensus PCR(ERIC⁃PCR).The metal beta⁃lactamase(MBLs)phenotype was detected by EDTA synergy test.Multiplex PCR was used to amplify carbapenemase genes,including four kinds ofOXAgenes(OXA⁃23,OXA⁃24,OXA⁃51,andOXA⁃58)and three kinds of MBLs genes(Imp,Vim,andSim).ResultsTwo genomic types were detected in the 35 strains of IRAB by ERIC⁃PCR,in⁃cluding 31 strains of type A and 4 strains of type B.TheOXAgenes ofOXA⁃23andOXA⁃51was expressed in all these strains.MBLs phenotype and genotype of the test were negative.ConclusionThere was prevalence of the IRAB mainly caused by clones in the hospital ICU,and the resis⁃tance mechanism could be the expression ofOXA⁃23.
ICU;imipenem;Acinetobacter baumannii;homology;resistance mechanism
R378
A
0258-4646(2014)07-0612-03
贵州省卫生厅科学技术基金(gzwkj2012⁃1⁃106);贵州省科技计划课题(黔科合LS字[2012]030号)
罗湘蓉(1973-),女,副主任技师,硕士.
袁军,E-mail:99430junyuan@163.com
2014-04-02
网络出版时间:
