猪关节内细菌的分离鉴定及生物特性分析
2014-03-11何海健刘晓东姜正前蒋春燕张超颖
何海健,刘晓东,马 涛,姜正前,蒋春燕,张超颖
(1.浙江金华职业技术学院,浙江 金华321007;2.青岛易邦生物科技有限公司,山东 青岛266032;3.浙江同点生物科技有限公司,浙江 杭州310004)
关节肿胀是保育猪的常见疾病,而且常常伴随发生败血性疾病或者脑炎,为猪场造成了严重的经济损失[1]。引起关节肿胀的疾病很多,包括猪链球菌、副猪嗜血杆菌、猪丹毒杆菌、支原体等,但目前常见的病原仍是猪链球菌和副猪嗜血杆菌[2]。从临床症状上很难将这2种疾病区分开来,必须借助实验室诊断予以确诊。本文是在发生关节肿胀的病死猪中,同时从关节和肺脏中进行细菌的分离,比较不同细菌的分离率,并分析这两种细菌在猪体内的生物学特性。
1 材料与方法
1.1 病料来源 从浙江的几个猪场中采集,这几个猪场的保育仔猪均出现关节肿胀,并伴随败血性疾病或者脑炎、呼吸道症状。
1.2 材料 HPS标准菌株:由华南农业大学传染病教研室惠赠;TSA与TSB培养基,购自杭州天和微生物试剂有限公司;Taq酶等PCR反应试剂,购自TaKaRa公司。
1.3 细菌分离 参考尹秀凤等[10]的副猪嗜血杆菌及戴金玲等[11]的链球菌分离方法,用接种环挑取肺脏黏液或者关节液,划线于含5%牛血清及0.1%NAD的TSA平板上,37℃培养16~24 h后,挑取单菌落于含5%牛血清及0.1%NAD的TSB培养基中振荡培养24 h。
1.4 细菌的鉴定
1.4.1 模板的提取 取100μL菌液或者关节稀释液煮沸10min,离心后取上清作为PCR模板,利用PCR方法对细菌进行鉴定。
1.4.2 副猪嗜血杆菌的PCR鉴定 PCR反应引物[2]见表1,PCR反应体系(25μL):10×Buffer 2.5μL,25mmol/LMgCl20.5μL,2μmol/L dNTPs 0.5μL,20μmol/L上、下游引物各0.5μL,Taq DNA聚合酶0.5μL,无菌水19μL,模板1μL。反应条件:94℃预变性3min,94℃变性30 s,60℃退火30 s,72℃延伸45 s,30个循环后,72℃延伸10min。
将PCR反应产物进行测序并与NCBI上发布的副猪嗜血杆菌16S基因序列进行比对,进行进一步的确认。
1.4.3 猪链球菌的PCR鉴定 PCR反应引物[3]见表1,PCR反应体系(25μL):10×Buffer2.5μL,25mmol/LMgCl20.5μL,2μmol/L dNTPs0.5μL,20μmol/L上、下游引物各0.5μL,Taq DNA聚合酶0.5μL,无菌水19μL,模板1μL。反应条件:94℃预变性3min,94℃变性45 s,56℃退火45 s,72℃延伸45 s,30个循环后,72℃延伸10min。
将PCR反应产物进行测序并与NCBI上发布的猪链球菌GDH基因序列进行比对,进行进一步的确认。
1.4.4 猪链球菌的分型鉴定 PCR分型引物根据NCBI上发布的猪链球菌cps序列,并参照文献设计[3-5],引物如表1。

表1 细菌鉴定、分型引物序列
PCR反应体系(25μL):10×Buffer 2.5μL,25 mmol/LMgCl20.5μL,2μmol/L dNTPs 0.5μL,20 μmol/L GDH及cps1、2、7、9上、下游引物各0.5 μL,Taq DNA聚合酶0.5μL,无菌水补齐24μL,模板1μL。反应条件:94℃预变性3min,94℃变性45 s,56℃退火45 s,72℃延伸45 s,30个循环后,72℃延伸10min。
将PCR反应产物进行测序并与NCBI上发布的猪链球菌cps基因序列进行比对,进行进一步的确认。
1.5 小鼠致病性试验 将培养的副猪嗜血杆菌CFU计数后,离心,调整为1010CFU/mL。将25只昆明系小鼠随机分为5组,每组5只,其中1组作为阴性对照,其他4组分别攻毒4株副猪嗜血杆菌,每只小鼠攻毒0.2mL。将死亡的小鼠剖检后,对小鼠重新进行细菌分离,检测死亡小鼠的副猪嗜血杆菌分离率。
2 结果
2.1 细菌的PCR结果 按照上述PCR反应引物及反应体系,可扩增出相应片段大小的PCR产物,将所有的PCR产物测序并比对后,序列同源性均超过97%,证明所分得的细菌为副猪嗜血杆菌或者猪链球菌。
2.2 细菌的分离结果 见表2。
2.3 关节液PCR检测结果 见表3。

表2 细菌的分离结果
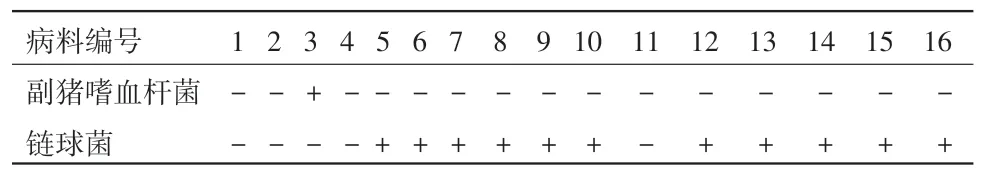
表3 关节液的PCR鉴定结果
从表3中可以看出,关节液的PCR结果与细菌的分离结果大体相似,仅在病料8中出现一定的偏差,怀疑可能保存不当或者因吞噬细胞导致菌体崩解。
2.4 小鼠致病性试验 见表4。
所有死亡的小鼠死亡时间均在84 h内,84 h后,所有存活的小鼠耐过。在所有死亡的小鼠体内,均重新分离到了HPS。

表4 副猪嗜血杆菌的小鼠致死率
3 讨论
我们分离的病料中,并不是所有的猪都存在呼吸道症状,但几乎在所有的肺脏中,我们都分离到了细菌。虽然副猪嗜血杆菌是一种条件性致病菌,同时也是呼吸道常在菌,但非致病时,其定居在上呼吸道中,而在肺脏中是不存在的,所以肺脏中分离到的副猪嗜血杆菌,我们怀疑其为致病菌。接着通过小鼠攻毒试验证明其存在致病性。
在欧洲,导致猪发生猪链球菌病以R群的2型猪链球菌为主,其次是1型、9型和7型[6]。从结果中看出,相对副猪嗜血杆菌,链球菌较易从关节中分离到,而关节中副猪嗜血杆菌的分离率很低,这与张玉玉等人得到的结论一致[7]。后来我们用大量的关节液涂布平板,仍然很难见到副猪嗜血杆菌。如果我们假设,引起关节肿胀的疾病与引起呼吸道疾病为同一种病原所致,那么我们有理由怀疑,在副猪嗜血杆菌引起的关节肿胀中,关节内不一定会有菌体的存在,关节肿胀或许由相关毒素引起,或者也有可能由其他致病性因素引起。
从研究中可以看出,在这些病料中,2型和7型发病比例较高。在分离到猪链球菌的6份病料中,肺脏和关节也不是一一对应的关系,无论是分离率还是链球菌的血清型;在一份病料中,我们从肺脏中分离到了2、7型链球菌,但在关节中仅分离到了2型,而在另一份病料中,我们在肺脏和关节中也分离到了不同血清型的链球菌。因此,在一头猪体内,可能存在多个血清型的链球菌,引起呼吸道症状或者败血症状的链球菌,与关节肿胀的链球菌可能不是同一个菌株甚至血清型。不同菌株甚至不同种血清型的链球菌的同时存在,无疑为链球菌的防治提高了难度。
同时,我们从关节分离到的链球菌中,7型的分离比例相对较高。这可能与7型链球菌的靶器官嗜性相关,也可能跟链球菌在不同地区的不同流行性有关[8-9]。
[1] 蔡宝祥.家畜传染病[M].4版.北京:中国农业出版社,2001.
[2]尹秀风,姜平,邓雨修,等.副猪嗜血杆菌的分离与鉴定[J].畜牧与兽医,2004,36(7):6-8.
[3]郑升博,华修国,陆伟,等.多重PCR方法检测猪链球菌主要致病血清型及其毒力因子[J].上海交通大学学报(农业科学版),2010,28(1):53-58.
[4] Okwumabua O,Persaud js,Reddy PG.Cloning and characterization of the gene encoding the glutamate dehydrogenase of Streptococcus suis serotype 2[J].Clin Diagn Lab Immunol,2001,8(2):251-257.
[5]李小军,张苏华,刘佩红,等.多重聚合酶链反应检测猪链球菌7种主要毒力因子[J].微生物与感染,2007,2(1):30-33.
[6] Staats JJ,Feder I,Okwumabua O,etal.Streptococcus suis:past and present[J].Veterinary Research Communications,1997,21:381-407.
[7]张玉玉,吴家强,任素芳,等.仔猪多发性关节炎病原菌的分离鉴定及耐药性研究[J].西南农业学报,2012,25(2):680-685.
[8]赵战勤,胡睿铭,吴斌,等.猪源链球菌的分离鉴定及生物学特性研究[J].畜牧兽医学报,2007,38(4):3764-381.
[9]王淑杰,徐敏,刘永刚,等.一株血清7型致病性猪链球菌的分离鉴定[J].中国预防兽医学报,2011,33(10):763-766.
[10]尹秀凤,姜平,邓雨修等.副猪嗜血杆菌的分离与鉴定[J].畜牧与兽医,2004,36(7):6-8.
[11]戴金玲,许云龙,周玉龙,等.猪链球菌7型的分离鉴定及药敏试验[J].中国畜牧兽医,2013,40(2):183-186.
