两株猪博卡病毒的检测及遗传演化分析
2014-03-11唐连飞朱事康朱中武佟铁铸禹思宇陈燕忠邹东辉罗卓军
周 宇,唐连飞,朱事康,朱中武,佟铁铸,禹思宇,刘 星,陈燕忠,邹东辉,罗卓军
(1.惠州出入境检验检疫局技术中心,广东 惠州516006;2.湖南出入境检验检疫局,湖南,长沙410004)
猪博卡病毒(Porcine Bocavirus,PBoV)属于细小病毒科、博卡病毒属,为单股线状无囊膜DNA病毒,基因组在5.2 kb左右[1],包括3个开放阅读框(ORFs),分别编码非结构蛋白NS1,结构蛋白VP1/VP2和磷酸化的非结构蛋白NP1[2-3],NP1基因的功能尚不清楚,VP1/VP2基因是其主要的抗原基因。该病毒的理化性质、致病机理和能引起的临床症状尚不清楚,对该病毒的研究仍处于起步阶段。2009年,瑞典科学人员首先发现了世界上第一例猪博卡病毒[4],2010年,翟少伦等[5]首次在我国191份疑似患高热病的病料中检出PBoV,胡军勇等[10]在对猪腹泻样品进行检测时发现PBoV的阳性率达到69.35%,表明该病毒在发生腹泻的猪肠道内普遍存在,虽然该病的致病性仍然存有争议,但其经常会与猪圆环病毒2型、猪输血传染病毒和猪繁殖与呼吸综合征病毒等在猪体内同时被检出。此后在中国北京市、上海市、湖北省等相继检测到猪博卡病毒。2010年Shan等[9]在无临床症状的猪粪便样品中检测到PBoV的广泛存在,2011年张志等[6]从河南某猪场表观健康猪样品中检测到PBoV,表明我国内地已经存在猪博卡病毒的感染。在基因分型上,翟少伦[7]等将其分为4个基因型,郝飞等[8]将其暂时分为7个基因型,国际病毒学分类委员会关于博卡病毒的分类方法按照非结构蛋白编码区NS1基因进行分类,但也有学者提出人博卡病毒应按照结构蛋白编码区VP1/VP2基因进行分类。其基因分型还需要进一步完善。
1 材料与方法
1.1 样品 200份猪粪便样本,分别采集自广东粤东地区的猪群。用1mL PBS稀释震荡混匀,12 000 r/min离心5 min,取200μL上清液进行病毒DNA抽提(采用天根生化科技(北京)有限公司的病毒DNA提取试剂盒)。
1.2 引物设计与合成 参照GenBank发表的猪博卡病毒序列,登录号为:HQ223038和HM053693,使用Primer5.0引物设计软件,分别针对NS1、NP1、VP1/VP2基因设计引物(如表1所示)。引物由英潍捷基(上海)贸易有限公司合成。-20℃保存备用。

表1 猪博卡病毒不同基因的PCR引物
1.3 PCR扩增 PCR反应体系为25μL,反应体系中含:上游引物、下游引物各2.5μL,2*Mix 12.5μL,模板2.0μL,ddH2O 5.5μL。PCR扩增条件为:NP1:95℃5min;94℃30 s,58℃30 s,72℃30 s,35个循环;72℃10 min;NS1和VP1/VP2:95℃5 min;94℃30 s,58℃45 s,72℃90 s,35个循环;72℃10 min。用1.5%琼脂糖凝胶电泳观察结果。
1.4 测序和分析 将阳性PCR产物送交英潍捷基(上海)贸易有限公司进行测序,然后将序列进行BLAST分析,并用DNAStar,MEGA5.1软件进行比对和进化树分析。参考序列选择了自2010-2013年已公布的猪博卡病毒全基因序列。登录号分别为:HQ223038,HM053693,HM053694,HM053672,HM053673,HM031134,JN831651,HQ291308,HQ29 1309,JF429834,JF429835,JF429836,JF512472,JF5 12473,JF713715,JF713714,JX854557,KC473563,KF206165,KF206155,KF206157,KF206167。
2 结果
2.1 PCR扩增 利用引物对所有样品进行PCR扩增,有2份样品可以扩增出特异性条带(见图1,图2,图3),将两份样品分别命名为GD4和GD18。
2.2 遗传分析
2.2.1 同源性比较 对GD4株和GD18株的NS1基因、NP1基因、VP1/VP2基因分别进行测序,测得的片段长度与预期的目的片段长度一致。应用BLAST和DNAStar分析软件进行相关全基因序列进行同源性比较,发现GD4株和GD18株相关基因同源性较低,在34.9%~50.5%之间。GD4株与HQ223038、JX854557、HQ291308相关基因的同源性较高,96%~99.8%之间,与其他毒株同源性较低,在60%以下;GD18株与KF206167、HM053693、HM053694、HQ29 1309、KF206165、KF206155同源性较高,在89.6%~96%之间,与其他分离株的同源性较低,在60%以下。两个毒株属于不同的基因型,GD4株基因突变率较低,GD18株基因突变率较高。

图1 NS1基因的检测结果

图2 VP1/VP2基因的检测结果
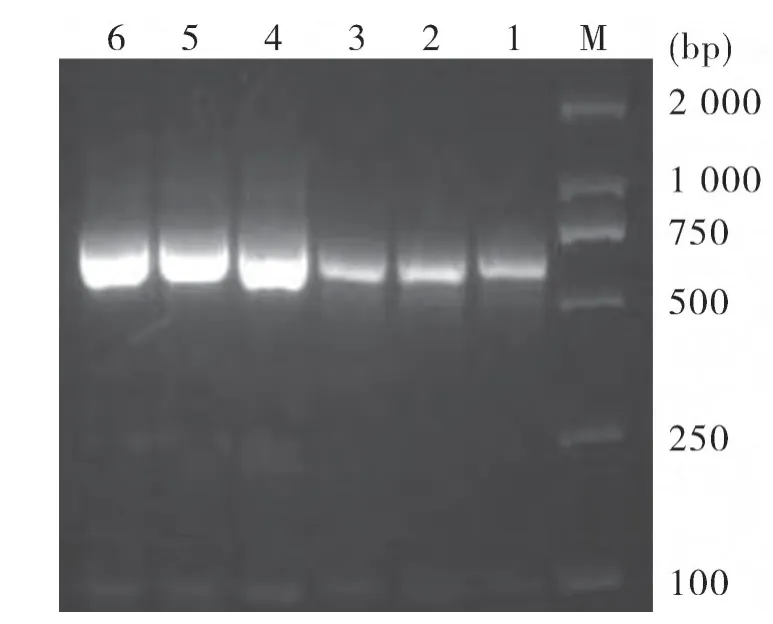
图3 NP1基因的检测结果
2.2.2 氨基酸系统进化树分析 应用MEGA5.1分析软件分别对GD4株和GD18株的NS1、NP1、VP1/VP2基因编码的氨基酸序列与参考株进行比对,绘制系统进化树,发现只有HM031134(中国江苏)株处于1个较远的分支。其他猪博卡病毒分为2个大分支,3个小分支,GD4株和GD18株的NS1和NP1处于1个大分支,不同的次分支,与多个欧洲株具有共同的祖先,在进化的过程中出现分化;而与美国、香港株亲缘关系较远;VP1/VP2却处于不同的大分支上。尤其是GD4株的VP1/VP2明显的处于1个独立的分支,预示其有自己独立的遗传演化趋势(见图4,图5,图6)。
3 讨论

图4 NS1氨基酸系统进化树分析

图5 NP1氨基酸系统进化树
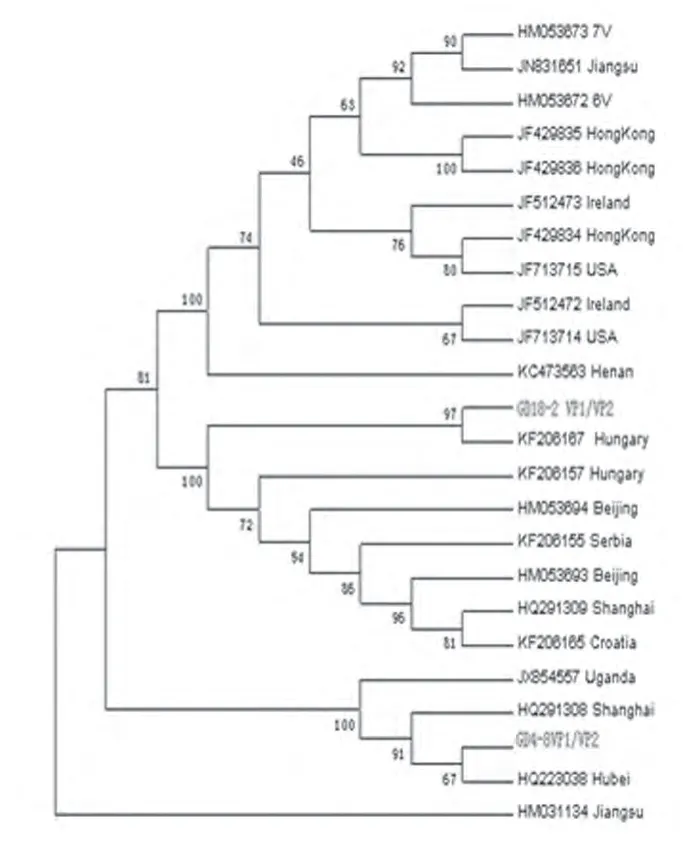
图6 VP1/VP2氨基酸系统进化树
当前对PBoV的研究还处于初级阶段,主要研究病毒的形态和基因组情况,并建立了相关的检测方法。本研究摘录了NCBI公布的PBoV具有代表性的全部22条PBoV的全基因序列。通过核苷酸序列的同源性比较和进化树分析发现,HM031134株与其他PBoV株的同源性很低,同源性在5.0%以内,而且在进化分支上相距较远并处于独立分支。而PBoV的各不同分离株大体可分为3大分支,并且同一分支序列的相似性较高,同源性在80.0%以上,变异性较低,而在不同分支之间的核苷酸序列相似性较低;地域性差异并不大,如美洲、欧洲、亚洲、非洲的毒株处于同一个进化分支;从目前公布的序列发现,国内存在的PBoV存在多样性和在一个地区同时存在多个毒株的情况,如上海的两个毒株HQ291308和HQ291309之间的差异显著;河南株与香港、美国等某些毒株同源性较高,而与其他国内毒株同源性较低,距离较远。本研究所得的两个毒株之间具有明显差异,分属不同的基因型,并且两个毒株均与欧洲株亲缘关系较近,与美国、香港毒株关系较远,推测认为是由于猪的引种和贸易往来导致的;氨基酸系统进化树表明GD4株的VP1/VP2处于独立的分支而其他两个基因编码的氨基酸却在同一大分支上,怀疑该毒株可能存在基因重组的可能,并且该毒株与其他毒株的致病性可能不同。虽然已经证实多种博卡病毒能够感染并且导致宿主发生急性腹泻[11-12],并且该病毒在发病猪群中的检出率明显高于健康猪群的检出率,但对于猪博卡病毒是否能导致宿主腹泻仍然存有争议[13-14],需要进一步深入研究。
[1]Blomstrom A L,Belák S,Fossum C,et al.Detection of a novel porcine boca-like virus in the background of porcine circovirus type 2 induced postweaning multisystemic wasting syndrome[J].Virus Res,2009,146(1-2):125-129.
[2]Zeng SL,Wang D,Fang L R,et al.Complete coding sequencesand phylogenetic analysis of porcine bocavirus(PBoV)[J].JGen Virol,2011,10:1099.
[3] Manteufel J,Truyen U.Animal bocaviruses:a brief rewiew[J].Intervirology,2008,51:328-334.
[4] Blomstrom A,Belak S,Fossum C,et al.Detection of a novel porcine boca-like virus in the background of porcine circovirus type 2 induced postweaning multisystemic wasting syndrome[J].Virus Research,2009,146:125-129.
[5]翟少伦,岳城,韦祖樟,等.猪博卡病毒PCR检测方法的建立及其应用[J].中国动物传染病学报,2010,18(2):14-17.
[6]张志,王赛赛,李岚,等.健康屠宰猪中博卡病毒的检测及遗传演化分析[J].畜牧与兽医,2012,44(10):9-11.
[7]翟少伦,陈胜男,魏文康,等.猪博卡病毒的研究进展[J].病毒学报,2012,28(2):190-193.
[8]郝飞,汤德元,李春燕,等.猪博卡病毒流行病学研究[J].畜牧兽医学报,2012.43(10):1609-1617.
[9]Shan Tong-ling,Lan Dao-liang,Li Lin-lin,et al.Genomic characterization and high prevalence of bocaviruses in swine[J].PLoS One,2011,6(4):e17292.
[10]胡军勇,张倩,王丹丹,等.猪博卡病毒PCR检测方法的建立及其初步流行病学调查[J].中国预防兽医学报,2012,34(8):632-636.
[11]Chen Jian-fei,Liu Xiao-zhen,Shi Da,et al.Complete genome sequence of a porcine epidemic diarrhea virus variant[J].JVirol,2012,86(6):3408-3412.
[12]Sun Rui-Qin,Cai Ru-Jian,Chen Ya-Qiang,et al.Outbreak of porcine epidemic diarrhea in suckling piglets,China[J].Emerg Infect Dis,2012,18(1):61-163.
[13]Meng,X J.Emerging and re-emerging swine viruses[J].Transbound Emerg Dis,2012,9(10):1865-1682.
[14]ChengWei-Xia,Li Jin-Song,Huang Can-Ping,et al.Identification and nearly full-length genome characterization of novel porcine bocaviruses[J].PLoSOne,2010,5(10):e13583.
