大鼠骨髓基质干细胞体外分离、纯化、培养的实验研究
2014-02-27何玉祥刘振川王茂华吴学君
何玉祥,孙 岩,刘振川,刘 洋,周 华,王茂华,袁 海,金 星,吴学君
大鼠骨髓基质干细胞体外分离、纯化、培养的实验研究
何玉祥,孙 岩,刘振川,刘 洋,周 华,王茂华,袁 海,金 星,吴学君
目的探讨Wistar大鼠骨髓基质干细胞(BMSCs)体外分离、纯化、培养的方法。方法 对5周龄Wistar大鼠予1%戊巴比妥钠(0.006 ml/g)行腹腔麻醉,成功后于大鼠双侧后肢股骨、胫骨提取BMSCs,用贴壁培养法分离、纯化、培养BMSCs,观察细胞形态变化及绘制细胞生长曲线了解其生长、传代、扩增特性,并应用流式细胞仪检测细胞表面标志物行细胞鉴定。结果 应用贴壁培养法分离、纯化、培养的大鼠BMSCs增殖迅速、生长曲线良好,经细胞表面标志物检测证实为BMSCs,且细胞具有很好的均一性(96.36%)。结论 贴壁培养法能够很好地分离、纯化、培养大鼠BMSCs,并且获得的细胞具有很强的增殖能力,取第3~6代细胞用于实验研究最为合适。
骨髓基质干细胞;分离和提纯;细胞培养技术;大鼠,Wistar
骨髓基质干细胞(bone marrow stromal cells,BMSCs)属成体干细胞(adult stem cells,ASCs),在成体骨髓细胞中是除造血干细胞之外的另一类骨髓干细胞,为多能或全能干细胞,来源于中胚层的间充质[1-2]。BMSCs是在胚胎发育过程中间充质干细胞迁移填充组织间隙时定居骨髓腔而来,其主要存在于结缔组织和器官组织通道中,骨髓是其主要来源。BMSCs在骨髓中的丰度并不高,并且在机体发育的不同阶段含量也不同,年龄越大其含量越少。因此要能够得到符合研究或临床应用数量的BMSCs,必须将体内的BMSCs在离体条件下进行分离、纯化、扩增,以获得大量可用的细胞。本研究应用BMSCs的底物黏附特性,用贴壁培养法分离、纯化、培养获得BMSCs,并观察其形态及不同生长阶段的生物学特点,为相关实验研究提供依据。
1 材料与方法
1.1 实验动物 雄性 Wistar大鼠,5周龄,体重130 g,由山东大学实验动物中心提供[许可证号:scxk(16/10)20090001]。
1.2 主要试剂及仪器 胎牛血清(FBS,Hyclone公司),DMEM/F12培养液、HG-DMEM培养液及胰蛋白酶(Gibco公司),D-Hank's液(自制),青霉素和链霉素(Sigma公司),流式细胞仪检测所用抗体(大鼠 Anti-CD44-FITC标记、大鼠 Anti-CD45-FITC标记、大鼠 Anti-CD90-FITC标记、大鼠 Anti-CD105-FITC标记,BD公司);恒温孵育箱(USA Forma Scientific),倒置光学相差显微镜及PM-CBAD全自动显微照相机(JAP,奥林巴斯)。
1.3 方法
1.3.1 BMSCs的分离和培养:予0.006 ml/g 1%戊巴比妥钠对大鼠行腹腔麻醉,75%乙醇浸泡双侧后肢消毒3 min。超净工作台无菌条件下,取大鼠双侧后肢股骨、胫骨,于无菌磷酸盐缓冲液(PBS)中去除附着组织,PBS反复冲洗干净。剪开两端骨骺处,用抽取10%FBS的DMEM/F12培养液从一端正压打入,将冲出的骨髓状物滴入有10%FBS的DMEM/F12培养液的培养瓶中,小心多次将骨髓全部冲出,用尖头吸管轻轻反复吹打制成细胞悬液。培养瓶拧紧瓶盖后反向旋松瓶口,置于5%CO2、37℃、饱和湿度的孵育箱孵育。1 d后换掉部分培养液,3 d全部换掉,换液频率为72 h。显微镜观察细胞生长情况,融合度为80% ~90%时,用0.25%胰蛋白酶约1 ml室温消化后,据细胞生长情况以1∶2或1∶3比例接种传代,3~4 d换培养液1次。此时获得细胞为第1代细胞(P1),当细胞生长至融合度达90%时,用上述方法再传代,使细胞不断纯化和扩增。
1.3.2 BMSCs的传代:镜下观察BMSCs铺满培养瓶瓶底80% ~90%时,据其生长情况以1∶2或1∶3比例接种传代。弃旧培养液。D-Hank's液轻缓漂洗细胞2次,尽量洗去残余血清,弃 D-Hank's液。加0.25%胰蛋白酶(以盖满瓶底为准)轻轻晃动,于37℃下消化,倒置相差显微镜下观察,细胞突起回缩、间隙增大、近乎缩成圆形时,吸出消化液。直接加10%FBS的DMEM/F12培养液终止消化。弯头吸管均匀有序吹打,动作不宜过猛,防止气泡产生。调整悬液浓度,均匀加入至3个培养瓶中,1.0 ml/瓶,补充10%FBS的DMEM/F12培养液至培养瓶容积1/10(约5 ml),送孵育箱培养。
1.3.3 BMSCs生长曲线测定:取第3、6代BMSCs,弃上清。PBS冲洗3次,0.25%胰蛋白酶室温消化。将所得单细胞悬液离心,1000 r/min,持续5 min,弃上清。细胞沉淀中加入10%FBS的DMEM/F12培养液,重新悬浮细胞。细胞计数板计数,使细胞浓度达1×104/ml,后以每孔1 ml接种于24孔板内,孵育箱孵育培养。每日取3孔予0.25%胰蛋白酶消化后,计算细胞均数,持续测量10 d。以天数为横坐标,细胞数量平均值为纵坐标,绘制细胞生长曲线。
1.3.4 BMSCs表面标志物检测:取第3代BMSCs,长满培养瓶瓶底后,弃上清,PBS洗涤3次,0.25%胰蛋白酶消化贴壁细胞,将细胞悬液在室温下800 r/min离心 3 min,弃上清。PBS洗涤 2次,800 r/min离心3 min,弃上清。加 PBS,制成1×106/ml细胞悬液。加入“1.2”项下抗体,用弯头吸管吹打混匀,室温孵育60 min。PBS洗涤1次,800 r/min离心3 min,弃上清。将细胞重新悬浮,流式细胞仪检测细胞表面标志物。同法做同型对照。
2 结果
2.1 BMSCs形态学观察 本方法所获原始细胞液为多种骨髓细胞的混合液,细胞数量大,低倍光镜观察细胞形态呈球形,有折光性,各细胞间差别不大。培养1 d可见部分细胞贴壁生长,但培养液中可见大量小圆细胞悬浮,此时更换一部分培养液,去除一部分悬浮的非BMSCs。培养3 d,更换培养液,去除杂质细胞。光镜下可见:贴壁细胞呈单层生长,多数为单个散在分布或多个细胞聚集,分布不均;细胞大部分呈梭形,少部分呈多角形,细胞核居中,折光性强。培养1~5 d细胞为生长潜伏期,扩增较缓慢,细胞克隆数的增加不是特别显著;培养6~8 d时观察,发现此时细胞克隆数量增加显著,外观也开始出现明显变化,呈纺锤形,有多个星形突起。细胞紧贴培养瓶壁生长延伸,呈条索状融合,中心细胞轮廓不清,体积变小,而周边细胞形态不变,呈漩涡样生长。换液过程中,黏附于贴壁细胞上的杂质细胞逐渐清除。培养10~14 d细胞长满整个培养瓶底部,接近融合,细胞形态均一,呈片状。若不进行传代继续培养,细胞可继续增殖,每个集落数百至数千个细胞互相重叠形成双层或多层。长满瓶底后的细胞用0.25%胰蛋白酶37℃消化后,按1∶3的比例传代。消化传代后的细胞开始为圆形,悬浮或聚集分布,一般于18~24 h重新贴壁生长,变为短梭形或多角形,此时细胞克隆速度急速增加,潜伏期较短(3 d左右)。然后步入快速增殖阶段,7 d左右细胞重新长满瓶底,接近融合,恢复片状或辐射状,细胞排列有一定的方向性。随着传代次数的增加,细胞不断增殖和纯化,传到第10代以后,细胞形态发生较大变化,由梭形变肥大,细胞贴壁能力较差,细胞质较疏松,增殖能力明显下降。本组大鼠BMSCs培养镜下形态学观察见图1。
2.2 BMSCs生长曲线测定 BMSCs有很强的增殖能力,原代细胞培养时潜伏期较长,一般5 d左右,随后细胞克隆速度加快,细胞数量成倍增加,9~10 d进入增殖平台期,细胞数量增加趋于平缓。传代后增殖仍迅速,从图2可看出,第3、6代细胞生长曲线相似,传代后的BMSCs培养1 d时,BMSCs稍减少,为细胞适应期,传代后2 d进入生长潜伏期,第4天进入快速增殖期,集落中细胞呈对数增殖,7 d后进入增殖平台期,细胞数量增加趋于平缓。

图1 大鼠骨髓基质干细胞培养镜下形态学观察
2.3 BMSCs表面标志物鉴定 应用流式细胞仪检测结果显示细胞均一性较好(96.36%),细胞表面抗原CD44、CD90、CD105呈阳性,CD45呈阴性,证明培养的大鼠细胞为BMSCs,见图3。
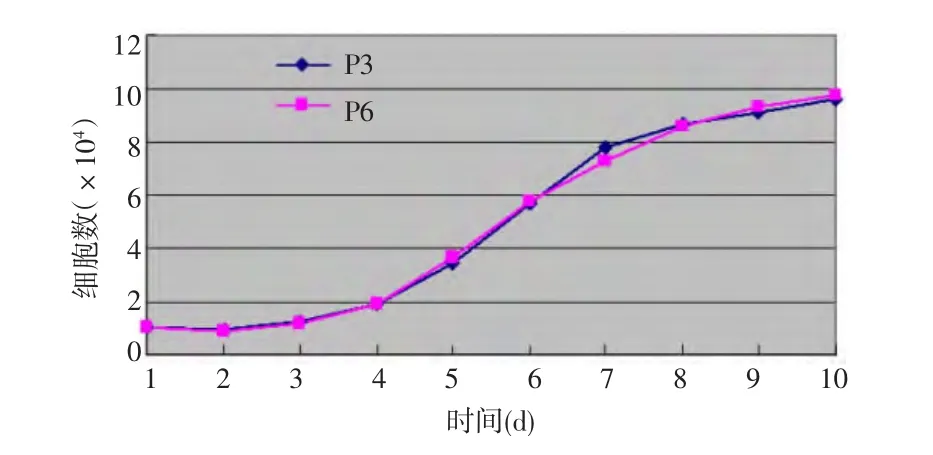
图2 大鼠骨髓基质干细胞第3、6代生长曲线图P3代表第3代细胞,P6代表第6代细胞
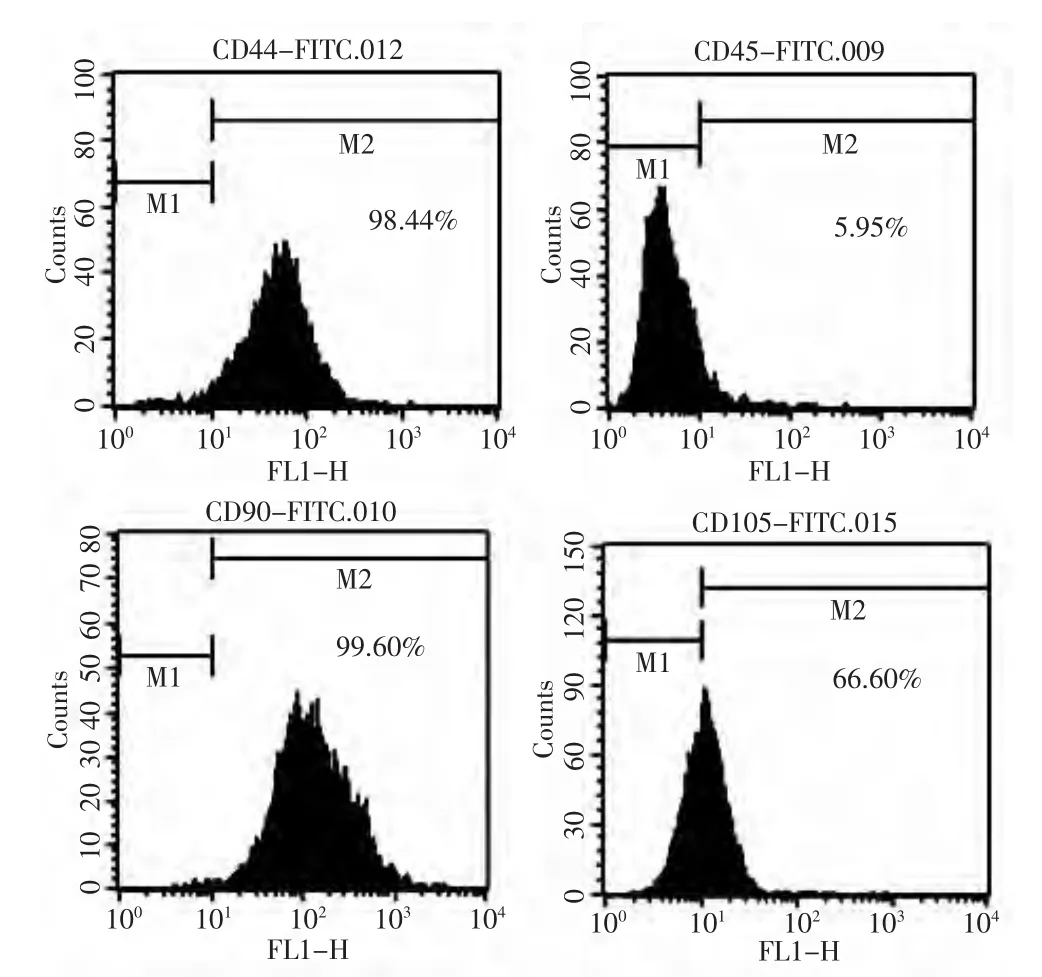
图3 流式细胞仪检测大鼠骨髓基质干细胞表面标志物结果
3 讨论
找到理想的种子细胞是组织工程的先决条件,该细胞在一定条件下体外培养能增殖发育成特定细胞、组织和器官,并能够完全替代机体缺失区功能。理想的种子细胞应具有以下特点[3-8]:①取材方便,对机体损伤小;②在体外培养过程中有较强的增殖传代能力,生物活性好,衰亡率低,能够在较短时间内大量增殖并可定向分化;③具有修复功能,组织相容性好,免疫活性低,生物毒性低,安全性高。
BMSCs可在特定体内微环境下被诱导分化为多种组织细胞,主要优点为:①具有强大的增殖能力和多向分化潜能;②易于分离、纯化、培养、扩增,不存在免疫排斥,多次传代扩增和冷冻保存后仍具有干细胞特性;③BMSCs为成体干细胞,在应用方面较少涉及伦理问题;④可转染外源基因并稳定高效表达。故BMSCs在组织器官再生、老化、功能衰退研究及先天性或遗传性疾病治疗等方面均有广阔的发展空间,是目前公认最理想的细胞和基因治疗工具。
BMSCs在骨髓中的含量为1/(105~106)个,且年龄越大在骨髓中的含量越少。在实验和临床研究中如何得到较高纯度的BMSCs非常重要。目前,对BMSCs的获取、分离、提纯及体外扩增方法仍在不断实验和改进中,故尚无统一标准[5,7,9]。1968 年,Friedenstein等利用自然贴壁法获得了BMSCs,并证实了其存在[1]。现在大多数研究者也都是应用其贴壁性能而进行获取、分离和体外培养。
目前,从骨髓中分离 BMSCs的主要方法[10-14]有:①贴壁法:骨髓中的造血干细胞能分泌生长因子和促贴壁物质,有利于BMSCs的生长,同时可促进BMSCs贴壁。又因BMSCs具有黏附底物的特性,故应用贴壁法分离BMSCs可以在换液、传代中将不贴壁的造血干细胞等杂质去除,使之纯化。此法简单、便捷,不影响细胞活性和增殖能力。本实验即采用此法分离并进一步培养扩增,获得较高纯度的BMSCs。②密度梯度离心法:密度梯度离心法是根据骨髓中细胞成分比重的不同,经高速离心将密度不等的细胞分离纯化,应用此法可提取到相对较纯的BMSCs,但是存在细胞破坏多、增殖慢等问题[15]。③流式细胞仪分选法:骨髓中各种细胞大小不一,其细胞表面表达的特异性抗原也不相同,利用此特点可以分离得到相对高纯度细胞。但该法极大地减弱细胞活性,有时可致细胞死亡,对细胞损伤极大。
本实验所获原始细胞液为多种骨髓细胞的混合液。细胞传到第10代后,细胞形态发生较大变化,由梭形变肥大,细胞贴壁能力较差,细胞质较疏松,增殖能力明显下降,并出现返祖现象,呈成纤维细胞样外观。推测其原因可能是当细胞离体培养后来自其他细胞的外源性信号被中断,导致受其调控的增殖、分化表达减弱或停止。本实验大鼠BMSCs生长曲线显示,BMSCs具有很强的增殖能力,并经历了生长潜伏期、快速增殖期和增殖平台期,传代后增殖仍然迅速,说明在体内丰度较低的BMSCs于体外进行培养、扩增是完全可行的。另外,图2显示,第3、6代细胞生长曲线基本相同,说明第3、6代细胞状态较稳定、最佳,取此细胞进行实验比较合适。
对于BMSCs的培养液也在不断改进中,不同成分的血清对BMSCs的成活率、黏附性、扩增能力以及多向分化的潜能影响较大。笔者所在科室发现应用小牛血清后,分离培养的BMSCs黏附性较差,扩增能力也受影响且增殖较慢,而用FBS培养效果较理想,细胞生长好,贴壁能力强,增殖快速。因此,建议应用10%FBS作为培养大鼠BMSCs的培养液。
总之,本研究利用贴壁培养法获得BMSCs的方法是可行的,相比目前其他常用的分离方法(密度梯度离心法、流式细胞仪分选法),在较高的细胞均一性和纯度的基础上,细胞成活率及增殖速度方面具有显著优势,而且操作简便、费用低;此法获得的BMSCs具有很强的增殖能力,能够满足实验研究的需要,取第3~6代细胞用作实验研究较为合适。
[1] 孙振强,纪卫政,李涛,等.供体骨髓间充质干细胞抑制肝移植大鼠免疫排斥的研究[J].中华消化外科杂志,2009,8(6):449-452.
[2] KafienahW,Mistry S,Williams C,etal.Nucleostemin is amarkerof proliferating stromal stem cells in adult human bonemarrow[J].Stem Cells,2006,24(4):1113-1120.
[3] Bocelli Tyndall C,Bracci L,Spagnoli G,et al.Bone marrow mesenchymal stromal cells(BM-MSCs)from healthy donors and auto-immunedisease patients reduce the proliferation of autologous and allogeneic-stimulatedlymphocytes in vitro[J].Rheumatology(Oxford),2007,46(3):403-408.
[4] Cai L,Wang Q,Gu C,et al.Vascular and micro-environmental influences on MSC-coral hydroxyapatite construct-basedbone tissue engineering[J].Biomaterials,2011,32(33):8497-8505.
[5] Hass R,Kasper C,Böhm S,et al.Different populations and sources ofhumanmesenchymal stem cells(MSC):A comparison of adultand neonatal tissue-derived MSC[J].Cell Commun Signal,2011,9:12.
[6] Colletti E J,Airey JA,Liu W,et al.Generation of tissue-specific cells from MSC does not require fusion or donor-to-hostmitochondrial/membrane transfer[J].Stem Cell Res,2009,2(2):125-138.
[7] Molina E J,Palma J,Gupta D,et al.Reverse remodeling is associated with changes in extracellularmatrix proteases and tissueinhibitors after mesenchymal stem cell(MSC)treatment of pressure overload hypertrophy[J].J Tissue Eng Regen Med,2009,3(2):85-91.
[8] da Silva Meirelles L,Sand T T,Harman R J,et al.MSC frequency correlateswith blood vessel density in equine adipose tissue[J].Tissue Eng Part A,2009,15(2):221-229.
[9] MaharlooeiM K,Bagheri M,Solhjou Z,et al.Adipose tissue derived mesenchymal stem cell(AD-MSC)promotes skin wound healing indiabetic rats[J].Diabetes Res Clin Pract,2011,93(2):228-234.
[10] Stafford N.Patents cannot be given for research methods that destroy healthy human embryos toobtain stem cells,German court rules[J].BMJ,2012,345:e8248.
[11]Ning L,Goossens E,GeensM,etal.Mouse spermatogonial stem cells obtain morphologic and functional characteristics of hematopoietic cells in vivo[J].Hum Reprod,2010,25(12):3101-3109.
[12]HurlbutW,Doerflinger R.Can amorally acceptable way be found to obtain embryonic stem cells?[J].Origins,2004,34(27):429-433.
[13] Robertson JA,Kahn JP,Wagner JE.Conception to obtain hematopoietic stem cells[J].Hastings Cent Rep,2002,32(3):34-40.
[14]Quan R F,Tang Y H,Huang ZM,et al.Difference of adherence,proliferation and osteogenesis ofmesenchymal stem cells culturedon different HA/ZrO2 composites[J].Chin JTraumatol,2012,15(3):131-139.
[15]Pittenger M F,Mackay A M,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
A Study on the Methods of Separation,Depuration and Cultivation in Vitro for Bone Marrow Stromal Cells of Rats
HE Yu-xiang1,SUN Yan1,LIU Zhen-chuan2,LIU Yang1,ZHOU Hua1,WANG Mao-hua1,YUAN Hai1,JIN Xing1,WU Xue-jun1(1.Departmentof Vascular Surgery,Provincial Hospital Affiliated to Shandong University,Jinan 250021,China;2.Department of Clinical Medicine,Shandong University,Jinan 250021,China)
ObjectiveTo explore themethods of separation,depuration and cultivation in vitro for bonemarrow stromal cells(BMSCs)of rats.MethodsFive-week-old Wistar ratswere anesthetized through abdominal cavities using 1%sodium pentobarbital(0.006ml/g),and then BMSCswere extracted from the rats'femurs and tibias.The adherent culturemethod was used to separate,purify and culture the BMSCs.The changes in cellmorphology were observed,and characteristics of cell growth,passage and amplification were studied by drawing curve of growth.The cellswere identified with flow cytometry.ResultsThe BMSCs obtained with adherent culture method had rapid proliferation and good growth curve,which proved BMSCs by the detection of cell surface marker,and the cells had good homogeneity(96.36%).ConclusionAdherent culture can well separate,purify and culture the BMSCs,and the obtained cells have better proliferative capacity,and the 3th-6thgenerations aremore suitable for experimental research.
Bonemarrow stromal cell;Isolation & purification;Cell culture technique;Rat,Wistar
R394.26;R-332
A
2095-140X(2014)05-0010-04
10.3969/j.issn.2095-140X.2014.05.003
山东省自然科学基金(ZR2012HM063);高等学校博士学科点专项科研基金(20090131110059);山东省优秀中青年科学家科研奖励基金项目(2005BS03007)
250021济南,山东大学附属省立医院血管外科(何玉祥、孙岩、刘洋、周华、王茂华、袁海、金星、吴学君);250012济南,山东大学医学院临床医学系(刘振川)
吴学君,E-mail:drwuxuejun@yahoo.com.cn
2013-12-15 修回时间:2014-01-19)
基础研究
·论著·
