CYP3A基因多态性与心脏移植术后环孢素肾毒性的相关性
2014-02-27魏国义石秀锦张海波贾一新首都医科大学附属北京安贞医院药剂科北京0009首都医科大学附属北京安贞医院心外科北京0009毅新兴业北京科技有限公司北京00080
魏国义,石秀锦,张海波,钟 逾,周 洋,贾一新(.首都医科大学附属北京安贞医院药剂科,北京 0009;.首都医科大学附属北京安贞医院心外科,北京 0009;.毅新兴业(北京)科技有限公司,北京 00080)
·实验研究·
CYP3A基因多态性与心脏移植术后环孢素肾毒性的相关性
魏国义1,石秀锦1,张海波2,钟 逾3,周 洋1,贾一新2(1.首都医科大学附属北京安贞医院药剂科,北京 100029;2.首都医科大学附属北京安贞医院心外科,北京 100029;3.毅新兴业(北京)科技有限公司,北京 100080)
目的:探讨心脏移植受者CYP3A基因多态性与环孢素(CsA)所致肾毒性易感性的关系。方法:应用飞行时间质谱技术分析66例CsA免疫抑制治疗发生肾毒性(20例)和未发生肾毒性(46例)心脏移植术后患者的CYP3A基因多态性,并通过统计学分析CYP3A各单核苷酸多态性(SNP)位点基因型与CsA所致肾毒性之间的关系。结果:筛选出8个标签位点的等位基因在肾毒性和非肾毒性组间的分布差异均无统计学意义。经非条件性二元Logistic回归分析,在AIC定义的共显性和显性遗传模型下,未发现CYP3A基因8个SNP位点与CsA肾毒性的发生有显著性关联。结论:本研究显示心脏移植受者本次调查的CYP3A基因位点与CsA所致肾毒性无显著性关联。
飞行时间质谱技术;心脏移植;环孢素;肾毒性;CYP3A;基因多态性
心脏移植术后的终生性免疫抑制治疗包括监测排斥反应、维持用药和治疗相关合并症等。钙调神经蛋白抑制剂环孢素(cyclosporine A,CsA)具有较强的免疫活性,已广泛用于器官移植术后抗排异反应的治疗。临床使用中发现,CsA具有治疗指数窄、个体内和个体间差异大的特点,主要应用治疗药物监测方法调整浓度,但仍难以避免不良反应的发生,文献[1]报道服用CsA引起肾毒性的发生率为50% ~ 70%。Morales[2]总结了肾移植术后随访10年的组织学资料,发现所有使用CsA免疫抑制剂的患者均出现了肾毒性组织学表现。CsA肾毒性是移植术后的严重并发症,可能导致肾功能受损和慢性移植物失功,是移植失败的主要指征。Naesens等[3]综述了发生肾毒性的危险因素,包括循环中CsA过量、CsA在肾组织局部的暴露、高龄肾脏、盐缺失、非甾体类抗炎药和利尿药的使用等。然而,CsA的慢性肾毒性机制至今仍不清楚[4],因此研究确定CsA慢性肾毒性的易感因素能有效改善CsA肾毒性的临床治疗。
CsA的代谢物在患者血液中的浓度远高于CsA原药[5];虽然部分CsA代谢物具有免疫抑制作用[6],但一些代谢物在老鼠肾脏中却表现出减少肾小球滤过率和形成肾小管空泡化[7],亦有研究[8]发现人类血液中CsA的代谢物浓度与肾功能不全具有相关性,提示这些代谢物或许在CsA慢性肾毒性的形成过程中具有非常重要的作用,同时CsA主要通过包括CYP3A4、CYP3A5在内的CYP3A亚家族进行代谢[9]。但关于CYP3A基因多态性与心脏移植患者CsA慢性肾毒性的相关研究国内外鲜有报道,本研究旨在探讨CYP3A基因多态性对心脏移植患者CsA慢性肾毒性的影响,以期为临床合理用药提供参考。
1 对象与方法
1.1 研究对象
选取2004年1月 – 2012年12月在我院行心脏移植术的患者,共计71例。入选者无其他严重疾病。排除术后失访患者3例、术后1个月内死亡患者2例,共有66例患者入组。所有入组患者术后均采用CsA、吗替麦考酚酯、糖皮质激素三联免疫抑制方案治疗,于手术当天及术后第4天行免疫诱导治疗[巴利昔单抗(舒莱)20 mg·d-1,ivgtt]。术后第3天或气管插管拔管后开始口服CsA,起始剂量为5 mg·kg-1·d-1,分2次口服,之后通过监测CsA血药浓度调整剂量,调整后的维持剂量为1.2 ~ 3.0 mg·kg-1·d-1。移植术后6个月停用糖皮质激素,继续使用CsA、吗替麦考酚酯。本研究经过我院伦理委员会的批准,患者或其家属均知情同意。
1.2 观察指标
详细记录患者的性别、年龄、体质量、身高等一般临床资料,及移植术后环孢素剂量、CsA全血浓度、肝肾功能等实验室检查结果。测定66例患者CYP3A4、CYP3A5基因多态性。
1.3 分组标准
慢性肾毒性组入选标准:1)心脏移植术后,定期复诊至少12个月;2)在移植后持续超过3个月的时间里,血清肌酐值至少> 141.44 μmol·L-1,但< 397.80 μmol·L-1;或爬行肌酐值大约超过基准线的20%;3)改用其他免疫抑制剂后的6个月内,肌酐值缓慢降至基准线[10-11]。
对照组入选标准:心脏移植术后,定期复诊至少12个月,且血清肌酐值持续< 141.44 μmol·L-1。
1.4 标本采集与分离
收集随访的心脏移植患者服药后12 h的空腹静脉血进行CsA血药浓度监测,并留取监测后乙二胺四乙酸(EDTA)抗凝的静脉全血2 mL,应用全基因组DNA提取试剂盒(北京天根生化有限公司),按照说明书从1 mL外周血中提取白细胞基因组DNA[溶解于0.1×TE缓冲液中(10 mmol·L-1Tris-HCL,1 mmol·L-1EDTA,pH 8.0),于– 20 ℃冰箱储存备用]进行检测。使用前经DU 800 紫外可见分光光度计(美国Beckman Coulter 公司)检测,D(260)/D(280)均在1.6 ~ 2.0范围内,DNA浓度均在10 ng·mL-1以上。
1.5 标签SNP的选择[12]
使用HapMap数据库的人类全基因组的SNP基因型数据进行标签位点的选择。再使用Haploview 4.2程序对从HapMap下载的中国汉族人群(CHB)基因型数据进行标签位点的选择,从CYP3A基因相关序列中共找到8个次要等位基因频率(MAF) > 0.01的Tag SNP。
1.6 SNP质谱分型[12]
应用Sequenom公司的基质辅助激光解析电离飞行时间质谱系统(MALDI-TOF MS)中的iPLEX试剂盒进行SNP基因型分析[13]。其步骤简述如下:1)多重PCR引物设计与扩增;2)去除未反应的引物和dNTPs;3)单碱基延伸PCR反应;4)纯化的延伸反应产物进行MALDI-TOF-MS分析;5)数据采集和基因型分析。
1.7 统计学方法
采用SPSS 17.0统计软件分析两组样本年龄、性别、体质量、身高的组间差异,并对肾毒性和无肾毒性样本中的等位基因频率和基因型频率的统计学差异应用χ2检验。在http://ihg.gsf.de/cgi-bin/hw/hwal.pl网站,对无肾毒性对照样本的各个位点进行Hardy-Weinberg平衡检验,其本质上是χ2检验,α = 0.05。采用Akaike's信息标准(AIC)[14]选取最保守的遗传模型,对各个SNP进行分析。应用STATA 10.0软件进行非条件性二元Logistic回归分析,并辅以年龄、性别的校正,计算目标SNP基因型的优势比(odds ratios,OR)和95%可信区间(confidence intervals,CI)。所有P值均为双尾检验。
2 结果
2.1 一般情况
66例心脏移植术患者接受CsA治疗,46例未发生肾毒性作为对照组,20例被诊断为慢性肾毒性,其中13例患者血清肌酐绝对值超标,肾毒性发生时间为CsA用药后(12.69±10.96)个月;7例患者爬行肌酐值超过基准线的20%,肾毒性发生时间为(16.71 ± 17.95)个月。两组患者的一般临床资料比较详见表1。由表1可知,两组患者年龄、性别、身高及体质量等比较,差异均无统计学意义(P > 0.05)。
表1 两组患者一般临床资料的比较.Tab 1 Comparison of clinical data between two groups.

表1 两组患者一般临床资料的比较.Tab 1 Comparison of clinical data between two groups.
临床特征 慢性肾毒性组 无肾毒性组病例数 20 46性别(男/女) 18/2 39/7年龄/岁 43.95 ± 12.63 41.98 ± 14.91身高/cm 172.42 ± 7.11 168.87 ± 8.55体质量/kg 72.05 ± 14.42 65.00 ± 14.79
2.2 单位点关联分析
CYP3A基因SNP的rs编号、染色体位置和等位基因频率详见表2。所有位点无肾毒性对照组都通过了Hardy-Weinberg平衡检验(P >0.05)。CYP3A基因8个SNP位点的等位基因在肾毒性和非肾毒性组间的分布差异均无统计学意义。
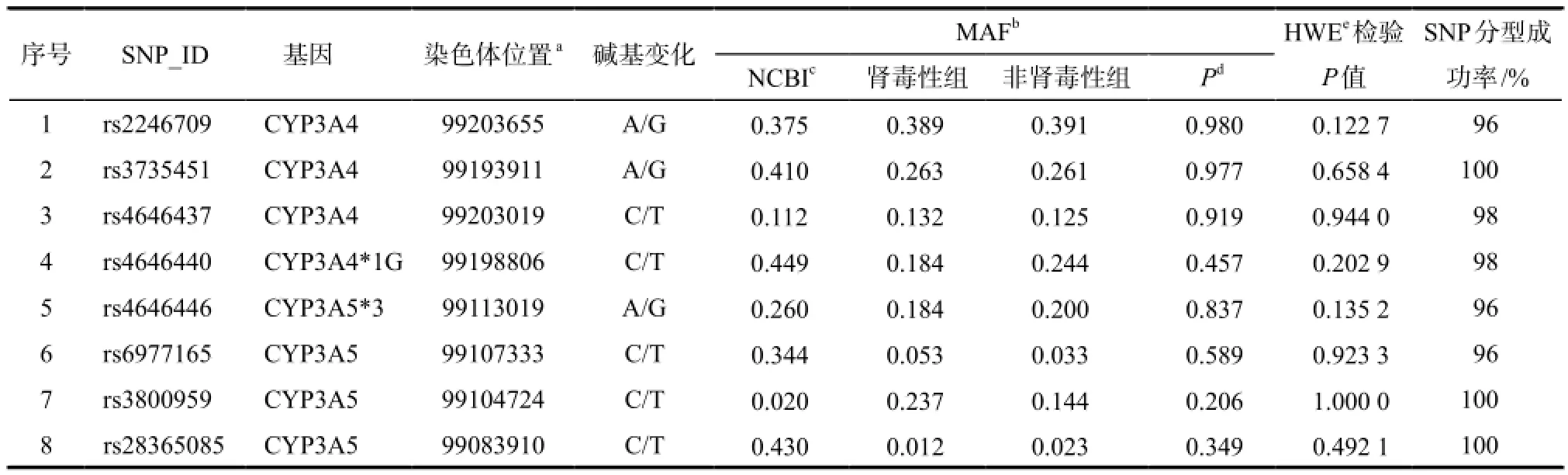
表2 CYP3A基因8个单核苷酸多态性(SNP)的相关信息Tab 2 Information about 8 genotyped SNP of CYP3A gene
经非条件性二元Logistic回归分析,在AIC定义的共显性和显性遗传模型下,发现CYP3A基因16个SNP位点与CsA肾毒性的发生无显著性关联,见表3。
3 讨论
CsA主要通过包括CYP3A4、CYP3A5在内的CYP3A亚家族进行代谢,CYP3A是细胞色素P450酶的一个亚家族,主要分布在肝和小肠,是参与药物代谢和口服药物首过效应的主要酶系[15]。CYP3A亚家族在人体内有CYP3A4、CYP3A5、CYP3A7及CYP3A43 四种亚型,它们串联排列于7q22.1长约231 kb的基因座内。迄今为止,CYP3A4已经确定有40个等位基因,CYP3A5存在30多个等位基因(http://www. cypalleles.ki.se)。本研究使用Haploview软件共从CYP3A基因相关序列中找到8个Tag SNP(代表20个SNP)进行CsA肾毒性易感基因相关性研究。
2007年Du等[16]对中国汉族、侗族和畲族3个民族人群中CYP3A基因多态性进行研究,发现CYP3A4*1G(Tag SNP rs4646440,被代表位点rs2242480)是目前中国人群中己确定的CYP3A4中等位基因突变率最高的位点,可能是中国人群中CsA有效剂量存在个体差异的重要影响因素之一,汉族人的突变频率为22%。本研究CYP3A4*1G的突变频率为29.3%,与文献报道相符。Kuehl等[17]研究发现,CYP3A5的基因突变是产生酶活性差异的最主要原因,其中最具功能意义的突变位点是CYP3A5*3(Tag SNP rs4646446,被代表位点rs776746)。CYP3A5*3在外显子3(6986A > G)的突变,引起可变剪切,产生了不稳定的蛋白质,使得携带突变型纯合子个体(CYP3A5*3/*3)不表达CYP3A5。因而,不论研究对药物代谢影响,还是与疾病发生的相关性,均聚于其身。不同种族间CYP3A5的变异率有所不同,其中CYP3A5*3在白种人的突变频率为77.6%,在黑种人的突变频率为70.6%,而在中国人、日本人中的突变频率分别为71% ~ 76%、71% ~ 85%[18]。本研究CYP3A5*3的突变频率为80.4%,与文献报道相符。
Christians等[8]研究表明,CsA及其代谢物在肾组织局部的暴露是移植后慢性肾毒性发生的危险因素,但关于CYP3A4*1G、CYP3A5表达个体差异与肾毒性发生的相关性尚存在争议。有学者[19-20]通过对以CsA为主要免疫抑制剂的患者进行CYP3A5基因多态性与CsA慢性肾毒性的研究,发现携带CYP3A5*1(表达CYP3A5)的肾移植患者比携带CYP3A5*3/*3(不表达CYP3A5)的肾移植患者具有更高获得CsA慢性肾毒性的风险。2008年Fukudo等[21]展开了对肝移植患者一年后CYP3A5基因型与肾功能不全发生率的相关性研究,结果却与上述研究相反,CYP3A5*1相对于CYP3A5*3/*3肾功能不全的发生率明显降低。出现这样的矛盾,有文献[22]分析:肾移植患者在肝脏中表达CYP3A5,导致了体内的免疫抑制剂代谢物浓度较高(归因于肾移植患者的CYP3A5基因型,肾脏基因由供肾者表达);而肝移植患者如果表达CYP3A5时,肝移植患者肾内的CYP3A5能把积聚在肾脏中的药物代谢,减少免疫抑制剂在肾脏中的积聚(归因于肾脏的CYP3A5基因型,肝脏由捐赠者表达)。有研究[23-24]表明CYP3A5的基因多态性与移植患者慢性肾毒性无相关性,如Klauke等[23]对106例心脏移植患者病例对照研究发现CYP3A5*3基因多态性与CsA的肾毒性间未见明显差异,谢宇等[24]对141例肾移植患者研究发现包括CYP3A5*3在内的4个CYP3A5 SNP位点均与肾毒性无显著性相关。另外,关于CYP3A4*1G表达个体差异与肾毒性发生的相关性研究结果也不一致。保泽庆[22]对400名肾移植病例对照研究发现,携带CYP3A4*lG/*lG基因的肾移植患者获得慢性肾毒性的风险是携带CYP3A4*1/*1或CYP3A4*l*lG基因型个体的2.914倍。而Wang等[25]对106例心脏移植患者病例对照研究发现CYP3A4*1G基因多态性与CsA的肾毒性间未见明显差异。本研究发现包括CYP3A4*1G在内的4个CYP3A4 SNP位点均与肾毒
性无显著性相关,与Wang等[25]的研究结果一致。
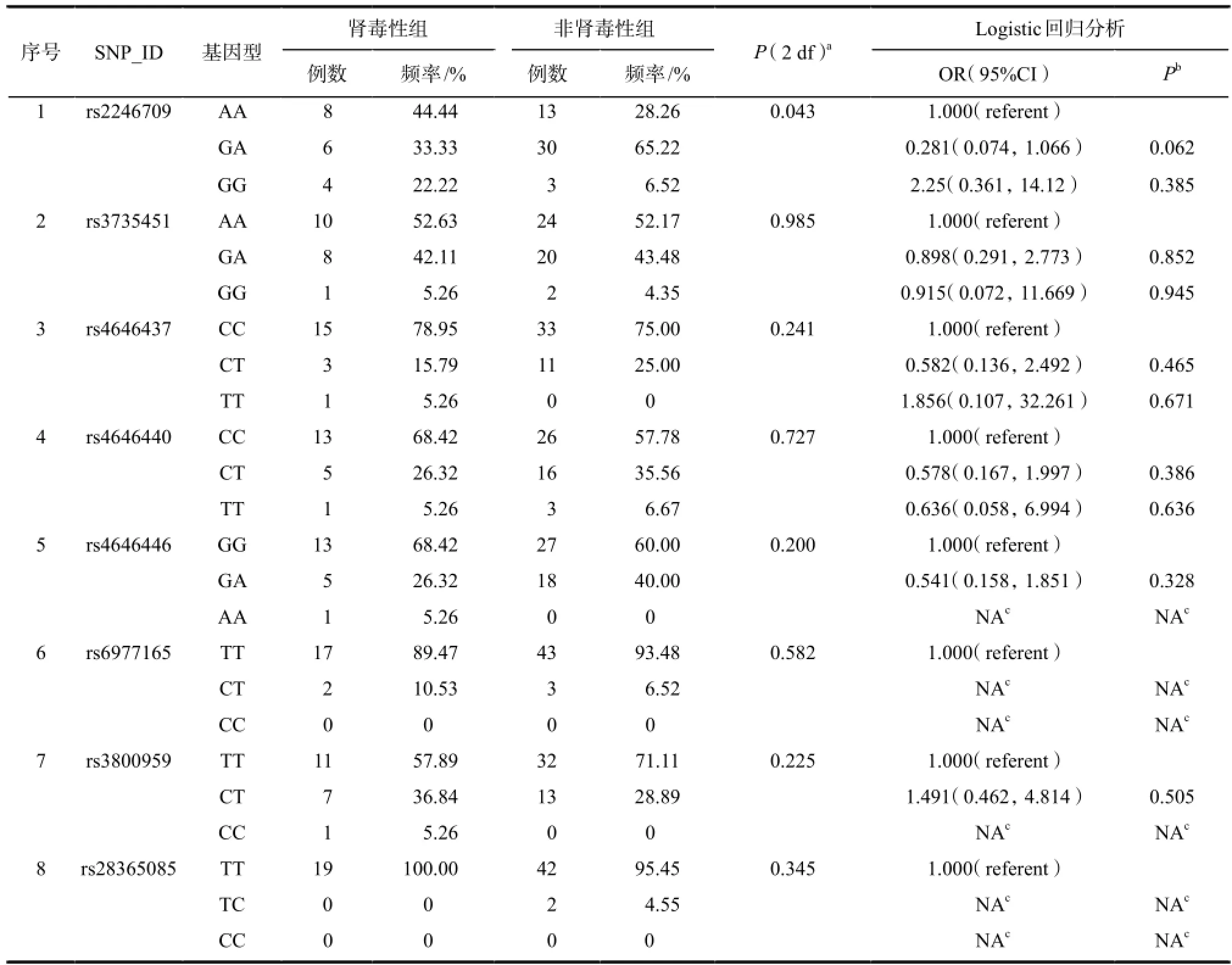
表3 CYP3A基因8个SNP在肾毒性组和非肾毒性组的基因型频率及其与CsA肾毒性的关联分析Tab 3 Analysis of genotype frequencies of 8 tag SNPs of CYP3A gene between nephrotoxicity group and non-nephrotoxicity group and their association with CsA nephrotoxicity
综上所述,本研究认为CYP3A4、CYP3A5基因多态性与CsA肾毒性的发生无显著性关联,但由于本研究样本量较小,且临床研究存在诸多混杂因素,研究结果仍需更大样本量的实验数据加以验证。同时CsA慢性肾毒性的发病机制复杂,其他可能对CsA肾毒性有影响的风险因素也不容忽视,此部分内容将在未来的研究中进一步完善。随着分子遗传学研究的不断深入,基因多态性在其中的确切发病机制将进一步被阐明,这将有助于心脏移植患者CsA药物治疗,从而实现个体化给药,为心脏移植患者肾毒性的防治和CsA的合理应用提供参考。
[1]高洁,郭俊英,孙秀颖,等.肾移植后患者的药学监护[J].中国药师,2005,8(2):139-140.
[2]Morales JM. Immunosuppressive treatment and progression of histologic lesions in kidney allografts[J]. Kidney Int Suppl, 2005(99): S124-S130.
[3]Naesens M, Kuypers DR, Sarwal M. Calcineurin inhibitor nephrotoxicity[J]. Clin J Am Soc Nephrol, 2009, 4(2): 481-508.
[4]Issa N, Kukla A, Ibrahim HN. Calcineurin inhibitor nephrotoxicity: a review and perspective of the evidence[J]. Am J Nephrol, 2013, 37(6): 602-612.
[5]Roby KA, Shaw LM. Effects of cyclosporine and its metabolites in the isolated perfused rat kidney[J]. J Am Soc Nephrol, 1993, 4(2): 168-177.
[6]Yatscoff RW, Rosano TG, Bowers LD. The clinical signi fi cance of cyclosporine metabolites[J]. Clin Biochem, 1991, 24(1): 23-35.
[7]Copeland KR, Thliveris JA, Yatscoff RW. Toxicity of cyclosporine metabolites[J]. Ther Drug Monit, 1990, 12(6): 525-532.
[8]Christians U, Kohlhaw K, Budniak J, et al. Ciclosporin metabolite pattern in blood and urine of liver graft recipients. I. Association of ciclosporin metabolites with nephrotoxicity[J]. Eur J Clin Pharmacol, 1991, 41(4): 285-290.
[9]保泽庆,石磊,赵树进.CYP3A基因多态性与环孢素A个体化用药的研究进展[J].中华器官移植杂志,2009,30(11):699-701.
[10]Hauser IA, Schaeffeler E, Gauer S, et al. ABCB1 genotype of the donor but not of the recipient is a major risk factor for cyclosporine-related nephrotoxicity after renal transplantation[J]. J Am Soc Nephrol, 2005, 16(5): 1501-1511.
[11]刘慧明,辛华雯,余爱荣,等.ABCB1 3435C >T基因多态性与肾移植术后环孢素肾毒性的相关性[J].中国药师,2012,15(6):751-755.
[12]石秀锦,魏国义,林阳,等. PXR基因多态性与心脏移植术后稳定期环孢素血药浓度的相关性[J]. 中国药物应用与监测,2014,11(3):152-155.
[13]Buetow KH, Edmonson M, MacDonald R, et al. High-throughput development and characterization of a genomewide collection of gene-based single nucleotide polymorphism markers by chipbased matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J]. Proc Natl Acad Sci USA, 2001, 98(2): 581-584.
[14]Akaike H. A new look at the statistical model identification[J]. IEEE Trans Automat Contr, 1974, 19: 716-723.
[15]Azarpira N, Aghdaie MH, Behzad-Behbahanie A, et al. Association between cyclosporine concentration and genetic polymorphisms of CYP3A5 and MDR1 during the early stage after renal transplantation[J]. Exp Clin Transplant, 2006, 4(1): 416-419.
[16]Du J, Yu L, Wang L, et al. Differences in CYP3A41G genotype distribution and haplotypes of CYP3A4, CYP3A5 and CYP3A7 in 3 Chinese populations[J]. Clin Chim Acta, 2007, 383(1-2): 172-174.
[17]Kuehl P, Zhang J, Lin Y, et al. Sequence diversity in CYP3A promoters and characterization of the genetic basis of polymorphic CYP3A5 expression[J]. Nat Genet, 2001, 27(4): 383-391.
[18]Roy JN, Lajoie J, Zijenah LS, et al. CYP3A5 genetic polymorphisms in different ethnic populations[J]. Drug Metab Dispos, 2005, 33(7): 884-887.
[19]Kuypers DR, Naesens M, de Jonge H, et al. Tacrolimus dose requirements and CYP3A5 genotype and the development of calcineurin inhibitor-associated nephrotoxicity in renal allograft recipients[J]. Ther Drug Monit, 2010, 32(4): 394-404.
[20]石磊,保泽庆,朱云松,等.CYP3A5基因多态性与肾移植后钙调神经蛋白抑制剂慢性肾毒性的相关性[J].中国组织工程研究与临床康复,2011,15(5):806-809.
[21]Fukudo M, Yano I, Yoshimura A, et al. Impact of MDR1 and CYP3A5 on the oral clearance of tacrolimus and tacrolimus-related renal dysfunction in adult living-donor liver transplant patients[J]. Pharmacogenet Genomics, 2008, 18(5): 413-423.
[22]保泽庆.钙调神经蛋白抑制剂的慢性肾毒性与CYP3A的相关性研究[D].广州:中山大学,2010.
[23]Klauke B, Wirth A, Zittermann A, et al. No association between single nucleotide polymorphisms and the development of nephrotoxicity after orthotopic heart transplantation[J]. J Heart Lung Transplant, 2008, 27(7): 741-745.
[24]谢宇,宋洪涛,王庆华,等.CYP3A5*3和MDR1 G2677T/A基因多态性对肾移植患者环孢素A血药浓度及疗效的影响[J].中国药学杂志,2011,46(20):1591-1596.
[25]Wang YY, Zhang M, Lu FM, et al. CYP3A4 genetic polymorphisms predict cyclosporine-related clinical events in Chinese renal transplant recipients[J]. Chin Med J (Engl), 2012, 125(23): 4233-4238.
Relationship between genetic polymorphisms of CYP3A and susceptibility to cyclosporine nephrotoxicity in Chinese heart transplant recipients
WEI Guo-yi1, SHI Xiu-jin1, ZHANG Hai-bo2, ZHONG Yu3, ZHOU Yang1, JIA Yi-xin2(1. Department of Pharmacy, Beijing Anzhen Hospital, Capital Medical University, Beijing 100029, China; 2. Department of Cardiac Surgery, Beijing Anzhen Hospital, Capital Medical University, Beijing 100029, China; 3. Bioyong Technologies Inc., Beijing 100080, China)
Objective:To investigate the relationship between genetic polymorphisms of CYP3A and susceptibility to cyclosporine nephrotoxicity in Chinese heart transplant recipients.Methods:Genetic polymorphisms of CYP3A in 66 heart transplant recipients with or without nephrotoxicity (20 : 46) after immunosuppressive therapy were analyzed by MassARRAY. The relationship between the genotypes of CYP3A single nucleotide polymorphism (SNP) and cyclosporine nephrotoxicity was analyzed by the univariate and non-conditional binary Logistic regression.Results:There was no significant difference in the frequency of alleles in 8 tags of CYP3A between nephrotoxicity group and non-nephrotoxicity group. Moreover, no statistically signi fi cant difference in CYP3A genotypes was found between two groups.Conclusion:There was no signi fi cant relativity between tags of CYP3A and CsA nephrotoxicity in the heart transplant recipients in this survey.
MassARRAY; Heart transplantation; Cyclosporine; Nephrotoxicity; CYP3A; Genetic polymorphism
R979.5
A
1672 – 8157(2014)04 – 0204 – 05
2013-12-16
2014-05-19)
魏国义,女,主任药师,研究方向:临床药学及药物基因组学。E-mail:weiguoyi2013@163.com
