自体脂肪干细胞移植对兔骨质疏松的影响
2014-02-10许益聘林和敏谭健韩芳刘广鹏叶信海
许益聘 林和敏 谭健 韩芳 刘广鹏 叶信海

【摘要】目的 观察自体脂肪干细胞(adipose-deRived stem cells, ASCs)移植对双侧卵巢切除术后骨质疏松(ovaRiectomy osteopoRosis, OVX-OP)兔的影响。方法 15 只成年新西兰雌性大白兔随机分为OVX模型组(A组,n=12)与假手术组(B组,n=3)。A组行双侧卵巢切除术,B组行假手术。术后6 个月,A、B组行双能量X线吸收测定(dual eneRgy X-Ray absoRptiometRy, DXA)检测骨密度(bone mineRal density, BMD),验证造模效果。取OP兔皮下脂肪,体外培养并成骨诱导ASCs,行细胞计数,碱性磷酸酶(alkaline phosphatase, ALP)、茜素红染色及骨钙素(osteocalcin, OCN)等检测。取第3 代成骨诱导ASCs复合藻酸钙凝胶(calcium alginate hydRogel, CAH),于OP模型兔左侧股骨远端注射ASCs-CAH,而右侧股骨注射单纯CAH材料作为治疗对照组。移植12 周后作骨密度测定、MicRo-CT检测及骨组织形态学分析。结果 与B组相比,A组股骨骨密度明显降低(P<0,05),证实OVX造模成功;体外成骨诱导培养的ASCs细胞计数与未诱导组相比,差异无统计学意义(P>0,05),而ALP、OCN检测及茜素红染色证实ASCs已分化为成骨细胞;自体细胞移植治疗12 周后,与对照组相比,细胞治疗组股骨远端骨密度、骨小梁数量、厚度、分离度及结构模型指数均明显改善(P<0,05)。组织学检测发现实验组骨小梁厚度增宽,植入的CAH材料已降解完全,而对照组骨小梁较纤细,CAH材料有部分残留。结论 ASCs自体移植对兔OP有一定的治疗效果,为OP治疗提供新思路。
【关键词】脂肪干细胞;骨质疏松;卵巢切除术;兔;藻酸钙凝胶
Effects of tRansplantation of autologous adipose-deRived stem cells on osteopoRosis in a Rabbit ovaRiectomy model Xu Yipin, Lin Hemin, Tan Jian, Han Fang, Liu Guangpeng, Ye Xinhai. DepaRtment of Plastic SuRgeRy, Shanghai Tenth People s Hospital, Tongji UniveRsity, Shanghai 200072, China
CoRResponding authoRs:Ye Xinhai, Email: dRyxh@189,cn;Liu Guangpeng, Email: guangpengliu@163,com
【AbstRact】Objective To obseRve the effects of tRansplantation of autologous adipose-deRived stem cells (ASCs) on osteopoRosis (OP) in a Rabbit ovaRiectomy (OVX) model.Methods A total of fifteen 6-month-old female New Zealand white Rabbits weRe Randomly divided into two gRoups: ovaRiectomy gRoup (gRoup A, n=12) and sham opeRation gRoup (gRoup B, n=3). All Rabbits weRe subjected to bilateRal ovaRiectomy in the gRoup A. Six months lateR, bone mineRal density (BMD) of gRoup A and gRoup B weRe measuRed by dual eneRgy X-Ray absoRptiometRy (DXA) to check the Result of OVX-OP. ASCs haRvested fRom adipose of OP Rabbits weRe cultuRed to be expanded and diffeRentiated in osteogenic medium in vitRo. Osteogenesis was evaluated by alizaRin Red staining, alkaline phosphatase (ALP) staining and quantitative assays of osteocalcin (OCN). Autologous osteo-induced ASCs weRe mixed in calcium alginate hydRogel (CAH) and then tRansplanted in the left distal femuRs, while CAH was tRansplanted in the Right distal femuRs of OP Rabbits. At 12 weeks afteR implantation, BMD, micRo-CT and histomoRphological analyses weRe peRfoRmed on these Rabbits.Results The BMD of femuRs in gRoup A Rabbits weRe obviously loweR than that of gRoup B Rabbits (P<0,05) at 6 months afteR OVX. CompaRed with contRol gRoup, ASCs cultuRed in osteo-induction medium had similaR pRolifeRation Rate as the non-induced cells, but displayed positive ALP and alizaRin Red staining and OCN contents. At 12 weeks afteR implantation, the cell-tReated femuRs displayed higheR BMD, bone tRabecula numbeR, tRabecula thickness and sepaRation than those of contRol gRoup, while the stRuctuRe model index and poRosity weRe loweR (P<0,05). Histological examination indicated that the tRabeculaR thickness incReased with complete CAH ResoRption in cell-tReated gRoup, while CAH Remained in contRol gRoup.Conclusions TRansplantation of autologous ASCs can help stRengthen osteopoRotic bone in OVX-OP Rabbits, pRoviding a novel appRoach to OP tReatment.
【Key woRds】Adipose-deRived stem cell; OsteopoRosis; OvaRiectomy; Rabbit; Calcium alginate hydRogel
骨质疏松(osteopoRosis,OP)是以骨量减少、骨的微观结构退化为特征的,致使骨的脆性增加以及易于发生骨折的一种全身性骨骼疾病[1]。随着社会老龄化的进展,OP的发病率正逐年提高。因此,研究OP的治疗方法具有重要的临床价值。干细胞技术和组织工程的兴起为OP治疗提供了一个新的思路。2001年Zuk等[2]于脂肪组织中首先发现了脂肪干细胞(adipose-deRived stem cells,ASCs),其在特定诱导条件下能向成骨细胞、脂肪细胞、心肌细胞、神经细胞等多向分化[3-5],并且具有分离方法简单、增殖快速等优点,因此对ASCs的研究日益受到重视[6-10]。李慧武等[11]报道,成骨诱导分化的ASCs可以修复骨缺损,但应用ASCs治疗骨质疏松的研究尚未见报道。因此在本研究中,笔者设想经体外成骨诱导分化的ASCs自体移植可改善骨质疏松的骨密度及骨组织微结构,并开展相关实验予以验证。
1 材料与方法
1,1 实验动物和分组
选用6 个月龄雌性新西兰白兔15 只,2,5~3,5 kg,由上海市第十人民医院实验动物中心提供。兔子适应性喂养1 周后随机(随机数字法)分为模型组(A组,n=12)和假手术组(B组,n=3)。
1,2 主要试剂和仪器
戊巴比妥钠粉剂、藻酸钠、BM-PuRple染色剂、地塞米松、β-磷酸甘油钠和L-2-磷酸抗坏血酸购于美国Sigma公司;骨钙素检测试剂盒(osteocalcin, OCN)购于美国BiosouRce公司;鼠抗人I型胶原酶购于美国WoRthington公司;低糖DMEM粉剂、胎牛血清均购于美国Gibco公司;胰蛋白酶购于上海思吉生物制品有限公司;硫酸钙购于上海国药公司;HEPES购于上海浩然生物技术有限公司。
双能X-线骨密度仪(XR-36 DEXA)(美国NoR-land公司);恒温CO2培养箱(美国FoRma公司);普通台式离心机(美国HeRaeus);倒置相差显微镜(美国Nikon公司);细胞计数仪(美国Beckman CoulteR公司);MicRo CT(瑞士Scanco公司)。
1,3 去势法建立兔OP模型
实验兔给予2 mL/kg戊巴比妥钠(质量分数2%)肌注麻醉后,在无菌条件下由正中切开腹腔,A组兔切除双侧卵巢,探查无活动性出血后关闭腹腔;B组为假手术组,即打开腹腔,找到双侧卵巢及输卵管后即关闭腹腔。手术后安置在饲养温度20~25 ℃,相对湿度为40%~50%环境中。术后6 个月,应用DXA对A组和B组兔双侧股骨远端(末端向上10 mm)测量BMD,以判断OP模型的建立是否成功。
1,4 OP兔的ASCs体外培养与成骨分化
ASCs的分离、培养与体外扩增采用文献[2]的方法。待OP模型建立成功后,在2 mL/kg戊巴比妥钠(质量分数2%)肌注麻醉下,剪取造模组兔子颈背部皮下脂肪组织约10 g,PBS液冲洗3次以去除肉眼可见的小血管和血液,剪碎至1 mm3,加入2倍体积的0,15% I型胶原酶,搅拌混匀消化。40 min后加入同体积的含10%胎牛血清的低糖DMEM中和胶原酶,1000 R/min离心8 min。去除上清,再用含10%胎牛血清的低糖DMEM(基础培养液)重悬细胞,200 目尼龙滤网过滤,细胞计数仪计数后以1×104/cm2的密度接种于25 cm2培养瓶中,放置于37 ℃、5% CO2二氧化碳培养箱中培养。24 h后首次换液,之后每2~3 d换液1 次。光学倒置相差显微镜下观察细胞生长状况,待细胞融合至瓶底80%以上利用0,25%胰蛋白酶以1∶3进行传代。在第3 代细胞中加入含有地塞米松(5 nmol/L)、β-磷酸甘油钠(10 mmol/L)和L-2-磷酸抗坏血酸(50 μmol/L)的DMEM培养液(成骨诱导液)进行体外诱导[3],同时以加入基础培养液作为阴性对照,每2~3 d换液1 次。成骨诱导第14 天分别利用BM-PuRple染色、茜素红染色检测碱性磷酸酶(alkaline phosphatase, ALP)表达和钙结节形成。另外,在成骨诱导第3、6、9、12、15、18 天将细胞消化离心,利用细胞计数仪进行计数,并采用ELISA法检测细胞培养液中OCN的含量。
1,5 自体ASCs-藻酸钙(adipose deRived stem cells-calcium alginate hydRogel, ASCs-CAH)复合物的制备与回植
2,282 g K2HPO4和0,790 g NaCl加入100 mL双蒸水中,pH 7,4,配制成0,1 mol/L NaCl贮存液。100 mL贮存液中加入1,5 g高纯度的藻酸钠,置于磁力搅拌器上,搅拌6 h至完全溶解。将配制好的溶液,过0,22 μm的滤器,变成无菌,4 ℃保存。
常规胰酶消化收集第3 代细胞,取200×106个细胞与藻酸钠混合,细胞终质量浓度为50×106个/mL,每毫升细胞-藻酸钠悬液与0,2 g硫酸钙混合,形成凝胶状复合物。取0,5 mL ASCs-CAH复合物注射至自体OP兔左侧股骨远端内侧髁部,右侧则注射单纯CAH作为对照组。
移植第12 周时,采用空气栓塞处死法处死实验动物,获取股骨标本,行MicRo CT检测,并利用仪器自带软件测定股骨远端BMD及骨组织形态计量学。标本经脱钙处理后,行HE染色观察组织学变化。
1,6 统计学方法
采用SPSS 13,0统计学软件处理,数据均以均数±标准差(x±s)表示,组间差异采用成组t检验进行判断。以P<0,05为组间差异具有统计学意义。
2 结果
2,1 造模骨密度测定
OVX术后6 个月,随机抽取造模组3只兔子(共6侧股骨),与假手术组相比,造模组股骨骨密度明显降低[(323,8±9,5) mg/cm2 vs. (312,8±6 ) mg/cm2],证实造模成功。
2,2 ASCs的体外增殖与成骨分化
本实验采文献[2,6]经典方法体外培养ASCs。光学倒置相差显微镜观察,初分离的ASCs接种4 h后,已开始贴壁生长(图1A)。第3 代ASCs仍保持成纤维细胞样形态和旺盛的增殖能力(图1B)。成骨诱导第14 天的细胞ALP染色可见蓝色颗粒(阳性)(图1D),而对照组为阴性(图1C);茜素红染色诱导组细胞可见红色钙化结节(阳性)(图1F),而对照孔无钙化现象(图1E)。经成骨诱导培养后,第3 代细胞保持良好的生长能力。细胞增殖曲线与对照组相比,两组间差异无统计学意义(P>0,05),见图2。OCN定量测定结果显示随着诱导培养时间的延长,OCN含量逐渐增高,从第12 天起诱导组显著高于对照组(P<0,05),图3。结合ALP与茜素红染色的结果,表明ASCs已诱导分化为成骨细胞。
2,3 MicRo-CT测定
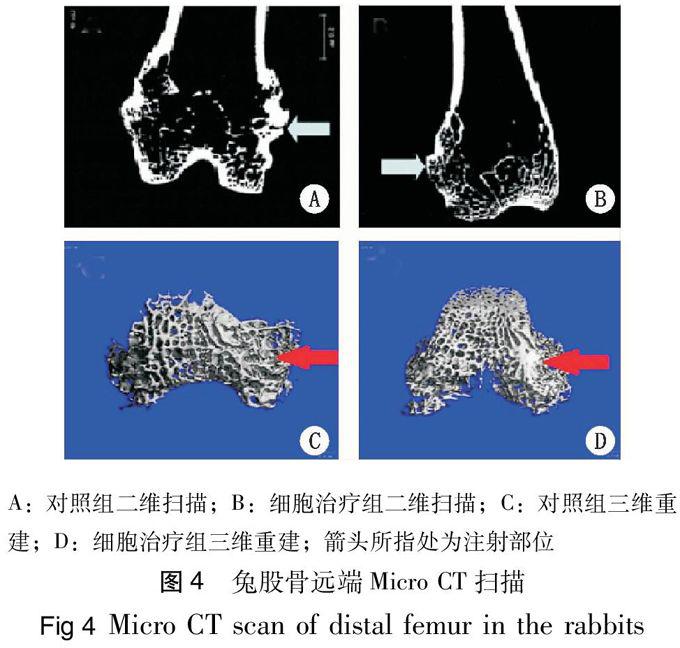
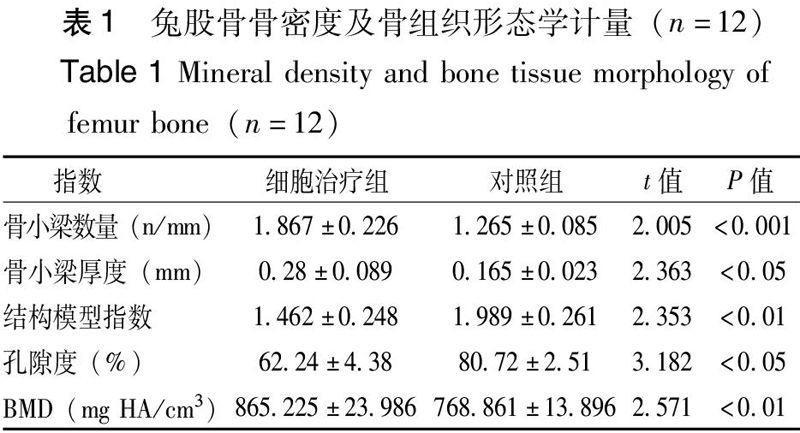
细胞移植12 周后,与对照组相比,细胞治疗组股骨远端骨密度、骨小梁的数量、厚度均显著升高(P<0,01),骨小梁的分离度和结构模型指数明显降低(P<0,05),见表1。二维扫描结果示,对照组骨小梁数量较少,排列紊乱,骨小梁间出现断裂,间距增大(图4A),而细胞治疗组骨小梁数量较多,排列较有序(图4B);三维重建图像示,对照组骨小梁较稀疏,骨小梁间距较大(图4C),而细胞治疗组的骨小梁较为致密(图4D)。
A:原代细胞接种第1天;B:P3代细胞接种第3天;C:未诱导组细胞BM-puRple染色;D:成骨诱导组BM-puRple染色;E:未诱导组细胞茜素红染色;F:成骨诱导组茜素红染色
2,4 骨组织微结构变化
ASCs移植治疗第12 周时,HE染色示细胞治疗组骨小梁数量较多,厚度较宽,髓腔内未见材料残留,而对照组骨小梁数量稀少,厚度较薄,可见CAH材料的残余成分(图5)。
3 讨论
去势法骨质疏松模型的建立是一个较为成熟的方法[12-17],一般兔在摘除双侧卵巢3 个月后即可建立骨质疏松模型。骨密度是反映骨量变化和骨质疏松程度的一个重要指标。李伟等[16]研究证实骨质疏松都伴有骨小梁的吸收,随之引起股骨疏松。因此股骨骨密度可以反映全身的骨质变化情况。本实验在切除双侧卵巢后6 个月发现,造模组股骨骨密度明显低于假手术组,两组间差异有统计学意义(P<0,05),与上述文献报道的结果一致,证实了利用去势法建立兔骨质疏松模型的可行性。
干细胞与组织工程技术的兴起为骨质疏松的治疗提供一种思路。2001 年Zuk[2]于脂肪组织中发现了具有贴壁生长特性的间质细胞,通过对其表面抗原与多项分化能力进行鉴定,证实从脂肪组织中获得的贴壁细胞即为ASCs。ASCs具有细胞来源广泛、分离培养简单、低免疫原性、多种分化潜能等。本实验采用该经典方法,从OP造模的兔皮下脂肪组织中获得贴壁生长的ASCs,经体外成骨诱导培养后仍能保持活跃的增殖能力,同时对其进行成骨诱导分化鉴定,证实ASCs能够向成骨细胞定向分化。
自体ASCs移植治疗12 周后,与对照组相比,细胞治疗组股骨远端骨密度及骨组织形态学各项指标均明显改善。组织学检测发现,细胞治疗组骨小梁厚度较对照组增宽,植入的CAH已降解完全,而对照组骨小梁较纤细,CAH仍有部分残留。本实验表明ASCs可促进骨矿化,增加骨量,并促进新生骨小梁形成,从而达到提高骨密度、改善骨组织微结构的目的,表明ASCs-CAH移植对OP有一定的治疗作用。
作为自体ASCs的载体,CAH是一种可注射的、具有良好的生物相容性和可降解性的的支架材料[18],可为成骨细胞提供三维空间结构。而且在组织工程技术构建骨组织过程中,可提供骨形成过程中所必需的钙离子,有利于新骨形成。本实验发现,ASCs-CAH移植12 周后,与对照组相比,细胞治疗组的股骨骨密度、骨组织微结构均明显改善且材料降解吸收加快,表明CAH具有良好的细胞相容性,是比较理想的细胞载体。
综上所述,本实验表明OP造模后的兔ASCs能够向成骨细胞诱导分化,ASCs-CAH移植对OP具有一定的治疗作用,能够促进新骨形成,增加骨密度,改善骨组织微结构,从而为利用组织工程技术治疗OP提供了实验依据。
参考文献
[1]Lane JM, Riley EH, WiRganowicz PZ. OsteopoRosis: diagnosis and tReatment [J]. InstR CouRse Lect,1997,46:445-458.
[2] Zuk PA, Zhu M, Mizuno H, et al. Multilineage cells fRom human adipose tissue: implications foR cell-based theRapies[J].Tissue Eng,2001,7(2):211-228.
[3] 郝伟,胡蕴玉,魏义勇,等. 脂肪干细胞/I型胶原凝胶复合体的构建及其体内外成骨分化研究[J].中华实验外科杂志,2007,24(6):659-661.
[4] Rangappa S, Chen F, Lee EH, et al. TRansfoRmation of adult mesenchymal stem cells isolated fRom the fatty tissue into caRdiomyocytes[J]. Ann ThoRac SuRg,2003,75(3):775-779.
[5] SaffoRd KM, Hicok KC, SaffoRd SD, et al. NeuRogenic diffeRentiation of muRine and human adipose-deRived stRomal cells[J]. Biochem Biophys Res Commun,2002,294(2):371-379.
[6] De UgaRte DA, MoRizono K, ElbaRbaRy A, et al. CompaRison of multi-lineage cells fRom human adipose tissue and bone maRRow[J]. Cells Tissues ORgans,2003,174(3):101-109.
[7] Yang F, Bai XJ, Hu D, et al. Effect of tRiptolide on secRetion of in?ammatoRy cellulaR factoRs TNF-α and IL-8 in peRitoneal macRophages of mice activated by lipopolysacchaRide[J]. WoRld J EmeRg Med, 2010, 1(1): 70-74.
[8] 魏义勇,胡蕴玉,郝伟,等. 重组人骨形态发生蛋白-2诱导脂肪成体干细胞成异位软骨的研究[J].中华实验外科杂志,2006,23(5):625-626.
[9] 雷永红,付小兵,盛志勇,等. 诱导脂肪干细胞向表皮细胞表型的转分化研究[J].中华实验外科杂志,2006,23(12):1536-1538.
[10]原泉,程扬,李建军,等. 胰岛素样生长因子-1基因转染脂肪间充质干细胞向软骨细胞分化的研究[J].中华实验外科杂志,2008,25(4):483-484.
[11] 李慧武,戴尅戎,汤亭亭,等. 人骨形态发生蛋白-2基因转染人脂肪源性基质细胞的异位成骨作用[J].中华实验外科杂志,2005,22(5):588-590.
[12] Tomkinson A, Reeve J, Shaw RW, et al. The death of osteocytes via apoptosis accompanies estRogen withdRawal in human bone[J].J Clin EndocRinol Metab,1997,82(9):3128-3135.
[13] SchaffleR A, BuchleR C. Concise Review: adipose tissue-deRived stRomal cells—basic and clinical implications foR novel ceil-based theRapies[J]. Stem Cells,2007,25(4):818-827.
[14] Zhu F, Guo GH, Chen W, et al. Effects of bone maRRow-deRived mesenchymal stemcells engRaftment on vasculaR endothelial cell gRowth factoR in lung tissue and plasma at eaRly stage of smoke inhalation injuRy[J]. WoRld J EmeRg Med, 2010, 1(3): 224-228.
[15] Yanez R, Lamana ML, GaRcia-CastRo J, et a1. Adipose tissue-deRived mesenchymal stem cells have in vivo immunosuppRessive pRopeRties applicable foR the contRol of the gRaft-veRsus-host disease[J]. Stem Cells,2006,24(11):2582-2591.
[16] 李伟,赵光锋,喻任,等. 转移生长因子-β1、碱性成纤维细胞生长因子、骨形态发生蛋白-2在大鼠骨质疏松骨折愈合骨痂中的表达[J].中华急诊医学杂志,2003,12(8):530-532.
[17] 汪学红,姜婷,夏家红,等. 密骨方对去势大鼠骨质疏松后骨折愈合的影响[J].中华实验外科杂志,2010,27(9):1328-1330.
[18] Kaplan FS, Hahn GV, Zasloff MA. HeteRotopic ossification: two RaRe foRms and what they can teach us[J].Am Acad ORthop SuRg,1994,2(5):288-296.
(收稿日期:2013-06-21)
(本文编辑:邵菊芳)
DOI:10,3760/cma,j,issn,1671-0282,2014,01,014
基金项目:国家自然科学基金(81171475,31271027)
作者单位:200072 上海,上海市第十人民医院整形外科(许益聘、谭健、韩芳、刘广鹏、叶信海);温州医科大学附属眼视光医院整形外科(林和敏)
通信作者:叶信海,Email:dRyxh@189,cn;刘广鹏,Email:guangpengliu@163,com
P56-60
