转录因子GATA—3和T—bet的表达失衡在复苏后急性肺损伤中的作用
2014-02-10顾伟李春盛殷文朋张健侯晓敏张达
顾伟 李春盛 殷文朋 张健 侯晓敏 张达

【摘要】目的 探讨转录因子GATA-3和T-bet的表达失衡是否参与了猪心肺复苏后的急性肺损伤机制。方法 26头猪随机(随机数字法)分为假手术组(SHAM)(6只)、复苏12 h组和复苏24 h组(各10只)。建立室颤8 min小型猪模型;用流式细胞术检测猪外周血淋巴细胞(PBL)中CD3+、CD4+和CD8+淋巴细胞亚群的分布;采用酶联免疫吸附(ELISA)方法检测血浆中白细胞介素-4(IL-4),肿瘤坏死因子α (TNF-α)和干扰素γ(INF-γ)的含量;采用Western-blot法检测肺组织GATA-3和T-bet的蛋白表达;用实时荧光PCR法定量肺组织GATA-3和T-bet mRNA水平。结果 复苏组小猪发生严重肺组织细胞损伤,在复苏后的12 h和24 h,猪血清中CD4+细胞的比例(28,4±2,3)%,(24,1±1,6)%明显低于假手术组(48,4±2,9)%,(51,1±5,4)%;CD4+/CD8+(1,7±0,9),(1,5±1,0)也较假手术组明显减低(2,5±1,3),(2,7±1,1)(P<0,05);IL-4和TNF-α 水平在2~12 h逐渐升高(P<0,01); INF-γ水平和INF-γ /IL-4却在2~12 h逐渐降低。复苏组的肺组织GATA-3的蛋白表达较假手术组分别在12 h、24 h明显升高,T-bet的蛋白表达和T-bet/GATA-3则分别在12 h、24 h明显降低。复苏组的肺组织GATA-3和T-bet的mRNA水平较假手术组分别在12 h、24 h明显升高和减低。结论 转录因子GATA-3和T-bet的表达失衡导致的肺免疫功能障碍可能参与了心肺复苏后急性肺组织损伤的过程。
【关键词】心肺复苏;急性肺损伤;Th1/Th2失衡;免疫功能障碍;GATA-3;T-bet
Role of imbalance between transcription factors GATA-3 and T-bet expressions in the pathogenesis of acute lung injury after resuscitation Gu Wei,Li Chunsheng,Yin Wenpeng,Zhang Jian,Hou Xiaomin,Zhang Da. Department of Emergency Medicine, Beijing Chaoyang Hospital, Capital Medical University, Beijing 100020, China
Corresponding author: Li Chunsheng, Email: banditgu@hotmail,com
【Abstract】Objective To study the role of imbalance between transcription factors GATA-3 and T-bet expressions in causing acute lung injury after resuscitation in cardiac arrest model of swine.Methods After swine model of electrically induced cardiac arrest was established for 8 minutes, animals were resuscitated to get restoration of spontaneous circulation (ROSC). The swine with ROSC were randomly assigned to be sacrificed at 12 and 24 h after ROSC (n=8 in each group). CD3+,CD4+ and CD8+ lymphocyte subsets were determined by flow cytometry, and the levels of serum IL-4,TNF-α,and IFN-γ were measured by using ELLSA. The protein levels and expressions of GATA-3/T-bet mRNA were detected in lung tissue by western blotting and quantitative real-time PCR device, respectively.Results Pulmonary function was significantly impaired after ROSC. CD4+ lymphocyte subsets(28,4±2,3)%,(24,1±1,6)%and CD4+/CD8+ (1,7±0,9),(1,5±1,0)were significantly lower in the post-ROSC group compared with the sham-operated group(48,4±2,9)%,(51,1±5,4)%(2,5±1,3),(2,7±1,1) (P<0,05) at 12 h and 24 h after ROSC. The levels of serum IL-4 and TNF-α were markedly increased, while IFN-γ and IFN-γ/IL-4 were significantly decreased in the post-ROSC group compared with the sham-operated group (P<0,05) at 2-12 h after ROSC. Protein level and expression of GATA-3 mRNA in lung tissue were markedly increased, while those of T-bet were significantly reduced in the post-ROSC group compared with the sham-operated group (P<0,05) at 12 and 24 h after ROSC.Conclusions The lung immune dysfunction induced by imbalance between transcription factors GATA-3 mRNA and T-bet mRNA expressions may complicate in the process of post-resuscitation lung injury in a porcine model of cardiac arrest.
【Key words】Cardiopulmonary resuscitation;Acute lung injury;Th1/Th2 imbalance; Immune dysfunction;GATA-3;T-bet
心搏骤停后,全身性缺血导致各组织器官均出现严重的缺血缺氧,并伴有严重酸中毒,从而导致组织细胞的能量代谢障碍、蛋白变性、细胞损伤甚至死亡[1]。当炎性反应过度,炎症介质产生异常,机体反应过激、失控,这种过度的全身炎症反应可累及到肺引起急性肺损伤(acute lung injury,ALI)[2],进而发展为急性呼吸窘迫综合征[3]。目前考虑心肺复苏(CPR)后的ALI主要与氧自由基、缺血-再灌注和凋亡等有一定的关系[4-6]。
辅助性T细胞主要有T淋巴细胞亚群l和2(Thl/Th2),Th1细胞产生γ-干扰素、IL-12和肿瘤坏死因子β;Th2细胞产生IL-4、IL-5、IL-13等细胞因子。前者与细胞免疫相关,而后者则参与体液免疫。在正常情况下,机体Thl/Th2细胞处于动态平衡状态,维持机体正常的免疫功能[7]。转录因子T-bet是Thl细胞特异的转录因子,参与Thl的分化和转化。而GATA-3则在Th2细胞分化过程中起关键作用,它是所有Th2型细胞因子转录所必需的,因而转录因子T-bet和GATA-3最终决定了Thl与Th2的分化方向。心搏骤停一旦发生,可理解成一种超常的应激反应,必将引起转录因子T-bet和GATA-3的失衡,从而导致Th1/Th2 的失衡, 出现Th2 型细胞因子发生瀑布式级联反应, 引发和促进ARDS及多器官功能衰竭[8]。目前,有关T-bet和GATA-3的失衡进一步导致的肺免疫功能障碍在CPR后ALI中的作用在国内外并没有报道。
本研究主要是建立小型猪室颤8 min模型,复苏成功后通过检测小型猪的血清中IL-4、TNF-α和INF-γ的水平和肺组織的T-bet和GATA-3蛋白表达以及mRNA水平,从而证实心肺复苏后肺组织细胞出现由转录因子GATA-3和T-bet介导的Th1/ Th2 失衡导致的免疫功能障碍,其机制可能是导致复苏后ALI的主要机制之一。
1 材料与方法
1,1 实验试剂与设备
GATA-3抗体购自ab113519; Abcam Biotechnology, UK;T-bet抗体购自sc-21003; Santa Cruz Biotechnology, USA。FITC 标记的CD8单克隆抗体(Mouse anti pig,IgG1)、PE/cy5标记的CD4单克隆抗体(Mouse anti pig,IgG2b)购自尚柏生物技术有限公司,IL-4(6R019),TNF-α(6R071)和INF-γ(6R082)试剂购自Santa Cruz 公司,实时荧光定量PCR检测试剂盒购自杭州博日科技有限公司,Q-CPRTMHeartStart MRx监护仪/除颤器(荷兰飞利浦医疗系统公司提供),GY-600A医用程控刺激仪购自中国开封华南仪器有限公司,HP M1165多功能监测仪(美国惠普公司提供),Line-gene 荧光定量PCR检测系统(杭州博日科技有限公司提供)。
1,2 实验动物分组
实验用近交系五指山小型猪(WZSP Inbred s Minipig)26头,雄性,月龄为10~12个月,体质量为(30±2)kg,由中国农业科学院畜牧兽医研究所提供。实验动物随机(随机数字法)分为假手术组(6头),复苏12 h组(10头)和复苏24 h组(10头)。
1,3 室颤动物模型的制备
术前晚上禁食,自由饮水。肌注氯胺酮(0,5 mg/kg),联合耳缘静脉注射丙泊酚2 mg/kg诱导麻醉,瑞芬太尼注射液首剂0,25 mg静脉推注,以后以30~50 μg/(kg·h)连续静脉滴注以镇痛。麻醉维持阶段,首剂使用3%戊巴比妥钠30 mg/(kg·h)静脉推注,以后以8 mg/(kg·h)静脉推注。气管切开后置入直径6,5 F的气管插管,连接CO2SMOplus呼吸监护仪及呼吸机,吸入氧体积分数为21%,通气频率为12次/min,潮气量设为15 mL/kg,然后调整呼吸机参数,使呼吸末PCO2保持在35~40 mmHg(1 mmHg=0,133 kPa)。备皮后连接心电监护,监测肢体导联心电图。将一个直径7F的血管造影用鞘管置入右侧股静脉,并放置双极临时起搏电极直至右心室[9]。
将心室内电极导线外接医用程控刺激仪GY-600A,选择食道输出S1S2(300/200 ms)模式,8∶ 1比例,步长-10 ms连续电刺激,直到出现室颤。室颤的判断标准是动脉血压迅速下降,心电图显示VF波形[10]。实验动物随机分为三组:12 h复苏组(10头)和24 h复苏组(10头):人工心外按压频率为100次/min,每30次按压后暂停5 s,使用空气以人工气囊进行通气2次,TV 300 mL,即6次/min。使用Q-CPRTM技术监测CPR质量,先按压2 min,如果没有ROSC,则开始电击除颤,除颤能量为150 J(双相指数截断波),如果没有ROSC,进行下一次复苏周期,在试验中不使用任何复苏药物;假手术组(SHAM)(6头):进行同样的步骤包括麻醉,呼吸机辅助通气和导管的留置,但不除颤不按压。ROSC后给予持续呼吸机机械通气,分别在复苏前,后即刻,0,5、2、6 h留取动脉血;在复苏前,复苏后0,5、2、6、12、24 h留取静脉血。ROSC后复苏两组分别在12、24 h将动物注射过量氯化钾处死。将猪左侧颈外静脉剪开,经右侧颈总动脉插管匀速灌注生理盐水至血液变清,开胸取肺,左右肺离断,取右肺中叶分别置于10%中性缓冲福尔马林中固定和-80 ℃液氮保存。
ROSC标准:主动脉收缩压在50 mmHg以上,并且持续时间超过10 min;如果30 min未达到ROSC,则认为复苏失败,动物死亡[11]。
1,4 血气分析和组织学
检测复苏前,复苏后0、0,5、2、6 h的动脉血气分析。肺组织标本常规切片,分别在光镜和透射电镜HITACHI H-7650型(北京神经外科研究所电镜室)下观察。
1,5 流式细胞术检测CD3+、CD4+、CD8+淋巴细胞亚群的分布
分别取复苏后12 h和24 h的抗凝血4 mL,在6 h之内分离PBL,取至少2×106个PBL 加入1,5 mL离心管中,用1 mL 荧光洗液(含2% NBS的0,15 mol/L PBS,pH 7,4)洗涤2次,洗涤时1000 r/min 离心5 min,弃上清液,用200 μL荧光洗液重悬细胞。将每个样品的PBL进行CD3+、CD4+和CD8+淋巴细胞亚群的检测:向每个样品的其中一管细胞中加入FITC 标记的CD3 单抗2 μL和PE/cy5 标记的CD4和CD8单抗2 μL,混匀后4 ℃避光放置30 min,用1 mL荧光洗液洗涤2次,管底细胞用500 μL 荧光保存液(含2%葡萄糖、1%甲醛和0,1% NaN3的0,15 mol/L PBS,pH 7,4)重悬,分析至少5000个单个核细胞群,确定CD3+、CD4+、CD8+的百分比,计算CD4+/CD8+。
1,6 ELISA 法检测血清IL-4、TNF-α 和INF-γ的浓度
取2 mL静脉血,3000 r/min高速离心,取血清25 μL加入相应的样品孔中,每孔加入25 μL Biotin Anti 猪IL-4、TNF-α 和INF-γ,轻轻混匀30 s,室温温育0,5 h,洗板,每孔加入50 μL HRP,再次轻轻混匀30 s,室温温育30 min,再次洗板,每孔加入50 μL显色液,轻轻混匀10 s,室温温育15 min,每孔加入50 μL终止液,轻轻混匀30 s,30 min内在450 nm处读吸光度A值,根据吸光度A值在标准曲线上读出细胞因子的浓度。
1,7 Western-blot法检测肺组织 GATA-3和T-bet的蛋白表达
配12%分离胶,并用dd H2O封胶,配 4%的浓缩胶灌胶,开始电泳。浓缩胶电泳电压为80 V,分离胶电泳电压为120 V。转膜完毕后用TBST配制5%脱脂奶粉,将膜浸入后,室温放置4 h。用1%的封闭液将一抗GATA-3和T-bet分别按1∶ 200和1∶ 500稀释,将膜与一抗一起孵育,4 ℃过夜。二抗孵育结束,TBS-T洗3次,每次5 min。使用ECL化学发光显色液,将显色后的膜或底片照相,并用LabWorks软件对图像进行灰度分析。
1,8 实时荧光定量PCR法检测肺组织GATA-3和T-bet mRNA水平
利用Primer express 3,0软件及oligo 6等生物软件分析。按GATA-3和T-bet基因序列设计并合成引物,引物序列为:T-bet(118 bp):上游引物:5 -ACAAACCCGATATGGCTGA- GA-3 ,下游引物:5 -CCTGCTTGCTTCTCCTGTTC-3 ,GATA-3(240 bp):上游引物5 -T- GCGGGCTCTACCACAA
AAT-3 ,下游引物:5 -TCGGTTTCTGGTCTGGAT
GC-3 ,GAPDH:上游引物:5 -CCATCACTGCC
ACTCAGAAGACT-3 ,下游引物:5 - GTCAGATC
CACAACGGATACATTG -3 。反应体系: Mix 5 μL, cDNA 2 μL,上/下游引物(10 pmol/L)1 μL,2XSYBR Mix (with 4 mmol Mg2+) 25 μL,反應总体积为10 μL,反应条件为:95 ℃预变性2 min,95 ℃变性20 s, 65 ℃退火45 s,72 ℃延伸30 s,扩增45个循环,60 ℃延伸结束时采集荧光信号,并作溶解曲线检测引物特异性。将各样本Ct值代入公式基因表达量 = 2-ΔΔCt计算,其中ΔΔCt = [目的基因的平均Ct值(样本组)-管家基因的平均Ct值(样本组)]-[目的基因的平均Ct值(校正组)-管家基因的平均Ct值(校正组)]。
1,9 统计学方法
应用SPSS 17,0统计软件进行数据处理, 计量资料以均数±标准差(x±s)表示,多组均数比较用方差分析,组间两两比较采用LSD-t检验和相关性分析,以P<0,05为差异具有统计学意义。
2 结果
复苏12 h组和24 h组分别各有2头动物复苏失败死亡,死亡的4头动物被排除而不纳入统计分析。
2,1 动脉血气分析
SHAM组和CPR组的血气分析指标在心搏骤停前差异无统计学意义。复苏后各时相组pH值较SHAM组明显降低(P<0,05),而PaCO2虽然较SHAM组有所升高,但差异无统计学意义(P>0,05),在复苏后即刻和0,5 h,CPR组PaO2较SHAM组明显降低(P<0,05),复苏后其余各时相组与SHAM组相比,差异无统计学意义。见表1。
2,2 组织形态学
光镜下SHAM组无明显病理改变(图1A);CPR组光镜下可见肺泡腔狭窄,肺泡壁增厚,肺泡壁毛细血管扩张,肺泡内有明显出血,并有水肿液渗出,肺泡腔内有脱落上皮细胞和中性粒细胞浸润( 图1B)。电镜显示,SHAM组肺内毛细血管内皮细胞无肿胀,上皮细胞完整( 图1C);CPR组肺内毛细血管内皮细胞肿胀,上皮细胞坏死崩解(图1D)。
2,3 CD3+、CD4+淋巴细胞亚群的分布
流式细胞仪检测结果显示,在复苏后的12 h和24 h,猪PBL中CD3+细胞(32,8±4,1)%, (21,1±5,7)%和CD4+细胞的比例(28,4±2,3)%, (24,1±1,6)%分别明显低于SHAM组(65,2±8,5)%, (63,9±9,1)%和(48,4±2,9)%, (51,1±5,4)%, CD4+/CD8+(1,7±0,9), (1,5±1,0)也较SHAM组降低(2,5±1,3), (2,7±1,1) (P<0,05)。见表2。
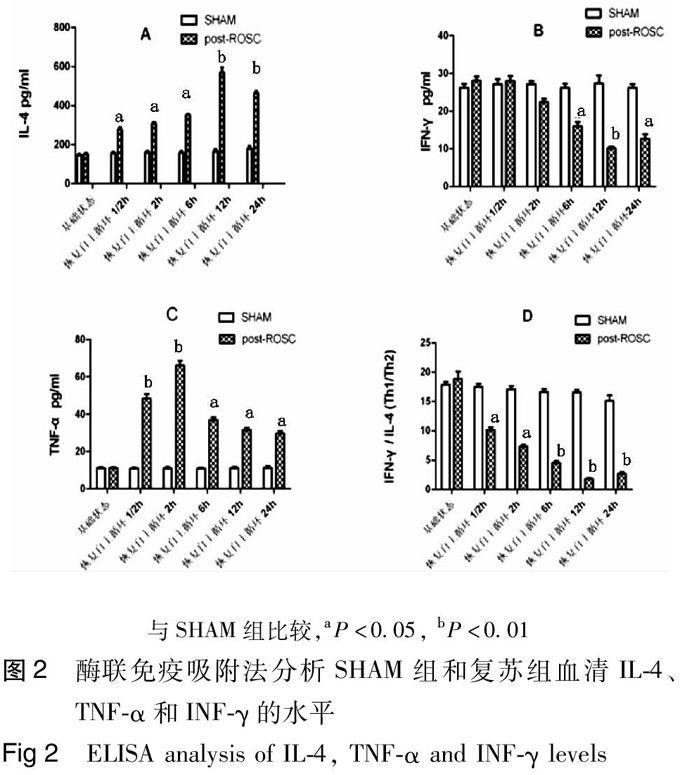
2,4 血清IL-4a、TNF-α和INF-γ的水平
如图2所示,与SHAM组比较,CPR组的IL-4水平在2 h开始明显升高,随复苏后时间的延长而呈增加趋势,在12 h达到高峰,在24 h开始下降;而INF-γ水平则在2 h开始明显降低,在12 h达到最低,并且INF-γ/IL-4 比值也在2 h开始明显下降。此外,TNF-α水平则在复苏后0,5 h就开始明显升高,在2 h达到高峰,然后逐渐降低。
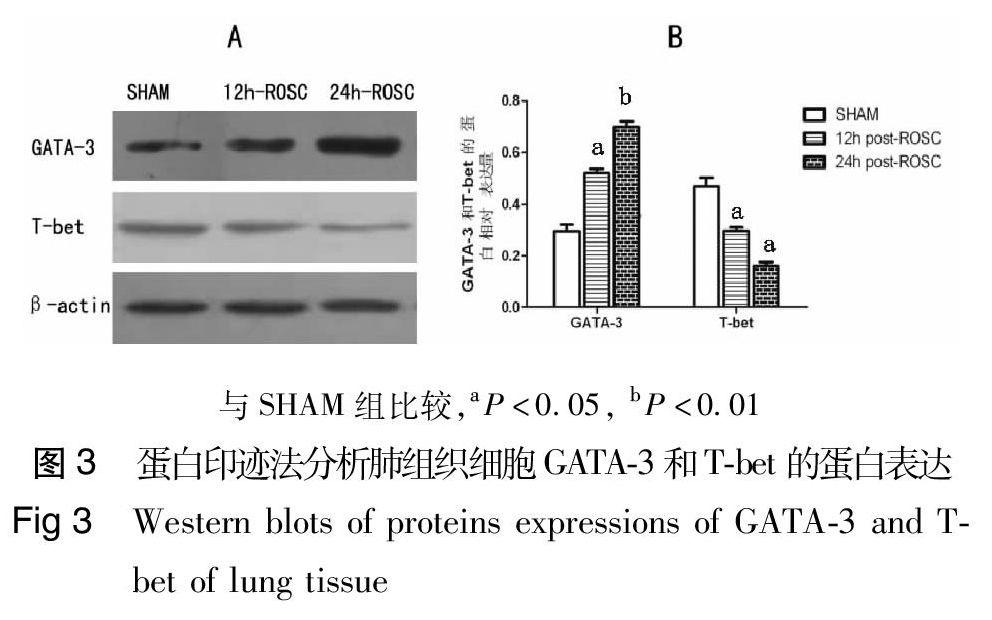
2,5 肺组织GATA-3和T-bet的蛋白表达
CPR组(12 h和24 h组)和SHAM组的肺组织GATA-3蛋白表达分别是0,52±0,07,0,69±0,04和0,29±0,06,CPR组比SHAM组明显增加;而T-bet的蛋白表达分别是0,30±0,02,0,16±0,04和0,47±0,09,CPR组比SHAM组明显减少(图3)。
2,6 肺组织GATA-3和T-bet的mRNA水平
CPR组的肺组织GATA-3的mRNA水平在分别为2,54±0,13, 3,42±0,15和0,81±0,06,较SHAM组明显升高,而T-bet的mRNA水平分别为0,56±0,05, 0,29±0,15和0,91±0,04,较SHAM组明显减低(图4)。
3 讨论
本实验发现在复苏后的早期(6 h内),单从血气分析来看,CPR组的小猪短期内肺功能似乎改变并不严重,但在光镜和电镜下观察较SHAM组不论是肺脏的组织结构还是细胞超微结构都有着较为明显的损伤。复苏后肺组织细胞的病理改变不仅可见肺组织细胞的水肿、渗血,同时也可见I型肺泡上皮和Ⅱ型肺泡上皮细胞及肺泡隔等功能性结构的损伤。这主要是由于在自主循环恢复以后,缺血后代谢产物使微血管通透性增加、液体外渗、血小板聚集、阻滞微循环导致血流分布异常、组织缺血-再灌注损伤、血管收缩和舒张异常, 导致血管扩张, 加剧液体外渗, 血流分布紊乱, 引起肺灌注失常,肺表面活性物质减少,毛细血管通透性增加,血浆蛋白渗出,进而导致急性肺损伤[12]。
T细胞亚群CD4+、CD8+均是T细胞重要的表面抗原标志,作为免疫效应细胞在直接杀伤靶细胞进行免疫调节等方面发挥着重要的功能。CD4+细胞为辅助T淋巴细胞,在细胞免疫的效应阶段和变态反应中能产生多种淋巴因子,导致炎症反应,从而加速消除抗原物质。CD8+细胞可对靶细胞产生细胞介导的细胞毒作用,对CD4+细胞具有调节性抑制作用,CD4+/CD8+比值可反映机体的免疫功能状态,CD4+/CD8+比值降低反映机体细胞免疫功能的抑制[13]。在本研究中發现,CPR组的CD4+细胞亚群和CD4+/CD8+比值都较SHAM组明显降低,这可能与抗炎细胞因子的升高,抑制淋巴细胞的增殖以及诱导T淋巴细胞发生FAS和FAS-L的结合,通过Caspase级联反应,导致T淋巴细胞彼此杀伤或直接“自杀”,使T细胞总数和活化的T细胞数量下降[14]。这反映在心肺复苏后机体存在严重的免疫失调和抑制,这种过度的免疫失调和全身炎症反应往往可造成多器官功能障碍,而肺往往是最先受累的器官。
Thl/Th2分化失衡涉及多种疾病,如肿瘤、自身免疫性疾病、变态反应性疾病、内分泌疾病、感染性疾病、移植排斥反应等。本实验证实TNF-α在CPR后0,5 h即大量出现,并持续升高,2~4 h达高峰,6 h有所下降,但仍在较高水平。这说明在CPR后,机体启动了炎症反应系统,ROSC后产生的代谢产物可引起促炎、抗炎反应失去平衡,导致Thl细胞因子(INF-γ)表达降低及Th2细胞因子(IL-4)表达上升。INF-γ主要促进Th0细胞分化为Th1细胞,抑制Th2细胞增殖;IL-4主要促进Th0细胞向Th2细胞分化,抑制Th0细胞向Th1细胞分化,继而引起Th1向Th2大量分化,促成了Th细胞向Th2方向极化,从而导致Th1和Th2的失衡[15],引起免疫抑制,可进一步发展为免疫失调[7],导致发生MODS。笔者认为复苏后的早期,机体经历了缺血-再灌注过程。复苏后全身各脏器的再灌注损伤产生大量氧自由基、乳酸、花生四烯酸的代谢产物等炎性介质,随血流到达肺组织细胞,从而造成再灌注损伤,这些炎性细胞因子相互影响,进一步引起炎症反应失控,加重肺组织的免疫功能障碍。
GATA-3是属于GATA转录因子家族的一种细胞谱系特异性因子,是Th2细胞的特异性转录因子,参与几乎所有Th2类细胞因子的转录;并且在Th2类细胞因子的基因的启动子区存在GATA-3的结合位点,对Th2细胞的分化起主导作用[16]。而T-bet 则是属于T-box家族的一种新型转录因子,可以调节Th0向Th1发育、正调控Th1类细胞因子的表达,它的主要作用是抑制GATA-3表达,进而阻止Th1细胞向Th2分化[17,18]。此外,T-bet也是INF-γ基因强有力的转录激活剂。T-bet和GATA-3的共同作用引起Th1/Th2两类细胞因子在表达水平上的差异,是决定Thl/Th2极性分化的决定性因素,而且两者具有交互抑制作用,T-bet正调节Thl型细胞因子。GATA-3正调节Th2型细胞因子。本实验发现小型猪CPR组的肺组织GATA-3和T-bet的蛋白表达和mRNA水平均较SHAM组分别有着明显的升高和降低,GATA-3的高表达和T-bet的低表达,会诱导IL-4的升高和INF-γ的降低,从而使Th1细胞向Th2细胞的漂移,引起机体的免疫失衡,进一步引发的MODS可能是导致复苏后肺组织细胞损伤的首要因素。因此在ROSC后,既可能存在免疫亢进,也可能存在免疫抑制,两者可同时存在,其强弱也处于不断变化之中,机体处于一种复杂的免疫紊乱和失衡状态。因此,相应的免疫治疗也不应只强调抑制炎症反应这一个方面,而在于重建患者的免疫平衡稳态。
综上所述,在心肺复苏后的早期,CPR组小猪的肺组织细胞受到了明显的损伤,同时出现肺组织转录因子GATA-3的上调和T-bet的下调,进一步引起了Th1和Th2类细胞因子的失衡,导致肺组织的免疫功能的抑制,这可能是导致心肺复苏后急性肺损伤的机制之一。
参考文献
[1]Geppert A,Zorn G,Karth GD,et al.Solube selectiarts and the systemic inflammatory response syndrom after successful cardiopulmonary [J].Crit Care Med,2000,28(7):2360-2365.
[2]Welty KE,Carraway MS,Ortel TL,et al. Coagulation and inflammation in acute lung injury [J]. Thromb Haemost, 2002, 88 (1) : 17-25.
[3]张劲松.创伤后急性肺损伤的救治 [J].中华急诊医学杂志, 2011,20(2):223-224.
[4]Schwartz MD,Repine JE. Abraham E. Xanthine oxidase—derired oxygen radicals increase lung cytokine expression in mice subjected to hemorrhagic shock [J]. Am J Respir Cell Mol Biol,1995,12(4):434-440.
[5]Zhu F, Guo GH, Chen W, et al. Effects of bone marrow-derived mesenchymal stemcells engraftment on vascular endothelial cell growth factor in lung tissue and plasma at early stage of smoke inhalation injury[J]. World J Emerg Med, 2010, 1(3): 224-228.
[6]Zhang MY, Li CS, Ji XF, et al. Shen-Fu injection attenuates postresuscitation lung injury in a porcine model of cardiac arrest [J]. Resuscitation, 2012, 83(9):1152-1158.
[7]秦卫兵.Th1和Th2细胞在体内的分化[J].国外医学免疫学分册,2002,25(1):42-44.
[8]Bone RC.Toward a theory regarding the pathogenesis of the systemic inflammatory response syndrome: what we do and do not know about cytokine regulation? [J]. Crit Care Med, 1996, 24(1): 163- 172.
[9]Gu W, Li CS, Yin WP, et al. Apoptosis is involved in the mechanism of postresuscitation myocardial dysfunction in a porcine model of cardiac arrest [J]. Am J Emerg Med, 2012, 30 (9): 2039-2045.
[10]顾伟,李春盛,殷文朋,等. 不同复苏措施对猪心肺复苏后心肌凋亡的影响[J].中华急诊医学杂志,2013, 22(1):11-17.
[11]Gu W, Li C, Yin W, et al. Shen-fu injection reduces postresuscitation myocardial dysfunction in a porcine model of cardiac arrest by modulating apoptosis [J]. Shock, 2012, 38(3):301-306.
[12]施梦, 祝禾辰,曹同瓦.急性肺损伤发病机制研究进展 [J].中华急诊医学杂志,2008, 17(4):443-444.
[13]Miller AC,Rashid RM,Elamin EM.The“T”in trauma:The helper T-cell response and the role of immunomodulation in trauma and burn patients [J].J Trauma,2007,63(6):1407-1417.
[14]Von Boehmer H.Mechanisms of suppression by suppressor T cells [J].Nat Immunol, 2005, 6(4):338-344.
[15]江晓东, 陈惠晓. Th 细胞的分化调控[J]. 国外医学免疫学分册, 2003, 26 (2) :79-82.
[16]Zheng WP,Flavell RA.The transciption factor GATA-3 is necessary and sufficient for Th2 cytokine gene expression in CD4-T cells [J].Cell,1997,89(5):587-597.
[17]Huang M, Dong XQ, Hu YY, et al. High S100B levels in cerebrospinal fluid and peripheral blood of patients with acute basal ganglial hemorrhage are associated with poor outcome[J]. World J Emerg Med, 2010, 1(1): 22-31.
[18]李萍,赵广东,杜立峰.脂质前列腺素E1对急性肺损伤T细胞特异性转录因子T-bet与Gata-3的作用 [J].中华急诊医学杂志,2012,22(2):175-179.
(收稿日期:2013-05-11)
(本文编辑:郑辛甜)
DOI:10,3760/cma,j,issn,1671-0282,2014,01,004
基金项目:国家自然科学基金(30972863);2012北京市优秀博士学位论文专项资金项目(2012-1002501)
作者单位:100020 北京,首都医科大学北京朝阳医院急诊科
通信作者:李春盛,Email:banditgu@hotmail,com
P8-14
