免疫增殖性小肠病一例报告并文献复习
2014-02-08刘爱武
赵 辰,张 倩,刘爱武
免疫增殖性小肠病(immune-proliferative small intestinal disease,IPSID),过去被称为“地中海淋巴瘤(mediterranean lymphoma)”、“α重链病(α-HCD)”,是由Seligmann在1968年首次发现的,其特征为只合成和分泌不完整的免疫球蛋白α重链,而无轻链表达[1]。该病一般发生在10~30岁年龄段;早期出现间歇性腹泻和体质量减轻,以后逐渐加重可致肠梗阻或肠套叠;其主要发生于发展中国家,与经济、卫生等因素有一定关系;病理主要表现为病变组织内非典型免疫细胞浸润[2]。1997年WHO将IPSID归类为结外黏膜相关淋巴组织(MALT)淋巴瘤的一个变种[3]。近来研究发现,空肠弯曲杆菌可能是该疾病的一种特定病原体[4]。IPSID可从一良性且可治愈的疾病演变为恶性疾病,因此对其进行早期的诊断和治疗具有极其重要的意义。复习文献发现,自1983年至今,我国有文献报道的本病共11例,其中6例发生在台湾。本研究回顾性分析1例成人IPSID的诊治过程,并结合文献复习讨论,以加深对该疾病的认识,提高诊治水平。
1 病例简介
患者,男,29岁,因“反复左上腹痛近2个月”于2013-09-22入住我院。患者2月前突现左上腹痛(前期曾连续口服治疗“哮喘”类中药煎剂4 d),呈阵发性绞痛伴局域饱胀感,未伴其他明显腹部不适。起病第4日患者至当地医院就诊并予“输液、解痉”等对症处理;病情持续未见明显缓解,左上腹痛尤以自主进食后明显。行腹部CT平扫示左上腹局域小肠壁显厚并部分肠管扩张积气。1月前患者突现左上腹疼痛加重,遂即住院诊治,住院期间按“克罗恩病”治疗;患者进食后(包括饮水)左上腹痛仍反复出现,保守治疗约3周后,左上腹仍呈阵发性绞痛,疼痛剧烈,伴呕吐,呕吐物为消化液,味苦。近期体质量下降约20 kg。主要查体:腹壁软;左上腹部压痛,并局域出现轻微反跳痛,全腹部触诊未触及明显异常肿物,肝脾未触及;腹部叩诊示鼓音区缩小,肝浊音界正常,肝、肾区无叩痛,移动性浊音(-);肠鸣音显活跃,未闻及振水音及异常血管杂音。复查腹盆腔强化CT:左上腹局域小肠壁显厚并部分肠管扩张积气、肠套叠征象形成。腹部平片示不完全性肠梗阻。实验室检查:血浆纤维蛋白原 3.93 g/L(参考值为3.5 g/L);血浆D-二聚体 1.58 mg/L(参考值为0.55 mg/L);糖类抗原CA50 12.21 U/ml(参考值为10 U/ml)。大便分析:白细胞+/-,隐血试验阳性。
结合患者病情行手术治疗。术中见:盆腔内少量黄色清亮腹腔积液;肝脏与所触及腹膜区未见肿瘤性征象;小肠距Treitz韧带约120 cm处可见一环形缩窄,局部肠壁充血水肿、触之质韧,局域小肠系膜水肿并部分淋巴结肿大(质硬);近侧肠管扩张,肠壁显肥厚。遂行小肠部分切除术。术后患者恢复良好,进食及肛门排气、排便正常。术后病理,肉眼所见:远切线6 cm处查见面积7.0 cm×4.5 cm的糜烂区,病变区小肠壁最厚处0.8 cm,灰白色,质稍脆,较细腻;其近端肠管狭窄,长6 cm,最大周长4 cm,远端肠管扩张,长10 cm,最大周长8 cm,其余黏膜尚光滑。免疫组化染色示:CD20(+)、CD79α(+)、CD5(+)、Mum-1(+)、CD21(+)、CD23(-)、Bcl-6(-)、Bcl-2(-)、CD3部分(+)、CD7部分(+)、κ(+)、λ(-)、CyclinD1(-)、Ki-67阳性率约40%(见图1)。病理诊断:(空肠)符合IPSID。患者术后切口愈合良好,给予换药拆线后按期出院,出院后现已随访8个月,患者未诉明显不适。
2 讨论
2.1 病因及流行病学 IPSID的绝大多数病例发生在中东及地中海地区,至今全世界已有400余例报道。有学者在冷冻的肠组织中找到空肠弯曲杆菌,认为空肠弯曲杆菌是本病的特殊病原体[4]。因早期病例单用抗生素治疗有效,故有人认为IPSID是抗原驱动的肿瘤(Antigen‐drive tumors)[5]。
2.2 临床表现 患者以腹痛、消化不良(体质量减轻和腹泻)、杵状指三联征为特征性症状。大多数IPSID患者都有长期腹泻及小肠吸收不良的临床表现,出现进行性体质量减轻、水肿、腹腔积液,进展期可因肿块或肠套叠等原因导致肠梗阻或穿孔,体检时可发现杵状指或踝部水肿[6]。
2.3 实验室检查
2.3.1 蛋白检查 约半数IPSID患者血清蛋白电泳在β和α2区间出现一宽峰,而非窄底高峰M成分,部分患者血清蛋白电泳正常,或仅表现为低免疫球蛋白血症。免疫电泳和免疫固定电泳可以明显提高检出率,显示出与抗α重链血清反应,而不与抗轻链血清反应的单克隆α重链。少数血清α-HCD蛋白阴性的患者,在小肠分泌液中也可以发现α-HCD蛋白。尿液中α-HCD蛋白浓度极低。特异性检查方法是通过免疫电泳的方法在患者的血清、尿液或胃肠液中找α-HCD蛋白;近2/3患者可在血清和空肠黏膜中检测出α-HCD蛋白,其他1/3患者由于合成后未分泌而检测不出[5]。
2.3.2 影像学及内镜检查 消化道X线钡餐透视常见小肠有黏膜皱襞肥厚、假性多发息肉、多处狭窄或充盈缺损;小肠气钡造影显示肠壁成邮票边齿状改变,是IPSID特有X线表现。内镜检查中常见形态改变为黏膜浸润性改变,包括黏膜皱襞粗糙变形、增厚或消失,肠黏膜散布大小不等的结节、溃疡,肠黏膜花斑状表现,活检时感觉黏膜组织较硬等[1]。
2.4 组织学及免疫表型 IPSID组织学特点与其他黏膜相关淋巴瘤相似,但特征是显著的浆细胞样分化。在IPSID,浆细胞和边缘带细胞表达α重链而没有任何轻链。肿瘤细胞CD20+、CD79a+、CD10-,CD5-、CD23-、CD43+/-、CD11c+/-。肿瘤细胞还表达CD21 和CD35。免疫球蛋白轻链的减少对与良性淋巴细胞浸润的鉴别非常重要。与其他小B 细胞淋巴瘤鉴别的重要点是缺乏特征性标记:CD5 阴性有助于与套细胞淋巴瘤及小淋巴细胞淋巴瘤区别;cyclin D1 是套细胞淋巴瘤的特点;而CD10 阴性可与滤泡性淋巴瘤区别[7]。
2.5 鉴别诊断
2.5.1 克罗恩病 临床主要有腹痛、腹泻、发热、消瘦或体质量下降、贫血、便血和腹部包块等表现,病变常累及回盲部和回肠末端,最常见并发症为肠梗阻、肠瘘;实验室检查主要为C反应蛋白、红细胞沉降率升高;可行内镜及病理检查等明确诊断[8]。
2.5.2 惠普尔病 是以感染为特征的慢性全身性疾病,主要表现为不变形性关节炎、发热、体质量减轻、腹泻等消化道症状;实验室检查主要表现为贫血,淋巴细胞相对减少,红细胞沉降率增快;小肠活检标本的病理检查发现小肠绒毛固有层有过碘酸-雪夫(PAS) 染色阳性物质( 糖蛋白大颗粒) 和大脂滴; 周围淋巴结病理检查也可能会显示含有PAS 染色阳性物质的泡沫状巨噬细胞[9]。
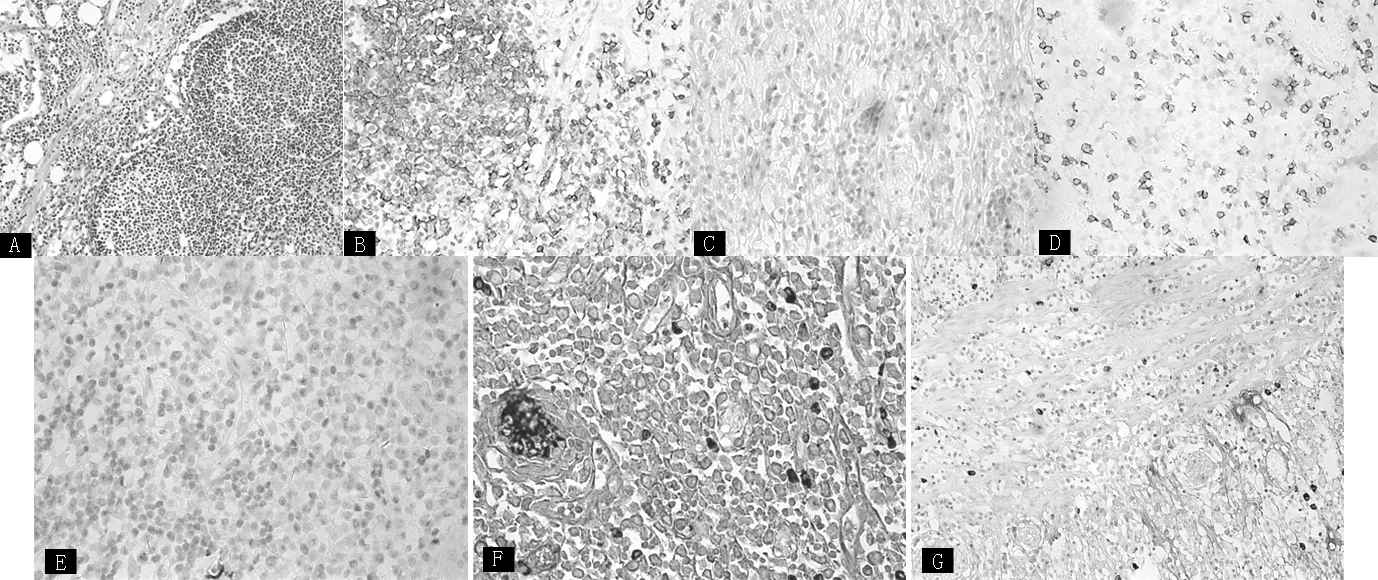
注:图A示病变处小肠黏膜、固有层内广泛浆细胞浸润(HE×200);图B示免疫组化CD20(+)(×400),病变处浸润细胞表现出明显的膜染色反应,提示浸润细胞为B细胞谱;图C示免疫组化CD79α(+)(×200),病变处浸润细胞表现出胞质染色反应,用以识别B细胞及区分B细胞各个阶段;图D示免疫组化CD5(+)(×400),病变处部分细胞膜染色阳性,提示浸润细胞可能来自B-1细胞(B细胞的亚群)或套细胞淋巴瘤;图E示免疫组化CD21(+)(×400),病变处浸润细胞中显示膜染色阳性,提示是成熟的B细胞;图F示免疫组化κ(+)(×400),病变处浸润细胞中显示出明显的膜和细胞质染色反应,提示为含有κ轻链的浆细胞或淋巴样细胞;图G示免疫组化λ(-)(×200),病变处浸润细胞胞质中无阳性反应,提示为不分泌λ轻链的浆细胞或淋巴样细胞病理检查发现小肠绒毛固有层有过碘酸-雪夫(PAS)染色阳性物质(糖蛋白大颗粒)和大脂滴;周围淋巴结病理检查也可能会显示含有PAS染色阳性物质的泡沫状巨噬细胞[9]。
图1 免疫增殖性小肠病病理组织切片
Figure1 The proliferation response of intestinal disease pathology biopsy
2.6 病理及分期 IPSID病理改变分为三期:A期,表现为肠道黏膜固有层成熟浆细胞浸润,部分绒毛萎缩,可累及肠系膜和腹膜后淋巴结;B期,表现为非典型的浆细胞或非典型的免疫母细胞浸润至黏膜下层,绒毛结构消失;C期,表现为小肠和肠系膜淋巴结有明显的免疫细胞淋巴瘤,形成散在的溃疡型肿瘤,可穿破肠壁[6]。
2.7 治疗 若不接受治疗,大多数患者病程呈进展性。但目前尚无标准治疗方案,药物治疗主要包括抗生素治疗和化疗两部分,可按患者的疾病分期选择[2]。
A期患者首选抗生素治疗,单纯使用抗生素即能诱导IPSID相关IgA重链病临床、组织学和免疫学表现完全缓解[10]。患者若经抗生素治疗3个月内不见效或已确定为IPSID或伴有淋巴瘤时,应采用与淋巴瘤相同的化疗方案,即CHOP〔环磷酰胺、多柔比星(阿霉素)、长春新碱、泼尼松〕或MOPP〔氮芥、长春新碱、丙卡巴肼(丙卡巴肼)、泼尼松〕。化疗常可取得疗效,但对于处于病程晚期(病理C期)已有淋巴瘤的患者,化疗取得缓解后易复发,所以对此类患者可考虑强烈化疗及放射治疗,后辅以自体骨髓移植治疗[6]。
IPSID的淋巴细胞肿瘤成分表达CD20,但浆细胞肿瘤成分不表达CD20,因此抗CD20单克隆抗体对于IPSID的疗效尚需临床试验证实。部分浆细胞或者淋巴样浆细胞成分较多的病例是否可以参考多发性骨髓瘤的治疗方案,也值得进一步研究。手术治疗仅用于缓解病变引起的肠梗阻,或者用于明确诊断和分期。当发现点状或者大的透壁病变时,也可考虑外科切除,以防止在化疗时出现穿孔[2]。
1 李健丁,靳宏星,武志峰.胃肠道间质瘤影像诊断[M].北京:人民卫生出版社,2009:85-87.
2 沈志祥,朱雄增.恶性淋巴瘤[M].2版.北京:人民卫生出版社,2011:510-512.
3 李涤臣.非霍奇金淋巴瘤WHO新分类简介[J].临床与实验病理学杂志,1999,16(1):74-77.
4 Mrabti H,Raiss G,Raissouni S,et al.Intestinal non-Hodgkin lymphoma:“immunoproliferative small intestinal disease”[J].Presse Médicale(Paris,France:1983),2011,40(11):995-1000.
5 欧阳钦.消化系统疾病查房释疑[M].2版.北京:人民卫生出版社,2009:164-166.
6 王树叶,王晨.淋巴瘤简明诊疗策略[M].北京:人民卫生出版社,2013:75-82.
7 肖志坚.血液病合理用药[M].2版.北京:人民卫生出版社,2009:314-316.
8 陆星华.克罗恩病的诊治进展[J].现代消化及介入诊疗,2010,5(4):40-45.
10 李金梅,周晋.简明血液病学[M].北京:人民卫生出版社,2010:272-274.
