大力参急性毒性与遗传毒性试验研究※
2014-02-07杨晓峰陈文学陈志福杨
杨晓峰陈文学陈志福杨 明*
(1通化兴华药业有限责任公司,通化134008;2吉林省中医药科学院新药研究开发中心,长春130021)
大力参急性毒性与遗传毒性试验研究※
杨晓峰1陈文学2陈志福1杨 明2*
(1通化兴华药业有限责任公司,通化134008;2吉林省中医药科学院新药研究开发中心,长春130021)
目的 了解大力参急性毒性及遗传毒性,为大力参的食用安全性提供实验依据。方法 采用小鼠及大鼠急性经口毒性试验; Ames试验(每皿分别加入8、40、200、1000、4000μg大力参)、小鼠骨髓细胞微核试验与小鼠精子畸形试验对大力参遗传毒性进行评价。结果 大力参经口最大耐受剂量(MTD)均大于16.2g/kg。3项遗传毒性试验的结果均为阴性。结论 在本实验条件下大力参对小鼠及大鼠经口急性毒性试验未见毒性反应,同时未见遗传毒性作用。
大力参;急性毒性;遗传毒性
大力参又称为烫通参或烫参,是将新鲜的人参用沸水浸煮或汽烫后晒干而成。大力参是介于生晒参和红参之间的一种人参制品,所以,大力参具有生晒参和红参的双重特点,其外皮类似生晒参,肉质类似红参样。本文参照《新资源食品安全评价规程》[1]及《GB15193.1-2003食品安全性毒理学评价程序》[2]的要求,通过急性毒性试验与遗传毒性试验对大力参的毒理学进行了初步研究,可作为其食用的安全性依据[3]。
1 材料与方法
1.1 受试物 大力参由中国农业科学院左家特产研究所提供,粉碎,过100目筛,试验时用蒸馏水配制成所需浓度。
1.2 试验动物与环境 清洁级昆明种小鼠与Wistar大鼠,购自吉林大学基础医学院动物实验中心。动物合格证号:SCXK(吉)-2003-0001。试验期间动物饲养环境为:温度(23±1)℃;相对湿度(50±10)%。
1.3 菌株 试验菌株均由华西医科大学公共卫生学院检测中心提供,4种菌株分别为TA97、TA98、TA100、TA102。
1.4 实验方法[4]
1.4.1 大鼠急性毒性试验 取大鼠40只,雌雄各半,重130~140g,根据体质量随机分为2组(对照组与大力参组),首次给药前禁食16h,24h内灌胃给予大力参3次(给药浓度为0.27g/ml,给药体积为20ml/kg·次),累计给药量为20.4g/kg,对照组给予同体积蒸馏水。给药后,连续14d内观察并记录大鼠中毒表现以及死亡等情况。
1.4.2 小鼠急性毒性试验 取40只小鼠,雌雄各半,重18~20g,根据其体质量随机分为2组(对照组与大力参组),于24h内灌胃给药3次(第一次给药前禁食16h),给药浓度为2.7g/10ml,给药体积为40ml/kg·次,对照组给予同体积蒸馏水。给药后连续观察14d内小鼠的外观体征、行为活动、精神状态、饮水进食、粪便、呼吸、腺体分泌、体质量变化及死亡等情况。
1.4.3 Ames试验 采用经鉴定符合要求的鼠伤寒沙门氏菌组氨酸缺陷型四种菌株进行试验。本次试验采用平板掺入法,每种大力参受试品设配置成(含生药量)8、40、200、1000、4000μg/皿共设5个剂量组;同时设溶剂对照组(蒸馏水)、10%S9混合液为S9对照组;叠氮钠(NaN3,20μg/皿)、敌克松(Dexon,50μg/皿)、2-氨基芴(2-AF,20μg/皿)、丝裂霉素C(MMC,20μg/皿)和1,8-二羟基蒽醌(50μg/皿)为阳性突变对照组。在底层培养基平皿上写上编号,取已融化并在45℃水浴中保温的顶层培养基(2ml),依次加入受试物溶液0.1ml,测试菌液0.1ml,0.2mol·L-1磷酸缓冲液0.5ml(活化试验时加10%S9混合液0.5ml),迅速混匀,倾于底层培养基上,转动平皿使顶层培养基均匀分布在底层上,平放固化,37℃培养48h观察结果。非活化试验(-S9)和活化试验(+S9)同时进行,每个剂量做三个平行皿,试验重复二次。
1.4.4 小鼠骨髓细胞微核试验 取体质量25~30g小鼠50只,根据其体质量随机分为5组,每组10只,雌雄各半,即大力参受试品4.0g/kg、2.0g/kg、1.0g/kg三个剂量组,蒸馏水阴性(0.2ml/10g)对照组,环磷酰胺(40mg/kg)阳性对照组。各组受试物均按0.02ml/g体积,分两次(间隔24h)口服灌胃给药,第二次给药后6h断颈法处死动物。环磷酰胺组口服灌胃1次,给药后24h处死。取股骨的骨髓加小牛血清混匀后推片,用甲醇溶液固定15min,使用吉姆萨液染色40min。光学显微镜下,每只鼠计数1000个骨髓嗜多染红细胞(PCE),观察含微核的PCE数(一个细胞内可出现一个或多个微核,但都按一个细胞计),计算其微核出现率(MNF),以‰表示。并且计数200个细胞中PCE/NCE(正染红细胞)的比值。
1.4.5 小鼠精子畸形试验 取雄性小鼠25只,体质量为25~35g,根据其体质量随机分为5组,每组5只,即大力参受试品4.0g/kg、2.0g/kg、1.0g/kg三个剂量组,蒸馏水阴性(0.2ml/10g)对照组,环磷酰胺(60mg/kg)阳性对照组。各组受试物均按20ml/kg体积灌胃给药,每天给药1次,连续5d。首次给药后第35d处死动物,取出双侧附睾放入盛有1ml生理盐水的24孔细胞培养板中,用镊子轻轻撕开附睾表面包膜、轻轻摇动附睾组织后、静置5~10min,然后用镊子夹去组织碎片。轻轻吹打悬液,用加样器吸取100μl精子悬液滴在24孔细胞培养板中,每孔精子悬液中加入0.06ml 1%伊红染液混匀染色15~20min后,取1滴于清洁的玻片上,均匀推片,空气自然干燥,用中性树脂封片每个精液样本制片2张。在高倍镜下检查精子的形态,每只动物计数1000个结构完整的精子,计算畸变精子发生率(%)。
1.5 统计学方法 精子畸形试验数据采用秩和检验;其他试验数据均采用t检验。
2 结果
2.1 大鼠急性毒性试验 给药后14d内,大鼠未见明显中毒症状,且无一例死亡。14d后处死动物,肉眼观察大鼠各脏器未见异常。因给药体积与浓度均已达最大限度,故大力参灌胃给药大鼠的最大耐受剂量大于16.2g/kg,表明其无急性毒性作用。大鼠体质量增长情况见表1。
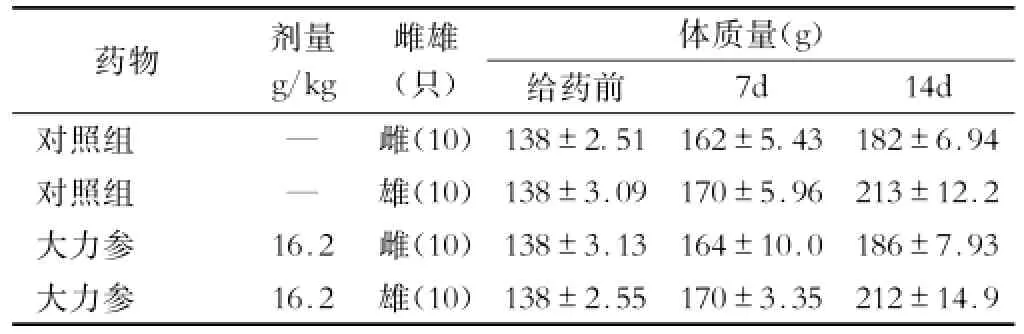
表1 大力参对大鼠急性毒性体质量增长的影响(x±s)
2.2 小鼠急性毒性试验 给药后小鼠未见中毒症状,小鼠无一例死亡。14d后处死动物,大体观察小鼠各脏器均未见异常。给药体积与浓度均已达最大限度,故未能求出小鼠灌胃给药大力参的半数致死量。本品灌胃给药小鼠的最大耐受剂量大于32.4g/kg,表明其无急性毒性作用。小鼠体质量增长情况见表2。
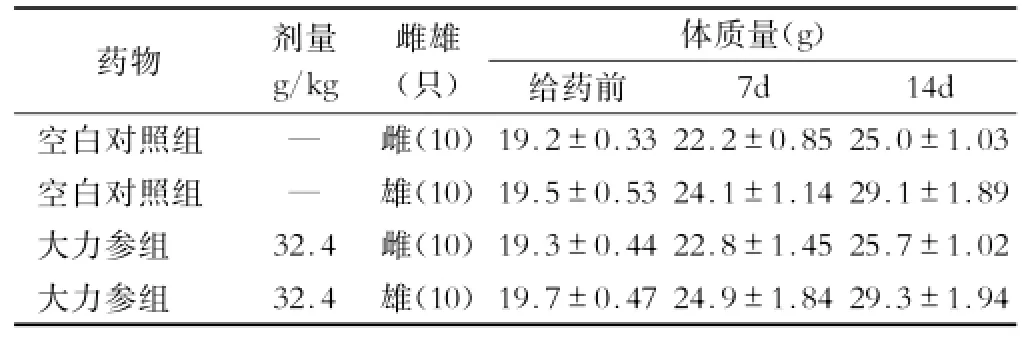
表2 大力参对小鼠急性毒性体质量增长的影响(x±s)
2.3 Ames试验 大力参受试品对TA 97、TA 98、TA 100、TA 102四种试验菌株,在加与不加S9混合液条件下均未引起基因组碱基置换或移码突变,受试各剂量组、溶剂对照组及S9对照组对TA 97、TA 98、TA 100、TA 102菌株的回变菌落数同自发回变组菌落数相比无统计学差异,且无剂量-反应关系。受试组与阳性对照组相比差异均非常显著。重复试验结果相同。表明大力参A-mes试验结果为阴性。试验结果见表3、表4。
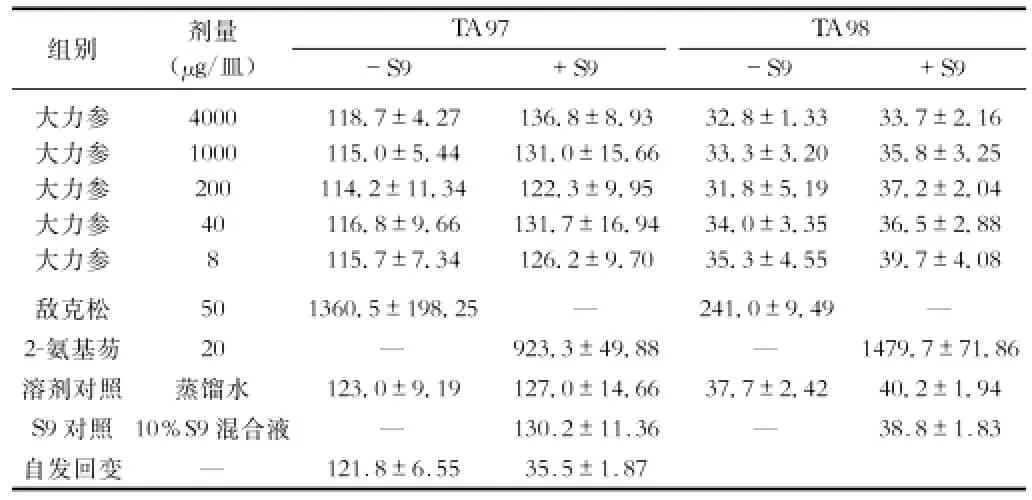
表3 大力参供试品的Ames试验结果(x±s,n=6)
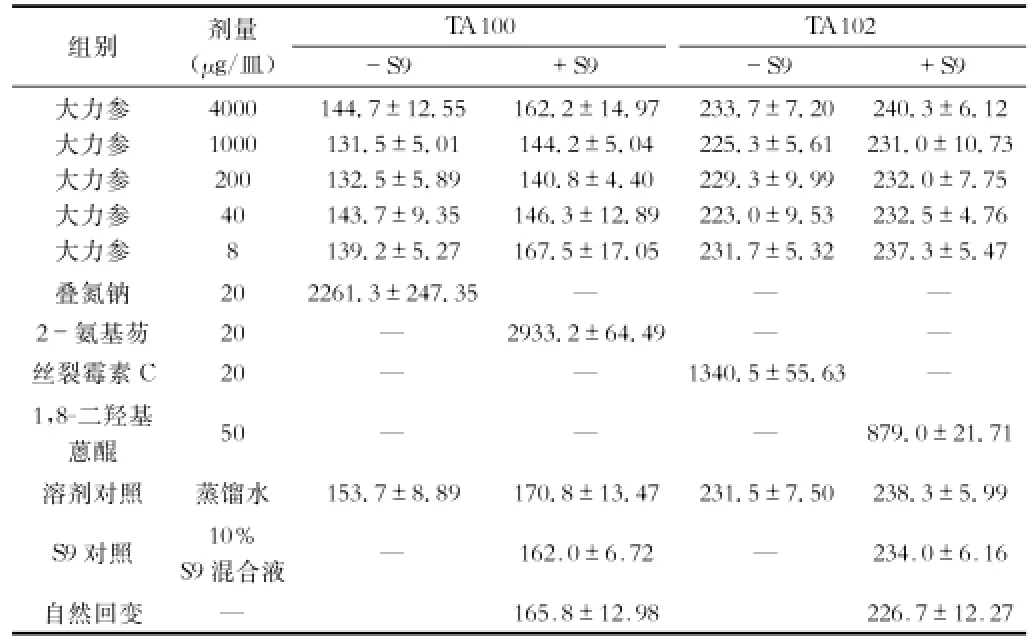
表4 大力参供试品的Ames试验结果(x±s,n=6)
2.4 小鼠骨髓细胞微核试验 大力参各剂量组的小鼠骨髓细胞微核发生率与阴性对照组比较均无统计学差异(P>0.05),各剂量组与环磷酰胺对照组比较则差异显著(P<0.01)。各组PCE/NCE比值均在正常范围内。表明大力参对小鼠骨髓嗜多染红细胞无诱发微核作用。结果见表5。
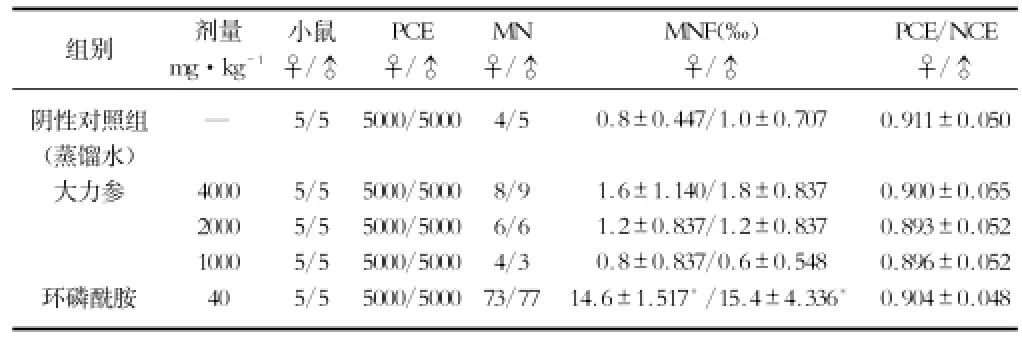
表5 大力参对小鼠骨髓细胞微核发生率的影响(x±s)
2.5 小鼠精子畸形试验 大力参受试品各剂量组小鼠精子畸形率与阴性对照组比无显著差异(P>0.05),阴性对照组和大力参各剂量组精子畸形率均显著低于阳性对照药环磷酰胺(P<0.01)。提示大力参对小鼠精子无致畸变作用。结果见表6。
表6 大力参对小鼠精子发生率的影响,n%)
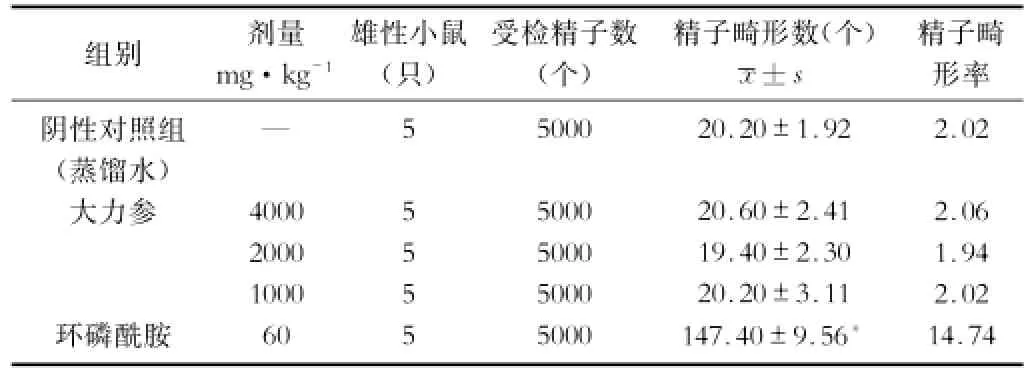
表6 大力参对小鼠精子发生率的影响,n%)
注:*与阴性对照组比较,P<0.01
组别剂量mg·kg-1雄性小鼠(只)受检精子数(个)精子畸形数(个)精子畸x±s 形率阴性对照组(蒸馏水)大力参—500020.20±1.922.02 2.06 1.94 2.02环磷酰胺14.74 4000 2000 1000 60 55555 5000 5000 5000 5000 20.60±2.41 19.40±2.30 20.20±3.11 147.40±9.56*
3 讨论
采用Ames试验,通过突变的测试菌株,观察大力参在基因水平上对遗传物质受损情况;微核试验是一种快速检测染色体是否受到损伤的方法,用于鉴别对细胞遗传物质有损伤作用或干扰细胞有丝分裂的有毒物质;小鼠精子畸形试验通过观察精子形态,检测受试物能否破坏精子正常形态的方法,检查雄性哺乳动物精子畸形率的高低[5-6]。三项试验可从体内、体外较全面的反应化学物对原核细胞与真核细胞、体细胞与生殖细胞的遗传毒性。实验结果表明,大力参无急性毒性反应,最大耐受剂量大于16.2g/kg。本实验条件下3项遗传毒性试验结果均为阴性。因此,我们认为上述的试验结果可以为大力参的食用安全性提供一定的依据。
[1]中华人民共和国卫生部.新资源食品安全性评价规程[S].2007.
[2]中华人民共和国卫生部.食品安全性毒理学评价程序和方法[S].2003.
[3]国家新药审评中心.药物遗传毒性研究技术指导原则[S].2007:6-10.
[4]张涛,迟晓星,于利民,等.大豆异黄酮的毒理学安全性评价[J].齐齐哈尔医学院学报,2011,32(6):851-852.
[5]于燕,周玲,李安静.山泽减肥食品的毒理学安全性评价[J].西安交通大学学报·医学版,2004,25(2):162-164.
[6]王心如.毒理学基础[M].4版.北京:人民卫生出版社,2003:136.
Study on Acute Toxicity and Genetic Toxicity of Boiled Ginseng
Yang Xiaofeng1Chen Wenxue2Chen Zhifu1Yang Ming2✫
(1 Tonghua Xinghua Pharmaceutical Co.,Ltd.,Tonghua,Jilin Province,134008,China; 2 New D rug Research Center of Jilin Academy of Chinese Medicine Science,Changchun,Jilin Province,130021,China)
Objective To determine the acute toxicity of boiled ginseng and provide experimental basis for its application.Methods Acute toxicity test was performance in mice and rats.The genetic toxicity of boiled ginseng was evaluated by Ames test(boiled ginseng at 4000,1000,200,40, 8μg each dish),bone marrow micronucleus test and sperm shape abnormality test in mice.Results The acute oral maximum dose of boiled ginseng was greater than 16.2g/kg.Ames test,micronucleus test and sperm shape abnormality test shoved negative results.Conclusion Boiled ginseng was classified as non-toxic substance.It did not produce genetic toxicity.
Boiled ginseng;Acute toxicity test;Genetic toxicity test
10.3969/j.issn.1672-2779.2014.01.097
1672-2779(2014)-01-0152-03
��吴义红 本文校对:于 艳
2013-11-05)
吉林省科技支撑计划项目[No:20086042]
*通讯作者
